添加菊粉改善藻源虾青素在机体的生物利用度
李春君,高远,郇宇晨,徐杰,薛长湖,2,唐庆娟*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003)
(2.海洋国家实验室海洋药物与生物制品功能实验室,山东青岛 266237)
虾青素是一种非维生素A原脂溶性酮式类胡萝卜素,以其优异的抗氧化能力著称[1]。虾青素主要以虾青素酯的形式存在于虾蟹等海洋生物以及特定的微生物中。雨生红球藻来源的虾青素是人类目前作为膳食补充剂的主要来源[2]。藻源虾青素主要以虾青素酯的形式存在,其中虾青素单酯的含量高达71%左右,游离虾青素的含量仅占约1%[3]。2010年,美国食品药品监督管理局(FDA)将从雨生红球藻来源的虾青素列为“一般安全的”(Generally Recognized as Safe,GRAS)的物质。同年,我国将含有较高含量虾青素的雨生红球藻列入“新资源食品”之中[4]。
作为一种脂溶性物质,目前的研究认为藻源虾青素在机体内的吸收方式与脂质类似。根据叶黄素酯[5]及其他脂质在体内的吸收推测,虾青素酯首先在相关酶的作用下水解成游离虾青素。而游离虾青素主要在小肠中的空肠段吸收,在小肠中,虾青素与胆盐、游离脂肪酸等形成混合胶束。虾青素被吸收入肠上皮细胞后,会与其他脂类物质、胆汁等形成乳糜微粒,经淋巴和血液输送到肝脏。在肝脏中,脂肪酶会消化乳糜微粒,之后被相关的脂蛋白重新分泌,进一步分布到其他组织和器官中[6]。然而,虾青素的口服生物利用度较低[7],且在不同个体间存在着巨大的吸收差异[3]。近年来,也有相关的文献指出,脂质的吸收与肠道菌群间存在着密切的联系[8]。有研究报道,藻源虾青素会改变肠道菌群的结构[9,10],肠道菌群的差异可能是虾青素在不同个体吸收间存在差异的原因。
益生元是一类人体不消化或者难消化的食物成份,能够选择性地刺激结肠中具有生理活性细菌的生长。有益生元功能的物质主要是一些非(或)消化性低聚糖,如低聚果糖、菊粉、低聚木糖、低聚壳聚糖(壳寡糖)等[11]。益生元可以促进肠道内对人体有益的细菌生长繁殖,提高机体的免疫力,优化菌群的平衡。益生元通过调节肠道菌群可以影响机体的糖代谢[12]和脂代谢[13]。此外,益生元的补充还可以促进机体对于铁[14]、钙[15]等矿物质的吸收。
因此,本研究拟采用小鼠模型,在膳食中添加三种常见的益生元(低聚果糖、壳寡糖、菊粉)来探究其对藻源虾青素在机体吸收内的影响。本研究为提高藻源虾青素的生物利用度、相关益生元虾青素复合产品的开发提供了科技支撑和新的思路。
1 材料与方法
1.1 材料与试剂
雨生红球藻来源的天然虾青素油(虾青素质量分数10%),云南爱尔发生物技术股份有限公司。菊粉、低聚果糖、壳寡糖,上海源叶生物科技有限公司;脂肪酶(Elisa)试剂盒,上海艾莱萨生物科技有限公司;甲醇(色谱纯),德国Merck公司;甲基叔丁基醚(色谱纯),赛默飞世尔科技(中国)有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Millipore Q纯水机,美国Millipore公司;Neofuge 23R型高速冷冻离心机,上海力申科学仪器有限公司;CP224C电子天平,奥豪斯仪器(上海)有限公司;SPARK 10M酶标仪,帝肯(上海)贸易有限公司;YMC-Carotenoid-C30色谱柱(4.6 mm×250 mm,5 μm),日本YMC株式会社;1260 Infinity高效液相色谱仪,配置极管阵列检测器(DAD),安捷伦科技(中国)有限公司;6890 Series气相色谱仪,安捷伦科技(中国)有限公司;NovaSeq6000测序平台,美国Illumina公司。
1.3 实验方法
1.3.1 动物饲养与取样
第一组动物实验:24只雄性C57BL/6J小鼠(SPF级,四周龄)购自浙江维通利华实验动物技术有限公司[生产许可证号:SCXK(浙)2019-0001],该实验规程已获得中国海洋大学食品科学与工程学院动物伦理审查会批准(伦理实验许可证号:SPXY2020061603)。适应性暂养一周后根据体质量随机分成4组:正常组(NCA)、菊粉组(InA)、壳寡糖组(ChA)、低聚果糖组(FOA),每组6只。正常组饲喂标准饲料(AIN93G标准饲料),其他各组饲料在标准饲料的基础上添加2%相应的受试物,饲养2周后将小鼠禁食10 h,之后单次灌胃溶解在大豆油中的天然虾青素油,参考周庆新等[16]的灌胃剂量,为50 mg/kg(以小鼠体质量为基准计)。喂养条件:温度22±2 ℃,湿度65%±15%。每两天记录一次体质量和摄食量,灌胃结束之后于0~4 h、4~8 h、8~12 h、12~24 h、24~36 h、36~48 h、48~72 h取小鼠粪便。处死小鼠后取小肠,肝脏等组织,-80 ℃冰箱保存。
第二组动物实验:120只雄性C57BL/6J小鼠(SPF级,四周龄)购自北京维通利华实验动物技术有限公司[生产许可证号:SCXK(京)2016-0006],该实验规程已获得中国海洋大学食品科学与工程学院动物伦理审查会批准(伦理实验许可证号:SPXY2020082601)。适应性暂养一周后根据体质量随机分成2组:正常组(NCA)、菊粉组(InA),每组60只。正常组饲喂标准饲料(AIN93G标准饲料),菊粉组饲料在标准饲料的基础上添加2%菊粉,两组之间仅饲料组成存在差异。饲养两周,两组小鼠禁食10 h后,灌胃溶解在大豆油中的天然虾青素油,灌胃剂量参考Gao等[3]的实验设置,均为100 mg/kg(以小鼠体质量为基准计)。在灌胃0、2、4、8、12、16、20、24、48、72 h后,每组每个时间点取6只小鼠,摘眼球取血并处死。血液于室温放置30 min后,离心分离血清,于-80 ℃保存。分离小鼠肝脏。实验全部样品冻于-80 ℃保存。
1.3.2 不同时间粪便中虾青素含量及生物可接受率的测定
第一组动物实验中的小鼠单次灌胃藻源虾青素后,正常进食进水,在0~4 h、4~8 h、8~12 h、12~24 h、24~36 h、36~48 h、48~72 h收集小鼠粪便,真空冷冻干燥。研磨并充分混匀,记录总重。称取约60 mg于10 mL离心管中,加入1 mL甲醇和2 mL氯仿溶液,涡旋5 min,静置10 min。加入1 mL水,涡旋5 min,8 000 r/min离心10 min。离心后小心吸取下层有机相,重复提取3次,合并提取液,氮气吹干。用1 mL色谱级甲醇/甲基叔丁基醚(1:1,V/V)复溶,经0.22 μm有机滤膜过滤,置于棕色液相样品瓶中。参考之前测定虾青素的方法于3 d内进行高效液相色谱(HPLC)分析[17],测定粪便中游离虾青素含量及虾青素总量。实验过程尽量低温避光操作。
参考Failla等[18]提出的方法,生物可接受率的计算公式如公式(1)。

式中:
S——生物可接受率,%;
G——灌胃量,g;
P——总排泄量,g。
1.3.3 脂肪酶活力的测定
取小肠中的空肠段(4 cm左右)准确称量其质量,按照1∶9(m/V)的比例加入生理盐水,在低温条件下机械匀浆,制成10%的匀浆。按照试剂盒说明书进行测定。
1.3.4 血清中虾青素代谢时间曲线的测定
参照周庆新等[16]的方法,并进行适当修改。吸取200 μL血清置于4 mL离心管中,加2 mL甲醇后涡旋30 s混匀。再加入2 mL的氯仿,涡旋30 s,静置10 min。加1.8 mL水,涡旋混匀至呈现乳白色。8 000 r/min条件下离心10 min,使其分层,吸管吸取下相。重复萃取三次,合并下层有机相,氮气吹干。用200 μL以1∶1(V/V)混合的甲醇和甲基叔丁基醚混合液复溶。滤膜过滤后进入液相小瓶中,尽快进行HPLC-DAD分析。
1.3.5 肝脏中虾青素代谢曲线的测定
取0.1 g肝脏样品置于组织匀浆器中,加入1.2 mL甲醇。研磨均匀后,加入2.4 mL氯仿。继续研磨均匀,涡旋30 s,旋转混匀仪旋转30 min使其充分混匀。加入0.96 mL超纯水,涡旋30 s。离心机8 000 r/min离心10 min,吸管吸取下层有机相,置于另一离心管中。原离心管上层加入2.4 mL氯仿再次提取,合并下层有机相后用氮气吹干。吹干后用200 μL的甲基叔丁基醚和甲醇混合液(1∶1,V/V)复溶,滤膜过滤后进入液相小瓶中。尽快进行HPLC-DAD分析。
1.3.6 粪便SCFA含量的测定
称取小鼠粪便样品约0.2 g,加入1 200 μL超纯水,充分震荡1 min,混匀。加入浓H2SO4调节pH值(2~3),室温下放置5 min,每分钟震荡一次,5 000g离心10 min。收集上清液,取500 μL上清,加入50 μL稀释100倍(V/V)的内标二乙基丁酸和500 μL无水乙醚,充分混匀。5 000g离心10 min,吸取1.0 μL乙醚层用于气相色谱分析[19]。
1.3.7 16S rRNA测序分析
利用试剂盒提取粪便中的DNA,琼脂糖凝胶电泳检测DNA的纯度和浓度。以稀释后的基因组DNA为模板,采用细菌515F/926R引物扩增16S rRNA的V4~V5高变区序列。PCR产物使用质量分数2%的琼脂糖凝胶进行电泳检测。根据PCR产物质量分数进行等量混样,质量分数2%琼脂糖凝胶电泳检测PCR产物。对目的条带使用Qiagen公司提供的胶回收试剂盒回收产物。使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建。构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq6000进行上机测序。根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,截去Barcode和引物序列后使用FLASH对每个样本的reads进行拼接,得到的拼接序列为原始Tags数据(Raw Tags)。拼接得到的Raw Tags,需要经过严格的过滤处理,得到高质量的Tags数据(Clean Tags)。Tags序列通过与物种注释数据库进行比对检测嵌合体序列,并去除其中的嵌合体序列,得到最终的有效数据(Effective Tags)。利用Uparse软件对所有样本的全部 Effective Tags进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units)。最后,对各样本的数据进行均一化处理,以样本中数据量最少的为标准进行均一化处理。后续的Alpha多样性分析和Beta多样性分析都是基于均一化处理后的数据。
1.4 数据处理
文中的数据均以Mean±SEM(±s)表示,所有实验数据均用SPSS 19.0软件进行统计分析。作图均采用GraphPad Prism 8.0专业软件,组间差异采用单因素方差分析(One-way ANOVA)。以p<0.05表示差异有统计学意义,p<0.01为极显著。
2 结果与分析
2.1 三种益生元对于正常小鼠体质量、摄食量的影响
研究表明,一些益生元如低聚果糖等对于调节肥胖小鼠血糖、血压,降低胆固醇有较好的效果[20]。在本实验中,将3种益生元喂给正常小鼠。结果显示,在两周的时间内,补充菊粉、壳寡糖和低聚果糖不会显著影响正常小鼠的体质量和摄食量(如图1所示)。其中,正常组小鼠体质量比初始时上升了23.09%,菊粉组上升了20.28%,壳寡糖组上升了21.46%,而低聚果糖组仅上升了18.31%。与正常组小鼠相比,饲喂了三种益生元的小鼠体质量存在下降的趋势,其中低聚果糖下降趋势较大。

图1 菊粉、壳寡糖、低聚果糖对于正常小鼠体质量和摄食量的影响Fig.1 Effects of inulin, chito-oligosaccharides and fructose-oligosaccharides on body weight and food intake in normal mice
2.2 三种益生元对于藻源虾青素在小鼠体内生物可接受率的影响
生物可接受率是指某种物质有机会可以被生物机体利用的量占总摄入总量的百分比[21]。实验结果表明,正常小鼠单次灌胃剂量为50 mg/kg(以小鼠质量为基准计)的藻源虾青素之后,其生物接受率约在40%~50%之间。这与Gao等[3]研究发现藻源虾青素在机体内的生物可接受率的结果较为一致。与正常组相比,菊粉、壳寡糖对于藻源虾青素在机体内的生物可接受率并无显著影响(图2)。然而,在膳食中添加低聚果糖之后,显著降低了虾青素的生物可接受率,降低至32.92%。低聚果糖的添加不利于藻源虾青素在机体内的吸收(p<0.01)。四组小鼠的生物可接受率的变化趋势与体质量增加量变化趋势较为一致,与其他四组小鼠相比,低聚果糖组小鼠的体质量增长最小,可能与低聚果糖促使肠道蠕动增快,食物在肠道中停留时间缩短有关[22],这大大不利于藻源虾青素在机体内的吸收利用。然而,膳食中添加菊粉和壳寡糖对藻源虾青素生物利用度的影响有待进一步探究。

图2 菊粉、壳寡糖、低聚果糖对于藻源虾青素在正常小鼠体内生物可接受率的影响Fig.2 Effects of inulin, chito-oligosaccharides and oligosaccharides on bioacceptability of algae-derived astaxanthin in normal mice
2.3 三种益生元对不同时间小鼠粪便中虾青素含量及小肠脂肪酶的影响
单次灌胃藻源虾青素后,在不同时间点取四组小鼠的粪便冷冻干燥后记录总质量,研磨混匀并取约60 mg提取粪便中的虾青素并进行液相分析[3]。由图3a可知与对照组相比,菊粉组和壳寡糖组在不同时间点粪便中虾青素的量并无显著差异,而低聚果糖组在24~36 h时,小鼠体内虾青素的减少量高于正常组,在该时间内粪便中的虾青素大量排出。藻源虾青素需要先水解为游离虾青素才能够被机体吸收和利用[1,16],因此对粪便中游离虾青素含量进行了分析。由表1和图3b可知,各组小鼠粪便中的游离虾青素的含量随着时间的变化逐渐升高,而在8~12 h内,各组粪便中游离虾青素的含量均呈现快速增长。菊粉组和壳寡糖组在48 h内游离虾青素的含量均高于正常组。菊粉组小鼠粪便中游离虾青素含量在各时间点均高于正常组,菊粉组在8~12 h内的游离虾青素含量与正常组在12~24 h的含量相当。同时,在12~24 h内,菊粉组小鼠粪便中游离虾青素的含量显著高于对照组,提高了43.23%(p<0.05)。上述结果表明,在膳食中添加菊粉,可提高小鼠粪便中游离虾青素的含量。
有文献报道指出,脂肪酶可以水解虾青素酯[23]。因此,检测了空肠中的脂肪酶活力。由图3c可知,三种益生元组小鼠肠道脂肪酶活力并无显著性变化,反而有下降的趋势,这与文献报道益生元可以降低模型组小鼠脂肪酶的活力类似[24,25]。机体内的脂肪酶活力并不是导致菊粉组小鼠粪便游离虾青素含量升高的原因。

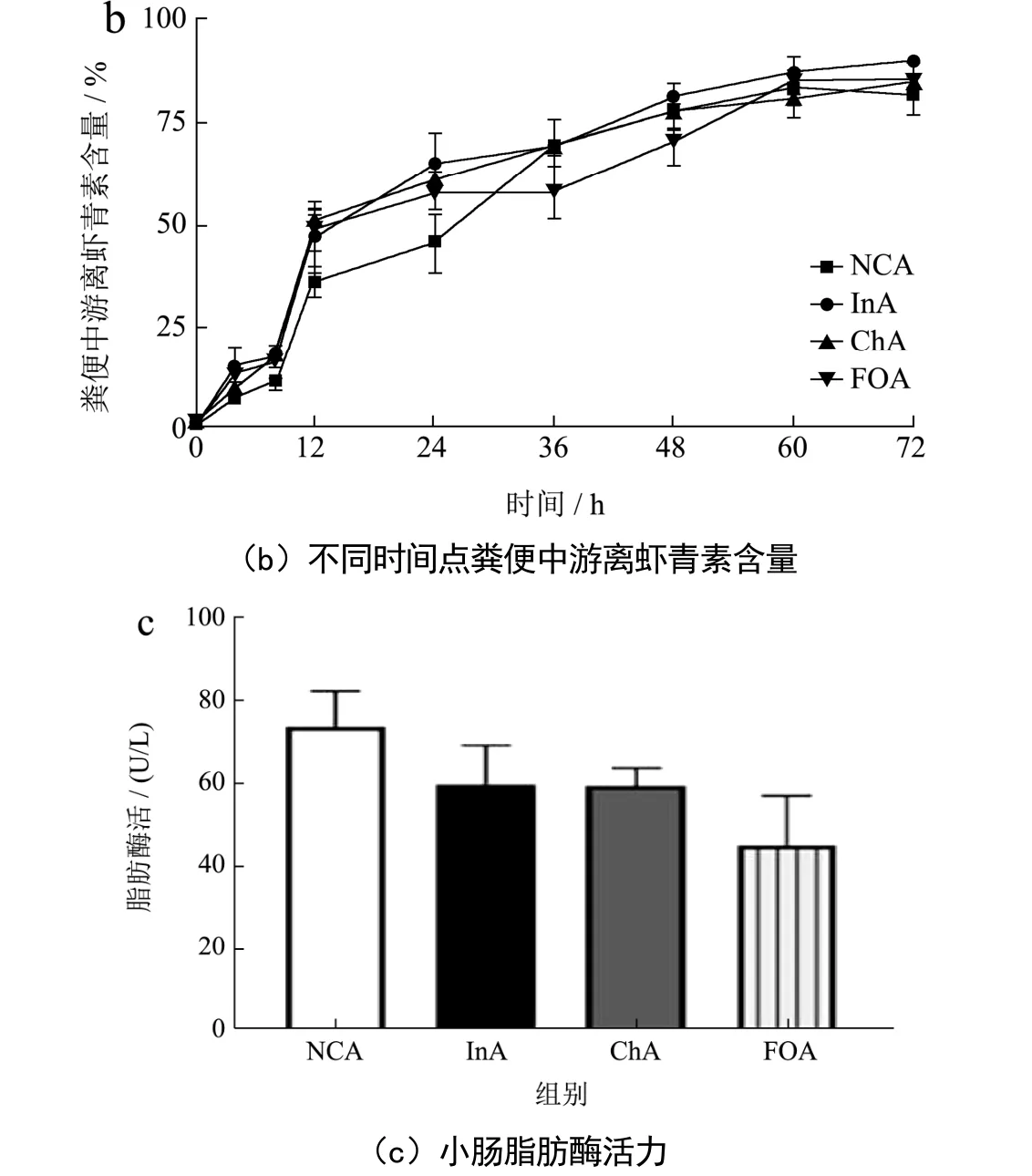
图3 菊粉、壳寡糖、低聚果糖对不同时间小鼠粪便虾青素的含量及小肠脂肪酶的影响Fig.3 Effects of inulin, chitosaccharide and oligosaccharide on astaxanthin content in feces and lipase in small intestine of mice at different time
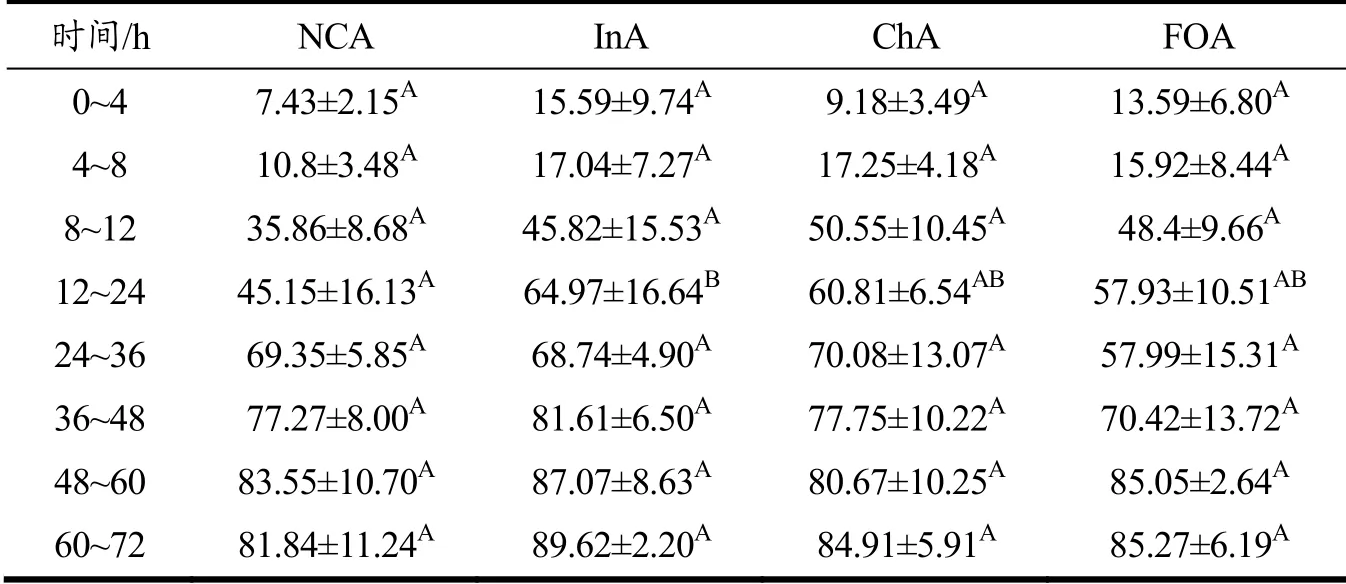
表1 不同时间点各组小鼠粪便中游离虾青素的相对含量(%)Table 1 Relative contents of free astaxanthin in feces of mice at different time points (%)
2.4 菊粉对虾青素血清和肝脏代谢曲线的影响
由于菊粉组小鼠粪便中的游离虾青素含量较高,因此进行了第二批动物实验以探究菊粉的摄入对藻源虾青素生物利用度的影响。单次灌胃藻源虾青素后,检测72 h内两组小鼠的血清和肝脏中的虾青素含量。如图4a和图4b所示,菊粉组小鼠血清和肝脏中的虾青素浓度变化趋势与正常组一致。饲喂菊粉后,该组小鼠对于藻源虾青素的生物利用度有所提高。表2和表3分别是血清和肝脏的药代动力学参数。由表2可知,两组小鼠的血清中虾青素峰值浓度差别不大,达峰时间均在20 h,菊粉组小鼠的曲线下面积(AUC)比正常组提高10.84%。与一般的类胡萝卜素不同,藻源虾青素的达峰时间高达20 h,这与以往的研究一致[3],推测这可能是由于虾青素酯需要先水解为游离虾青素才能被机体吸收和利用。由表3可知,虾青素在肝脏中的变化趋势与血清相一致,菊粉组小鼠的曲线下面积(AUC)显著高于正常组小鼠,比正常组提高了36.37%。以上结果提示,膳食添加菊粉改善了藻源虾青素在机体内的吸收和利用。
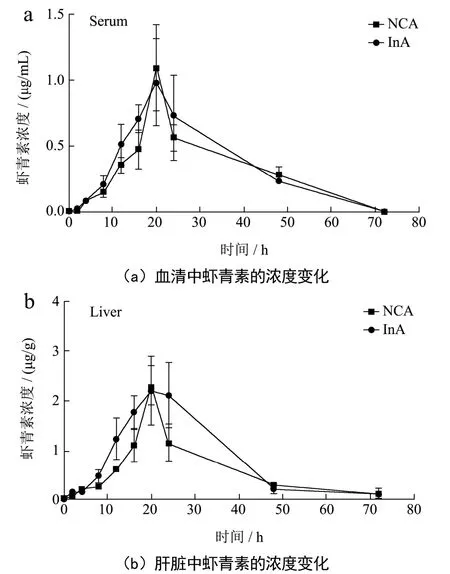
图4 菊粉对血清和肝脏中虾青素代谢曲线的影响Fig.4 Effects of inulin on astaxanthin metabolism curves in serum and liver

表2 血清中的AUC0-t值Table 2 AUC0-t values in serum
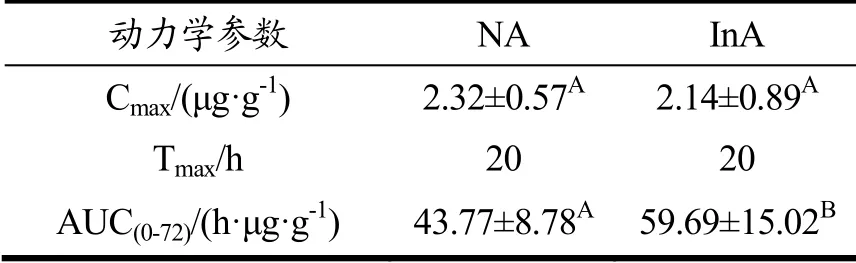
表3 肝脏中的AUC0-t值Table 3 AUC0-t values in liver
2.5 菊粉对小鼠粪便短链脂肪酸和菌群多样性的影响
Cao等[26]指出肠道菌群的结构可能会影响虾青素的吸收。而菊粉是一种益生元,会促使肠道菌群结构和短链脂肪酸发生改变[27],在排除了相关酶等因素的影响后,推测肠道菌群的改变可能是导致菊粉组小鼠对虾青素的生物利用度较高的原因。因此,对正常组小鼠和饲喂菊粉两周的小鼠的粪便进行短链脂肪酸检测和16S rRNA扩增子测序。
如图5a所示,在6种短链脂肪酸中,饲喂菊粉可以显著极显著增加乙酸含量,升高了139.54%(p<0.01),丙酸的含量提高了40.04%(p<0.05)。丁酸的含量也有所增加。该结果提示,菊粉的摄入可以增加相关产短链脂肪酸菌的数量[28]。Gao等[3]研究推测菌群的结构和丰度变化会影响虾青素的吸收。然而,短链脂肪酸的变化与虾青素吸收之间的联系有待深入研究。
随后,对两组小鼠粪便进行扩增子测序(n=9)。两组小鼠的粪便菌群的α多样性并无显著差异(图5b)。韦恩图(图5c)的结果显示,两组之间均有741个相同的OTUs,而菊粉组特有141个特有的OTUs,对照组特有187个特有的OTUs。基于Unweighted Unifrac距离进行主坐标(PCoA)分析(图5d)。结果显示,菊粉组和对照组小鼠的菌群组成结构具有一定的差异,提示菊粉在一定程度上改变了小鼠肠道菌群的结构,从而可能影响虾青素在机体的吸收。

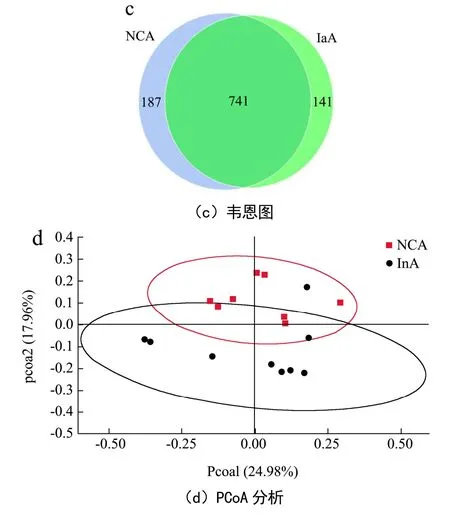
图5 饲喂菊粉对小鼠粪便短链脂肪酸和菌群多样性的影响Fig.5 Effects of inulin feeding on fecal short-chain fatty acids and microbial diversity in mice
2.6 菊粉对正常小鼠肠道菌群组成的影响
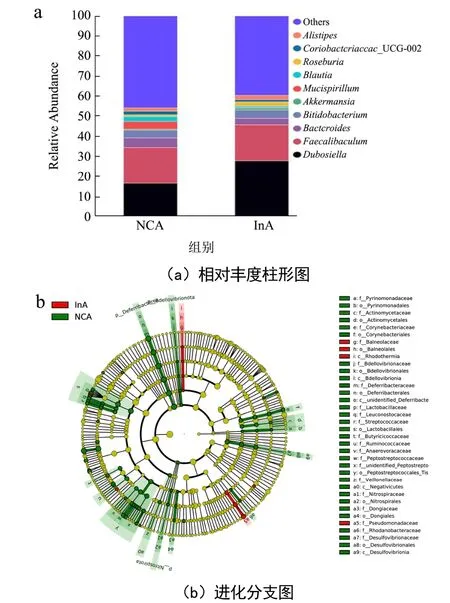

图6 饲喂菊粉对小鼠肠道菌群的影响Fig.6 Effects of inulin feeding on intestinal microflora in mice
两组小鼠属水平上的肠道菌群相对丰度柱形图如图6a所示,菊粉可以使正常小鼠菌群中杜氏杆菌属(Dubosiella)的相对丰度从16.30%增加至27.84%,提高了70.80%。双歧杆菌属(Bifidobacterium)的相对丰度从3.76%增加至4.20%,提高了11.70%,阿克曼氏菌属(Akkermansia)的相对丰度从0.56%增加至1.05%,提高了87.50%,罗氏菌属(Roseburia)的相对丰度从0.94%增加至2.04%,提高了117.02%。因此,菊粉的摄入可以上调有益菌属的相对丰度,这与Guo等[29]研究结果中菊粉对肠道菌群的调节趋势较为一致。Yao等[30]研究发现双歧杆菌可以促进机体吸收异黄酮,而异黄酮与虾青素性质较为类似,提示菊粉可能是通过上调相关有益菌的丰度从而促进虾青素的吸收。为了进一步鉴定出两组中显著差异的菌属,通过Lefse分析对两组小鼠的肠道细菌进行比较,结果如图6b~6e所示。图6b是两组小鼠显著性差异菌的进化分支图。图6c~6e显示的是属水平上菊粉组显著性上调的菌属。菊粉可以显著上调Thermovirga、UBA1819和Gracilimonas菌的相对丰度(p<0.05)。提示菊粉可能是通过调节相关菌的丰度来改善虾青素在机体内的吸收。然而,由于缺乏肠道菌对虾青素吸收影响的研究,相关结果有待进一步深入探讨。
3 结论
本文在膳食中添加3种益生元(低聚果糖、菊粉、壳寡糖),探究其对藻源虾青素吸收的影响。结果表明,菊粉和壳寡糖对虾青素的生物可接受率并无显著差异,低聚果糖显著降低了虾青素的生物可接受率。菊粉的摄入可以提高小鼠粪便中游离虾青素的含量,而在膳食中添加菊粉可以适当提高藻源虾青素的生物利用度,菊粉组肝脏中的代谢曲线下面积(AUC)显著高于对照组。菊粉组小鼠粪便中短链脂肪酸(SCFAs)的含量升高,杜氏杆菌属、阿克曼氏菌属、双歧杆菌属的相对丰度较高。综上,菊粉可能是通过上调与吸收有关的如双歧杆菌等有益菌属的相对丰度来改善藻源虾青素在机体内的吸收利用。然而,由于目前有关肠道菌群与虾青素吸收之间的研究相对较少,相关有益菌属和短链脂肪酸的上调与藻源虾青素在机体内的吸收机制有待深入研究。本研究为开发菊粉和藻源虾青素的复合产品提供了理论支撑,为提高虾青素的生物利用度提供了新思路。

