亚麻籽油对多囊卵巢综合征大鼠炎症细胞的调节作用
汪婷,李一唯,柳媛媛,禹文文,胡富宁,罗晓静,鲁奕男,张晓霞*,王浩,5*
(1.宁夏医科大学基础医学院,宁夏银川 750004)(2.宁夏医科大学中医学院,宁夏银川 750004)(3.宁夏医科大学临床医学院,宁夏银川 750004)(4.宁夏医科大学口腔医学院,宁夏银川 750004)(5.宁夏常见传染病防治重点实验室,宁夏银川 750004)
多囊卵巢综合征(Polycystic Ovary Syndrome,PCOS)是育龄期女性常见的内分泌紊乱疾病[1]。依据鹿特丹诊断标准,我国汉族育龄期女性患病率约为5.6%[2,3],患者主要表现为高雄激素血症、卵巢多囊性改变和排卵障碍[4]。如果不及时治疗,还会增加患糖尿病、心血管疾病等慢性代谢性疾病的风险[5]。然而,PCOS发病机制复杂,确切发病机制尚不清楚,二甲双胍等常用药物在治疗PCOS的同时往往伴随一定的胃肠道反应和肝、肾损伤[6]。因此,寻找更加安全有效的治疗方案至关重要。
近年来研究发现,在饮食中添加益生元Omega-3多不饱和脂肪酸(Polyunsaturated Fatty Acids,PUFAs)有助于改善PCOS患者内分泌紊乱[4,7],提示Omega-3 PUFAs对PCOS具有潜在益处。亚麻籽油(Flaxseed Oil,FO)是omega-3α-亚麻酸(α-linolenic Acid,ALA)最主要的植物来源,具有降血压、降血脂、抗炎等多种功效,被誉为“液体黄金”[8,9]。动物和临床研究证实,ALA来源的FO和鱼油干预能够有效降低PCOS血脂和睾酮水平,改善胰岛素代谢紊乱[10,11]。本团队前期研究[4]发现,FO摄入8 w后PCOS大鼠血浆和卵巢的促炎因子白细胞介素(Interleukin,IL)-6、IL-1β和肿瘤坏死因子-α(Tumor Necrosis Factorα,TNF-α)显著降低,抑炎因子IL-10增加,提示富含ALA的FO对PCOS炎症的调节作用。但是,FO调控炎症因子释放的机制尚不清楚,有待进一步研究。
众所周知,PCOS是一种慢性低度炎症性疾病,患者常表现为促炎性细胞因子升高和炎症细胞的改变[12]。髓源性抑制细胞(Myeloid-derived Suppressor Cells,MDSCs)是病理条件下调节免疫反应的关键因子,主要分布在骨髓、外周血、脾、肝、肺或各种器官的肿瘤中[13]。研究发现,MDSCs能够通过负调控2型辅助性T细胞(Helper T cell 2,Th2)减轻过敏性哮喘小鼠的呼吸道炎症[14],提示MDSCs具有抗炎和免疫抑制作用。调节性T细胞(Regulatory T cell,Treg)能够通过细胞与细胞间接触释放IL-10和转化生长因子-β(Transforming Growth Factor-β,TGF-β)发挥抗炎效应[15]。此外,巨噬细胞(Macrophages,Mψs)也具有免疫调控作用[16],其中M1型Mψs能够分泌大量促炎性细胞因子IL-1β、IL-6和TNF-α[17],M2型Mψs主要分泌IL-10抑制炎症反应[17]。因此,本研究猜测FO可能通过调节炎症细胞MDSCs、Treg和Mψs影响PCOS炎症因子的释放。
根据以往研究[18],采用经典的来曲唑造模法建立PCOS大鼠模型,给予FO灌胃干预,探讨其对PCOS大鼠免疫细胞MDSCs、Treg和Mψs的作用,以期为临床防治PCOS提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器设备
奥林巴斯BX51显微镜,日本Olympus;CytoFLEX流式细胞仪,美国Beckman。
1.1.2 试剂和材料
来曲唑,江苏恒瑞;质量分数1%羧甲基纤维素(Carboxymethyl Cellulose,CMC)溶液,上海源叶;FO(ALA含量>56%),宁夏六盘珍坊;瑞氏-吉姆萨染色试剂盒,珠海贝索生物;大鼠流式抗体CD11b-FITC和His48-FITC,美国Thermo公司;CD4-PE、CD25-BV421(APC)、CD45-PC7和CD86-FITC,美国BD公司;Foxp3-FITC,美国eBioscience公司;CD68-APC,英国Abcam公司;CD163-PE,北京博奥森生物;破膜/固定试剂盒,美国BD公司;大鼠免疫荧光抗体CD68-CY3,武汉赛维尔;一次性负压真空采血管,山东君诺;大鼠饲料,北京科澳。
1.2 实验设计及模型建立
6周龄SPF级雌性SD大鼠32只(193±10 g)购买并饲养于宁夏医科大学实验动物中心,许可证号:SCXK(宁)2015-0001,相关研究通过了宁夏医科大学伦理委员会的批准(批准号:2016-017)。大鼠适应性饲养1 w后随机分为阴性对照组、模型组、FO对照组和FO干预模型组。采用来曲唑造模法建立PCOS大鼠模型[18]。首先,模型组和FO干预模型组灌胃摄入量为每天1 mg/kg(以小鼠质量为基准计)来曲唑(溶于质量分数1% CMC溶液),连续灌胃给药21 d;阴性对照组和FO对照组灌胃等量质量分数1% CMC溶液;期间采集大鼠阴道涂片进行瑞氏-吉姆萨染色,根据镜下细胞形态和种类评估造模是否成功。造模成功后,FO对照组和FO干预模型组每天灌胃摄入1 mL/kg(以小鼠质量为基准计)的FO[19];阴性对照组和模型组灌胃等量生理盐水,持续灌胃干预8 w。末次灌胃后禁食8 h,称重并麻醉大鼠,收集大鼠外周血、脾脏、骨髓、卵巢等相关样本处理后用于后续检测。
1.3 测定指标及方法
1.3.1 阴道涂片及染色
从造模第1天开始到第21天,每天上午9:00收集各组大鼠阴道涂片,参照瑞氏-吉姆萨染色试剂盒说明书立即进行染色,随后在光学显微镜下观察各组大鼠阴道脱落细胞形态和种类的变化。
1.3.2 流式细胞术检测大鼠外周血、脾脏和骨髓中MDSCs
新鲜全血置于抗凝管中离心,分离出血浆和血细胞,下层血细胞通过密度梯度离心法分离出外周血单个核细胞[20]。新鲜脾脏组织研磨后300目滤膜过滤,加入红细胞裂解液裂红、洗涤,分离出单个核细胞。取适量预冷的RPMI 1640反复冲洗大鼠双侧胫骨和股骨的骨髓腔,收集全部的冲洗液300目滤膜过滤,加入红细胞裂解液裂红、洗涤,分离出单个核细胞。所有细胞悬液浓度均调整为每毫升1×106个细胞。随后,吸取上述细胞悬液各100 μL加入流式管中,分别加入1 μL抗大鼠FITC标记的His48以及PE标记的CD11b表面抗体,震荡混匀;4 ℃避光孵育30 min,孵育结束后加入1 mL PBS清洗细胞;弃上清,加入300 μL RPMI 1640重悬,立即上机检测。
1.3.3 流式细胞术检测大鼠外周血和脾脏中Treg
外周血和脾脏中单个核细胞的分离方法如上所述,所有细胞悬液浓度均调整为每毫升1×106个细胞。随后,吸取上述细胞悬液各100 μL加入流式管中,分别加入1 μL抗大鼠PE标记的CD4以及APC标记的CD25表面抗体,震荡混匀;4 ℃避光孵育30 min,孵育结束后加入1 mL PBS清洗细胞;弃上清,加入300 μL破膜固定液孵育30 min;孵育结束后加入1 mL透化液清洗细胞;弃上清,加入1 μL抗大鼠FITC标记的Foxp3抗体,吹打混匀;后续方法同前,上机检测。
1.3.4 流式细胞术检测卵巢Mψs、M1型Mψs和M2型Mψs
大鼠卵巢组织在解剖镜下用注射器针头刺破卵泡,使颗粒细胞释放入预冷的RPMI 1640中[21];加入0.25%胰蛋白酶1 mL置于37 ℃培养箱中消化12 min;终止消化后300目滤膜过滤,加入红细胞裂解液裂红、洗涤,分离出单个核细胞,调整细胞悬液浓度为每毫升1×106个细胞。吸取各组细胞悬液100 μL加入流式管中,分别加入1 μL抗大鼠PC7标记的CD45、APC标记的CD68、FITC标记的CD86以及PE标记的CD163表面抗体,震荡混匀;后续方法同前,上机检测。
1.3.5 免疫荧光检测卵巢Mψs
参照前人研究[22],进行卵巢Mψs免疫荧光染色。卵巢石蜡切片在65 ℃恒温箱中烘烤2 h后脱蜡至水,随后进行抗原修复,加入牛血清白蛋白常温封闭30 min;滴加兔抗大鼠CD68抗体(1:200),湿盒内4 ℃孵育过夜;滴加CY3标记的山羊抗兔抗体(1:200),避光室温孵育60 min;滴加含DAPI的封片剂;在荧光显微镜下观察并采集图像。
1.4 统计学方法
采用SPSS 21.0和GraphPad Prism 6.01软件处理实验数据。实验数据以均数±标准差表示,多组间差异比较采用单因素方差分析,两两比较采用SNK-q检验法。以p<0.05认为差异有统计学意义。
2 结果与讨论
2.1 卵巢病理组织形态学
PCOS患者临床表现多样化且病因复杂,建立与临床表现吻合度高且创伤性小的动物模型对疾病的深入研究至关重要。大量研究证明,来曲唑造模法诱导的PCOS大鼠模型动情周期紊乱,卵巢组织呈多囊性改变,很大程度上具备了临床PCOS患者的病理生理特点,广泛用于PCOS动物研究[23]。因此,本研究选用6周龄雌性SD大鼠通过来曲唑灌胃法建立模型。
阴道涂片法对实验动物无创伤性且具有准确、实用等优点,是判定大鼠动情周期最常用的方法之一[24]。因此,每日采集大鼠阴道涂片进行染色以判定各组大鼠的动情周期是否正常以及各周期持续的时间。如图1所示,动情周期包括四个阶段,动情前期:多为有核上皮细胞、少量无核的角化上皮细胞(图1a);动情期:全部为无核的角化上皮细胞(图1b);动情后期:可见有核上皮细胞、角化上皮细胞及白细胞(图1c);动情间期:大量白细胞及少量黏液(图1d)。结果显示,阴性对照组和FO对照组大鼠阴道涂片可见周期性变化,一个周期约为4~5 d(图1e~1g),该结果提示有排卵。模型组和FO干预模型组大鼠在来曲唑干预12 d后逐渐失去规律的动情周期,干预18 d后处于持续的动情间期(图1f~1h)。以往有研究证实,SD大鼠在来曲唑诱导16 d后处于持续的动情间期[25],本研究结果与之类似,说明来曲唑诱导的PCOS大鼠出现了排卵障碍。此外,结合本课题前期研究,模型组大鼠卵巢组织中黄体消失、卵泡发育异常、呈多囊样改变的结果[26],表明来曲唑诱导的PCOS大鼠模型建立成功。
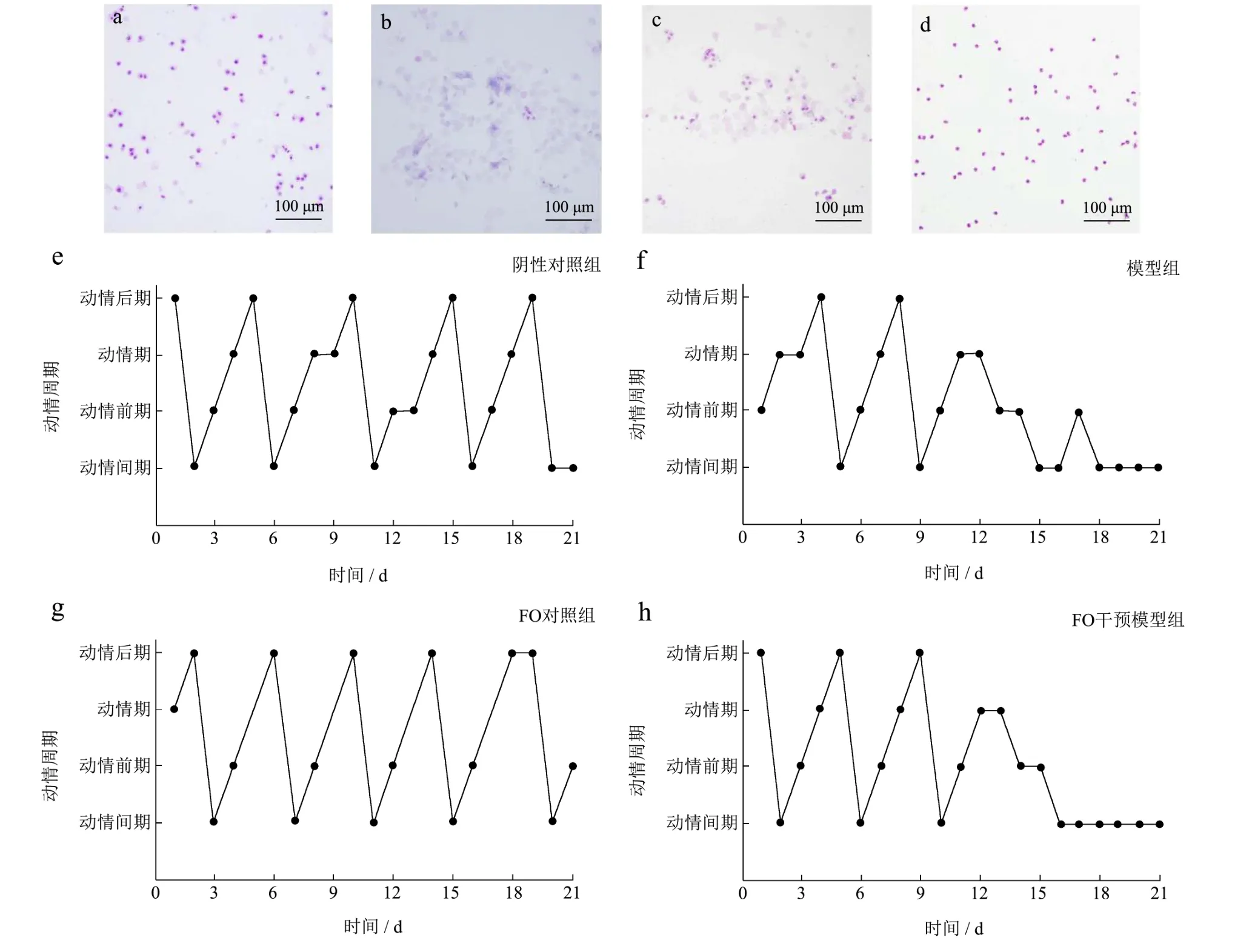
图1 光镜下大鼠阴道脱落细胞染色图和动情周期统计图Fig.1 Staining of vaginal exfoliative cells under light microscope and statistical chart of estrus cycles in rats
2.2 FO干预增加PCOS大鼠外周血、脾脏、骨髓细胞中MDSCs比例
前期研究证实,PCOS进程与慢性低度炎症密切相关,富含ALA的FO干预后通过降低促炎因子水平和增加抗炎因子产生改善了PCOS炎症状态[4]。然而,FO调控炎症因子释放的机制尚不清楚。MDSCs主要分布在骨髓、外周血、脾、肝、肺等组织器官中,在调节炎症过程中具有双向作用,既可以防止过度的炎症反应,同时又能维持一种慢性低度炎症状态[27]。有研究发现,在感染和炎症过程中,未成熟的髓样细胞(Immature Myeloid Cells,IMC)可以通过不同的激活信号(如炎症刺激)分化为MDSCs,并诱导MDSCs在炎症组织富集,从而维持慢性炎症反应[28]。然而,当MDSCs在外周血、脾以及炎症组织中持续增殖后,又能够抑制其向成熟的髓系细胞分化,从而抑制炎症反应,触发炎症消退和启动修复过程,发挥免疫抑制功能[29]。据此,本研究对外周血、脾脏、骨髓中的MDSCs进行了分析。
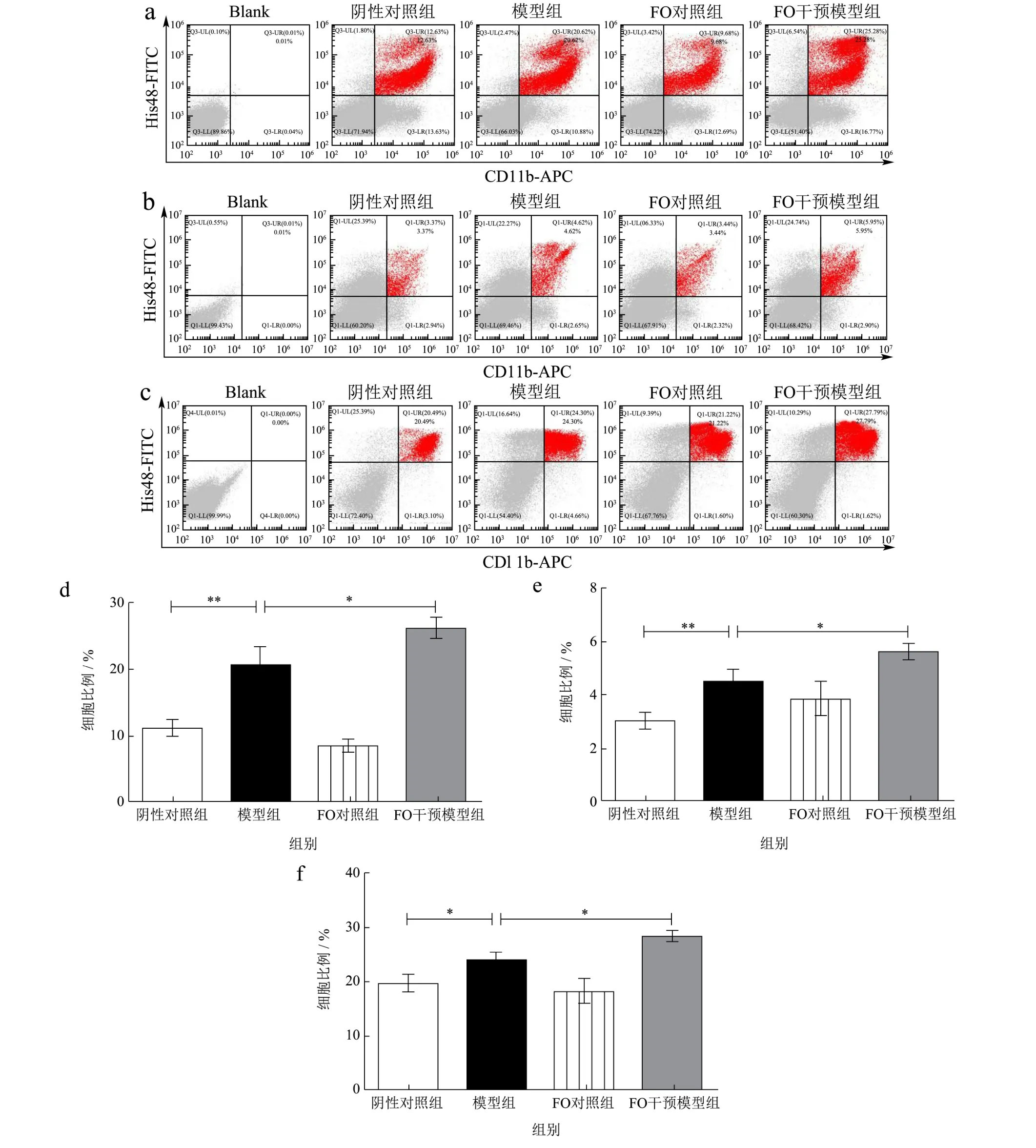
图2 FO干预对PCOS大鼠外周血、脾脏、骨髓MDSCs比例的影响Fig.2 Effects of FO intervention on the proportion of MDSCs in peripheral blood, spleen and bone marrow of PCOS in rats
图2结果显示,骨髓中MDSCs比例最高,外周血中次之,脾脏中MDSCs相对较少(图2a~2c)。阴性对照组外周血、脾脏、骨髓中MDSCs细胞比例分别是11.14%、3.02%和19.37%(图2d~2f)。与阴性对照组相比,模型组外周血、脾脏和骨髓中MDSCs显著高至20.53%、4.48%和23.88%(p<0.05,图2d~2f)。已有研究证实,脱氢表雄酮加高脂诱导的PCOS小鼠外周血、脾脏和肝脏中MDSCs比例增加,且与炎症因子呈现显著相关性,本研究结果与之一致[12]。结合前期研究[4],本研究推测可能是促炎性细胞因子升高促进了MDSCs在大鼠外周血、脾脏、骨髓中募集。有趣的是,与模型组下相比,膳食FO干预后外周血、脾脏、骨髓中MDSCs仍持续升高至25.87%、5.63%和28.36%(p<0.05,图2d~2f),可能是FO干预后MSDCs大量增殖进一步发挥了免疫抑制作用。一项研究[20]发现,FO摄入5 w后能够显著增加2型糖尿病(Type 2 Diabetes Mellitus,T2DM)大鼠外周血和脾脏中MDSCs比例,降低促炎因子IL-1β和TNF-α释放。由此说明,FO干预可能通过促进PCOS大鼠外周血、脾脏、骨髓中MDSCs增殖改善炎症因子释放。
2.3 FO干预增加PCOS大鼠外周血和脾脏中Treg比例
Treg细胞是CD4+T细胞的一种特异性谱系,能够适应局部微环境的变化进行迁移、增殖、存活和分化,在维持免疫稳态和限制过度免疫反应中发挥着重要作用[30]。研究发现,Treg细胞激活能够产生抗炎因子IL-10和TGF-β来抑制幼稚T细胞增殖[31],发挥抗炎效应。因此,研究Treg细胞的变化和作用可能为防治PCOS提供新的分子靶点。
采用CD4、CD25和Foxp3标记Treg细胞[32]。如图3所示,阴性对照组外周血和脾脏中Treg细胞比例分别是2.85%和1.50%。与阴性对照组相比,模型组外周血和脾脏中Treg细胞显著降低至1.29%和0.76%(p<0.01,图3c~3d),与本课题前期研究PCOS大鼠抗炎细胞因子IL-10降低相一致[4]。临床研究[33]发现,PCOS患者外周血Treg细胞较对照组显著降低,同时伴随着慢性低度炎症,这与本研究结果相一致。与模型组相比,FO干预后外周血和脾脏中Treg细胞升高至2.06%和1.07%(p<0.05,图3c~3d),但仍低于阴性对照组。结合前期研究推测[4],FO干预后在一定程度上增加了Treg细胞比例,进而刺激抗炎因子IL-10产生,增强抗炎作用,维持免疫稳态。
2.4 FO干预降低PCOS大鼠卵巢中Mψs比例
Mψs是机体固有免疫系统的重要组成部分,广泛分布在各个组织与器官,具有极强的异质性和可塑性[16]。在不同微环境下Mψs可极化为M1型Mψs和M2型Mψs[34],M1型Mψs通过分泌促炎性细胞因子和趋化因子参与正向免疫应答[34],在炎症反应的启始阶段起关键作用,同时引起组织损伤[34];M2型Mψs分泌IL-10和TGF-β等发挥负向免疫调控作用[17],促进炎症消除和组织损伤修复。近年来研究发现,Mψs在LPS等炎症刺激物的诱导下激活,迅速合成并释放大量炎症介质、炎症细胞因子和黏附分子等,引起M1/M2极化失衡,从而引发全身组织炎症和代谢功能障碍[35]。然而,至今仍没有公认的分子标志来鉴定和区分不同类型的Mψs[36]。目前,报道最多的谱系标志是CD45+CD68+为Mψs,CD45+CD68+CD86+为M1型Mψs,CD45+CD68+CD163+为M2型Mψs[37],故本研究采用其作为检测标志分子。
图4结果显示,阴性对照组卵巢Mψs、M1型Mψs以及M2型Mψs比例分别是8.09%、1.54%和2.27%(图4d~4f)。与阴性对照组相比,模型组卵巢Mψs和M1型Mψs显著升高至18.30%和2.85%(p<0.01,图4d~4e),M2型Mψs升高至2.73%,但差异无统计学意义(p>0.05,图4f)。动物研究发现,脱氢表雄酮诱导的PCOS小鼠脾脏Mψs和M1型Mψs显著增加,并伴随全身炎症反应和排卵障碍[38],本研究结果与之类似,提示卵巢Mψs增加与PCOS全身慢性炎症密切相关。与模型组相比,膳食FO干预后,卵巢Mψs和M1型Mψs比例均降低至13.51%和2.27%(p<0.05,图4d~4e),但仍高于阴性对照组;M2型Mψs升高至2.64%,但无统计学意义(p>0.05,图4f)。动物研究发现,omega-3 PUFA通过与G蛋白偶联受体(G-protein-coupled Receptors,GPR)120相互作用抑制Mψs迁移和浸润,进而减轻小鼠的血管炎症、动脉血栓形成和新生内膜增生[39]。上述结果提示,FO干预能够抑制PCOS大鼠卵巢Mψs和M1型Mψs增殖,但对M2型Mψs作用不明显,推测FO干预可能通过抑制Mψs和M1型Mψs增殖改善PCOS大鼠炎症。


图4 FO干预对PCOS大鼠卵巢Mψs、M1型Mψs和M2型Mψs比例的影响Fig.4 Effects of FO intervention on the percentage of Mψs, M1 Mψs and M2 Mψs of ovary in PCOS rats

注:a:卵巢中Mψs免疫荧光;b:卵巢中Mψs荧光强度的定量分析;*p<0.05,***p<0.001。
近年来研究发现,卵巢组织中定居的单核Mψs可诱导PCOS患者卵巢颗粒细胞凋亡[40]。卵巢中Mψs分泌的各种细胞因子还会影响卵泡的生长发育、排卵以及黄体的形成和功能,提示卵巢Mψs参与PCOS进程[41]。因此,本研究进一步通过免疫荧光对卵巢Mψs进行定量、定位分析。图5b结果显示,阴性对照组Mψs荧光强度为0.62%,模型组Mψs荧光强度较阴性对照组显著升高至2.55%(p<0.001,图5b),说明PCOS大鼠卵巢出现了Mψs浸润,与前人脱氢表雄酮诱导的PCOS大鼠卵巢组织中Mψs浸润的报道相一致[42]。与模型组相比,膳食FO干预后Mψs荧光强度降低至1.59%(p<0.05,图5b),但仍高于阴性对照组,该结果与流式结果趋势一致,推测FO干预后可能通过改善Mψs在卵巢的浸润降低PCOS的慢性低度炎症状态。综上所述,FO干预能够降低卵巢Mψs水平,以其为靶点可能为治疗PCOS提供新的思路。
此外,近年来研究发现,γδT细胞、固有淋巴样细胞(Innate Lymphoid Cells,ILCs)和Th17细胞等炎症细胞也参与了炎症性疾病的发生和发展[43,44]。本研究推测,FO对PCOS大鼠MSDCs、Treg和Mψs的调节作用只是改善炎症的机制之一,其他免疫细胞也可能参与了PCOS发展进程。
3 结论
本研究在前期研究证实富含ALA的FO能够改善PCOS大鼠炎症的基础上,进一步探讨其对炎症相关免疫细胞MSDCs、Treg和Mψs的作用。本研究证实了来曲唑诱导的PCOS大鼠存在动情周期紊乱和炎症细胞改变,FO摄入能够促进MDSCs在外周血、脾脏和骨髓细胞中富集,增加PCOS大鼠外周血和脾脏中Treg比例以及抑制卵巢中Mψs和M1型Mψs增殖,进而发挥负调控作用,改善PCOS炎症状态。本研究为临床进一步探索PCOS的作用靶点提供了新的方案和思路。

