茄皮提取物对糖尿病小鼠的降血糖作用
孙晶,魏静,杨洋,蔡如玉,,常世敏,佟立涛,刘佳萌,卢聪,陶然,孙玉凤,范蓓*,王凤忠*,张景俭
(1.中国农业科学院农产品加工研究所,农业农村部农产品加工质量安全风险评估实验室,农业农村部农产品质量安全收贮运管控重点实验室,北京 100193)(2.河北工程大学生命科学与食品工程学院,河北邯郸 056021)(3.沧州市农林科学院,河北沧州 061001)
糖尿病是常见慢性病,是一种胰岛素分泌不足或胰岛素利用障碍导致机体三大营养物质代谢紊乱的疾病,临床表现为“三多一少”,即多饮、多食、多尿和体质量下降。此外,糖尿病还会引起一些并发症,如糖尿病足、动脉粥样硬化、视网膜血管病变[1]、细菌和真菌感染、糖尿病肾病[2]和糖尿病周围神经病变[3]等,使患者的生活质量极大下降。据统计,全球20~79岁人群中约有420万人死于糖尿病及其并发症,占全球死亡人数的11.3%[4]。因此,如何有效防治糖尿病一直是研究热点。
目前西医治疗糖尿病通常为口服降糖药,如阿卡波糖、二甲双胍,这类药物抑制α-葡萄糖苷酶或促进葡萄糖的摄取和利用,临床疗效显著,但存在单用血糖控制不佳[5]或用药时降低维生素B12吸收、肝功能受损患者用药受限[6]等问题。而长期注射胰岛素可能会有依赖性和出现低血糖的风险。天然产物具有低毒、安全的优势,因此,寻找一种具有降血糖作用的食材,对防治糖尿病具有重要意义。
茄(Solanum melongenaL.)属茄科茄属植物,其根、茎、叶、花、果、蒂均可入药,果实更是餐桌上常见的蔬菜。茄的主要化学成分有咖啡酰奎宁酸酯衍生物、黄酮类、生物碱类、甾体皂苷类等,在抗炎、镇痛、抗氧化、调血脂、降血糖和抗肿瘤等[7]方面均具有较好的活性。本课题组前期已经阐明了茄不同部位的物质基础,发现苯丙酰胺和咖啡酰奎宁酸为茄的各个部位的主要化合物类型,其根、茎中主要成分为苯丙酰胺、木脂素酰胺类成分,而茄果实(茄皮和果肉)中腐胺和亚精胺衍生物较多[8-10],且茄皮中的成分种类和含量优于果肉,紫黑色茄皮较紫红色茄皮的酚类物质含量更高。有学者研究[11]发现,茄提取物具有较好的抑制α-葡萄糖苷酶和淀粉酶的作用,具有剂量依赖性,但茄提取物尤其是茄皮提取物对糖尿病小鼠血糖、糖耐量、体质量的影响仍鲜为研究,不利于茄皮降血糖作用的科学阐释及有效利用。因此,本研究以紫黑色茄皮为研究对象,利用四氧嘧啶建立小鼠糖尿病模型,研究SMPE的降血糖作用,以期为茄皮资源综合利用及降血糖功能性产品开发提供理论基础。
1 材料与方法
1.1 动物、材料与试剂
雄性昆明小鼠,体质量20~24 g,购自北京市实验动物研究中心,动物质量合格证号:211002300046930,许可证号:SCXK(辽)2015-0001。饲养环境:23~25 ℃,相对湿度60%~65%,光照12 h,自由进食、饮水。
新鲜紫黑色茄购自北京市海淀区超市发超市,取其皮用于成分提取。
甲醇(质谱级)、甲酸(质谱级),德国Meker公司;α-葡萄糖苷酶(10 U/mg)、阿卡波糖、对硝基苯酚吡喃葡萄糖苷、苯丙氨酸、色氨酸、3-O-咖啡酰奎宁酸,上海源叶生物科技有限公司;四氧嘧啶,美国Sigma公司;葡萄糖溶液,北京索莱宝科技有限公司。
1.2 仪器与设备
Waters ACQUITY-Xevo G2 XS超高液相色谱-飞行时间质谱,美国Waters公司;Progenesis QI数据分析软件,美国Waters公司;DHG-9040A电热恒温鼓风干燥箱,嘉兴市中心医疗仪器有限公司;RE-52AA旋转蒸发器,上海亚荣仪器厂;Milli-Q超纯水仪,美国Millipore公司;PX224ZH/E精密电子天平,奥豪斯仪器有限公司;SIGMA3K15台式冷冻离心机,成贯仪器(上海)有限公司;SY-300超声波清洗仪,上海微弥超声波有限公司;ACCU-CHEK®performa血糖测定仪,罗氏血糖健康医护公司。
1.3 方法
1.3.1 SMPE的制备
新鲜紫黑色茄分离出果皮,果皮厚度为1~2 mm,切段约5 cm,冷冻干燥12 h,粉碎,过60目筛。取适量干燥样品,按1:40(m/V)加入体积分数70%的乙醇溶液,室温条件下超声功率350 W提取1 h,静置10 min,过滤。重复提取三次,合并滤液。滤液45 ℃旋蒸至干,得SMPE,冷藏保存,称重测得提取率为20.5%。
1.3.2 SMPE成分分析
1.3.2.1 供试品溶液的制备
取SMPE 10 mg,加入1 mL体积分数70%乙醇溶液,以12 000 r/min离心10 min,取上清液过0.22 μm微孔有机滤膜,即得。
1.3.2.2 超高效液相色谱条件
色谱柱:ACQUITY UPLC HSS T3 column(2.1 mm×100 mm,1.8 μm);样品室温度4 ℃;柱温35 ℃;流动相:0.1%甲酸溶液(A)-甲醇(B);梯度洗脱程序:0~10 min,10%~20% B;10~18 min,20%~30% B;18~30 min,30%~40% B;30~40 min,40%~45% B;40~46 min,45% B;流速0.3 mL/min;进样量5 μL。
1.3.2.3 质谱条件
电喷雾离子源;正离子一级全扫描模式,全扫描分子量范围为m/z50~1 200 u;电源电压和喷雾电压2.23 kV,毛细管电压1.0 kV;碰撞能量在4~20 eV之间;曲线脱溶剂气流量700 L/h;鞘气体(氮气)流速28 arb,辅助气体流速8 arb。
1.3.2.4 色谱峰鉴定
将原始数据导入Progenesis QI 2.3软件进行峰对齐、归一化等处理,搜索前期建立的茄成分数据库[8]、天然产物数据库,根据一级和二级质谱碎片,探究质谱裂解规律,结合对照品比对,鉴定化合物的结构。
1.3.3 SMPE对α-葡萄糖苷酶的抑制作用研究
1.3.3.1 待测液制备及测定
精密称取适量SMPE,70%乙醇溶液溶解至20 mg/mL,稀释得到2、4、6、8、10 mg/mL浓度,作为待测样品。配置pH值为6.8的0.1 mmol/L磷酸钾缓冲溶液,用配好的磷酸钾缓冲溶液配制2.5 mmol/mL的对硝基苯酚吡喃葡萄糖苷、0.2 U/mL的α-葡萄糖苷酶溶液及0.2 mol/L的碳酸钠溶液。取0.2 mL各浓度待测液于试管中,加入2.8 mL的磷酸钾缓冲溶液、0.5 mL的α-葡萄糖苷酶溶液,37 ℃孵育15 min,加入0.5 mL对硝基苯酚吡喃葡萄糖苷,再于37 ℃条件下孵育15 min,加入2 mL碳酸钠溶液终止反应。充分混匀后在405 nm处测定吸光值D1;在同样的条件下另取磷酸钾缓冲溶液代替α-葡萄糖苷酶溶液,测定吸光值D2;再取溶剂代替待测样品液,测定吸光值D3;取磷酸钾缓冲溶液于溶剂的混合液,测定吸光值D4。以2 mg/mL阿卡波糖作为阳性对照。
1.3.3.2α-葡萄糖苷酶溶液计算
其抑制率计算公式[12]为:
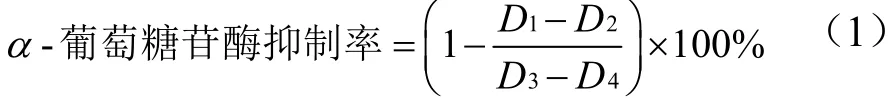
式中:
D1——α-葡萄糖苷酶溶液+样品液测定的吸光值;
D2——磷酸钾缓冲溶液+样品液测定的吸光值;
D3——α-葡萄糖苷酶溶液+溶剂测定的吸光值;
D4——磷酸钾缓冲溶液+溶剂测定的吸光值。
1.3.4 SMPE对糖尿病小鼠的影响
1.3.4.1 正常小鼠分组
随机取20只体质量在20~24 g的雄性昆明小鼠,适应性饲养1周,禁食禁水4 h后测定血糖浓度,并将其随机分成两组,每组10只,分别为SMPE正常给药组和正常对照组。试验组给予15 g/kg的SMPE溶液(溶于质量浓度5% CMC-Na),正常对照组给予生理盐水,按小鼠质量计,每克质量灌胃体积为0.01 mL,连续灌胃4周。
1.3.4.2 糖尿病小鼠模型建立及分组
随机取120只体质量在20~24 g之间的健康雄性昆明小鼠,适应性饲养1周,全部禁食禁水16 h,按照每千克体质量180 mg四氧嘧啶进行腹腔注射[13],自由饮食饮水72 h后,对其禁食8 h,进行尾部静脉取血,测空腹血糖浓度;以空腹血糖浓度不低于11.1 mmol/L为糖尿病模型成功标准[14]。从成模小鼠中随机抽取50只小鼠,随机分成5组,每组10只。分组及灌药情况如下:模型组(给予等量生理盐水)、阳性药组(每千克体质量给予1 mg的阿卡波糖溶液)、低剂量给药组(SMPE-L)(每千克体质量给予2.5 g SMPE)、中剂量给药组(SMPE-M)(每千克体质量给予5 g SMPE)和高剂量给药组(SMPE-H)(每千克体质量给予15 g SMPE)。每10 g体质量灌胃0.1 mL,每天1次,连续灌胃4周。
1.3.4.3 糖尿病小鼠糖耐量试验
灌胃4周后,将各组糖尿病小鼠禁食4 h后,各剂量组给予不同浓度的样品溶液,20 min后按照每千克体质量给予葡萄糖溶液2.0 g经口灌胃,用血糖仪测定小鼠分别给予葡萄糖后0、0.5、2 h后的血糖浓度。观察模型组、阳性给药组和其他不同浓度的受试物组给予葡萄糖后血糖-时间曲线下面积(Area Under Curve,AUC,记为S)的变化。
1.3.4.4 小鼠体质量记录与空腹血糖浓度测定
实验期间每7 d记录小鼠体质量,统计小鼠体质量变化趋势。分别于给药第1、2、3、4周,各组小鼠禁食不禁水4 h后尾部取血,用血糖仪测定血糖浓度。
1.3.4.5 血糖-时间曲线下面积计算
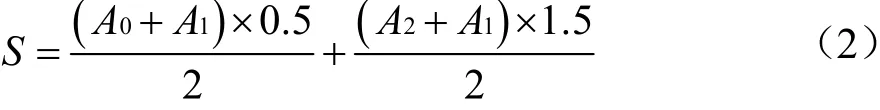
式中:
S——血糖-时间曲线下面积AUC,mmol·h/L
A0——0 h血糖浓度,mmol/L;
A1——0.5 h血糖浓度,mmol/L;
A2——2 h血糖浓度,mmol/L。
1.3.4.6 血糖下降率的计算
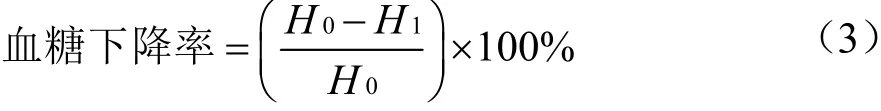
式中:
H0——试验前血糖浓度,mmol/L;
H1——试验后血糖浓度,mmol/L。
1.3.4.7 数据分析
采用SPSS 17.0软件处理数据,以单因素方差分析和t检验进行组间差异显著性比较,0.01<p<0.05表示差异显著,p<0.01表示差异极显著。
2 结果与讨论
2.1 SMPE成分分析结果
在本研究色谱分离条件下,SMPE中的化学成分得到有效的分离,如图1所示。通过与对照品、文献[8]、数据库比对,共鉴定了12个化合物,见表1。
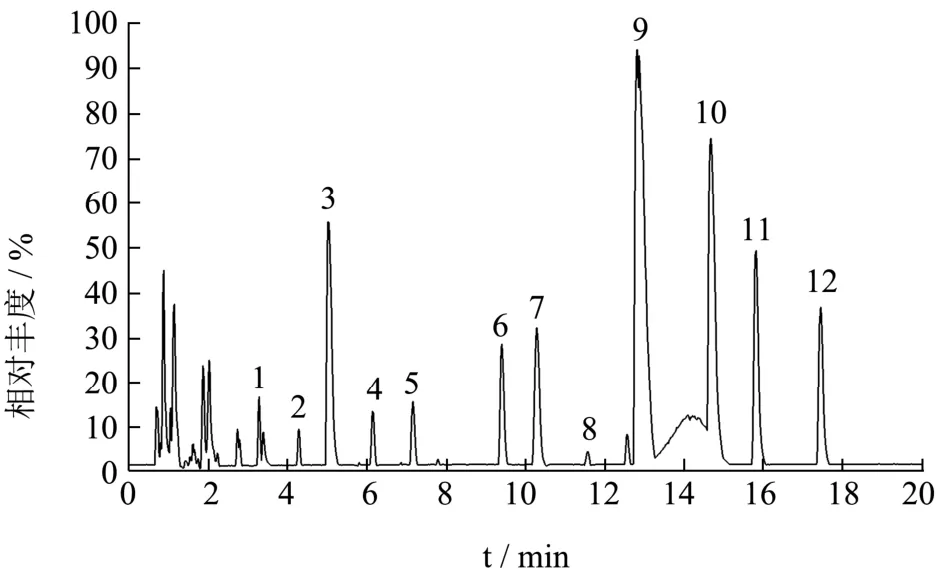
图1 茄皮提取物总离子流图Fig.1 Total ion chromatogram of SMPE
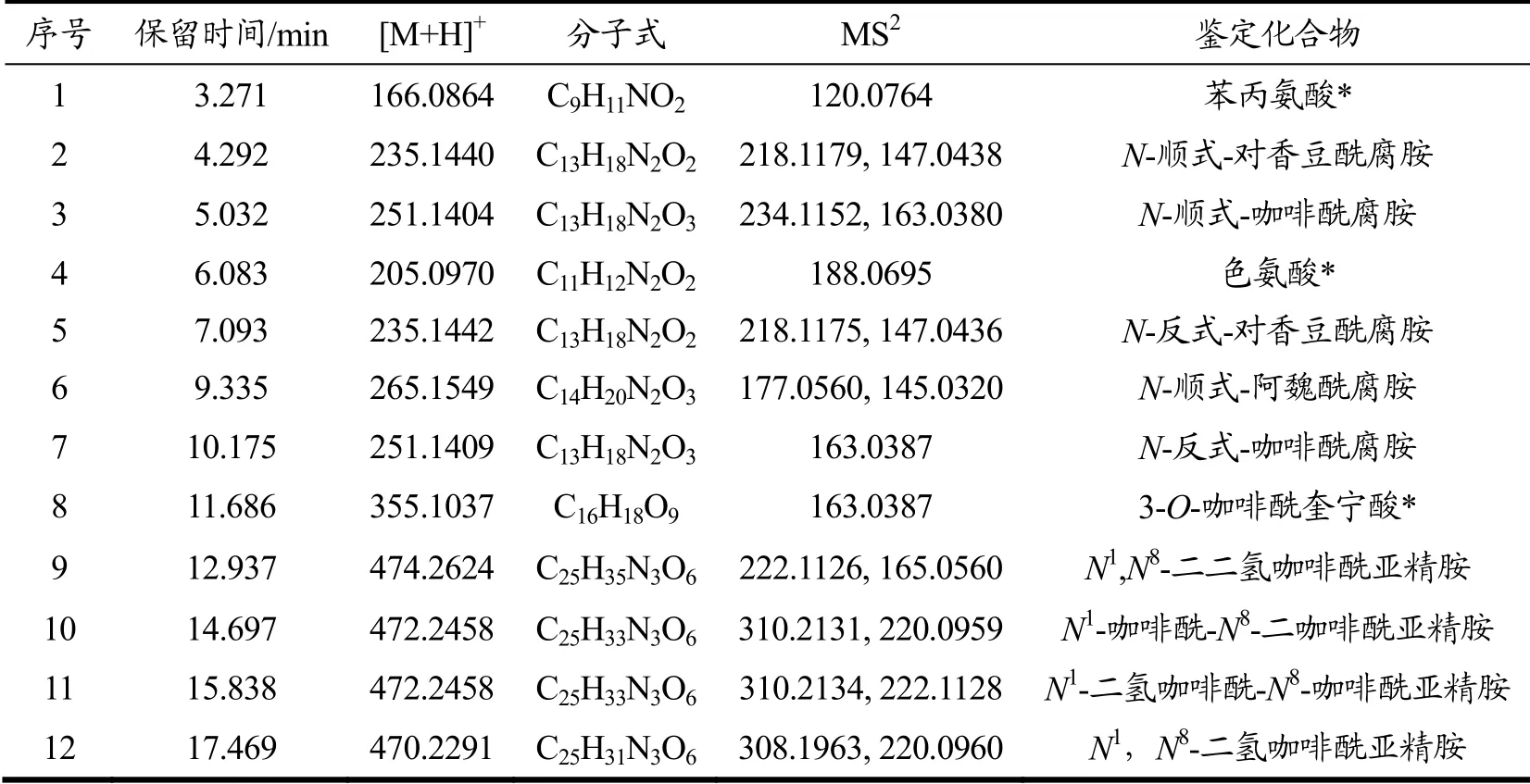
表1 SMPE中鉴定的化学成分Table 1 Chemical components identified in SMPE
2.2 SMPE对α-葡萄糖苷酶的抑制率结果
SMPE对α-葡萄糖苷酶活性抑制率如图2所示。不同浓度的SMPE对α-葡萄糖苷酶活性均有抑制作用,且抑制作用呈剂量依赖性。阳性对照阿卡波糖(2 mg/mL)对α-葡萄糖苷酶的抑制率为52.33%;2、4、6、8、10 mg/mL的SMPE抑制率分别为4.93%、9.93%、30.67%、35.53%和49.13%。低浓度SMPE对α-葡萄糖苷酶抑制作用不明显,SMPE 10 mg/mL组与阿卡波糖组对比,抑制率无显著性差异(p>0.05),表明SMPE高剂量对α-葡萄糖苷酶的抑制活性与2 mg/mL的阿卡波糖相当。α-葡萄糖苷酶是小肠肠道吸收碳水化合物的关键酶,能将二糖转化为单糖,使得餐后血糖急剧升高[15,16]。SMPE对α-葡萄糖苷酶的抑制作用可能与茄中含有的咖啡酰奎宁酸及其衍生物、亚精胺类物质有关,可以抑制小肠刷状缘上的α-葡萄糖苷酶对碳水化合物的转化,从而延缓肠道对葡萄糖的吸收[17-19]。VítorSpínola等[20]评估10种菊科植物提取物的体外降血糖能力,其中咖啡酰奎宁酸物质对关键消化酶和α-葡萄糖苷酶有明显抑制作用,还表现出对导致并发症发生的晚期糖基化终产物(Advanced Glycation End-products,AGEs)的预防作用。另有文献报道,咖啡酰奎宁酸、亚精胺类物质对α-葡萄糖苷酶有抑制作用,如N-反式-对香豆酰酪胺[21]、5-咖啡酰基奎宁酸[22]等,且对葡萄糖消耗能力强,通过与α-葡萄糖苷酶以1:1的摩尔比形成复合物而发挥抑制作用[23]。SMPE能够有效抑制α-葡萄糖苷酶活性,具体机制需进一步研究,但其结果可为SMPE体内降血糖实验提供理论依据,进一步挖掘茄的药理作用和食用价值。
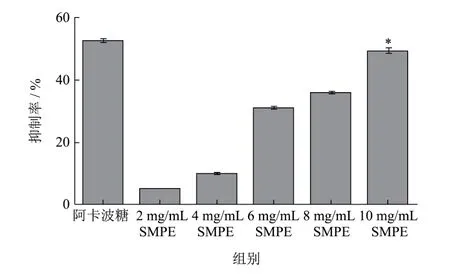
图2 SMPE对α-葡萄糖苷酶活性的抑制作用Fig.2 Inhibition of SMPE on α-glucosidase activity
表2 SMPE对小鼠体质量的影响Table 2 Effect of SMPE on body mass of mice (g,ˉ±s, n=10)
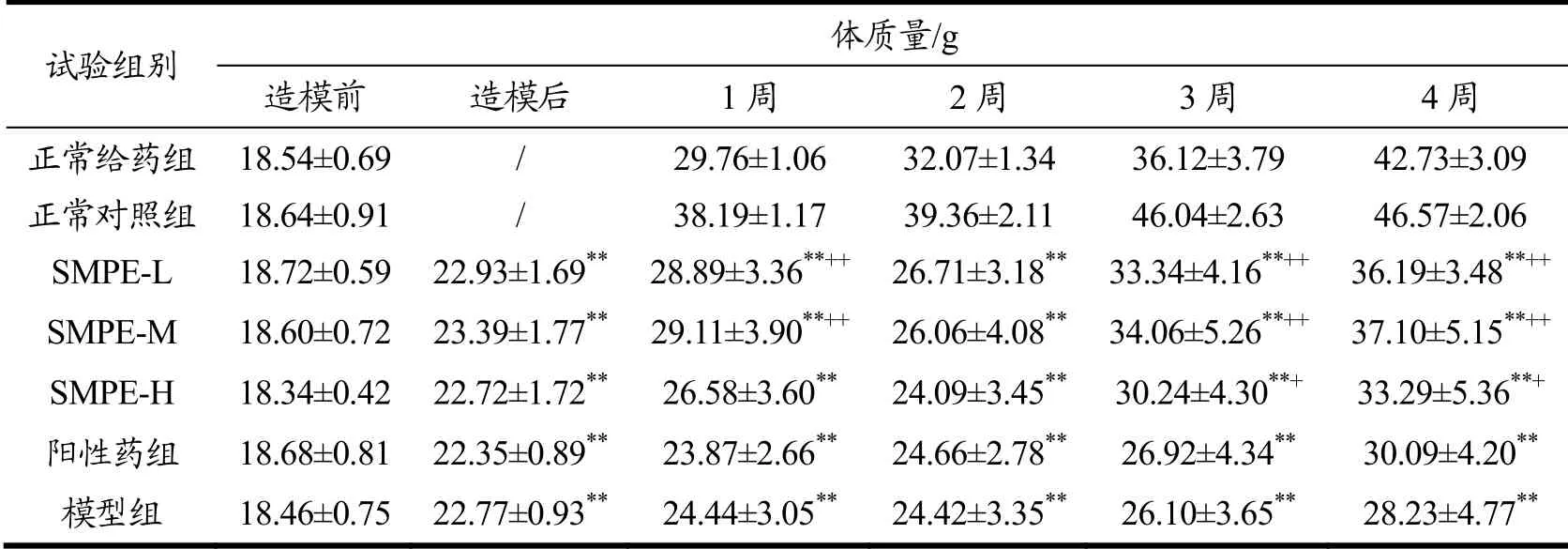
表2 SMPE对小鼠体质量的影响Table 2 Effect of SMPE on body mass of mice (g,ˉ±s, n=10)
注:**与正常对照组比较,差异极显著(p<0.01);++与模型组比较,差异极显著(p<0.01);+与模型组比较,差异显著(0.01<p<0.05)。下表同。
试验组别 体质量/g造模前 造模后 1周 2周 3周 4周正常给药组 18.54±0.69 / 29.76±1.06 32.07±1.34 36.12±3.79 42.73±3.09正常对照组 18.64±0.91 / 38.19±1.17 39.36±2.11 46.04±2.63 46.57±2.06 SMPE-L 18.72±0.59 22.93±1.69**28.89±3.36**++26.71±3.18**33.34±4.16**++ 36.19±3.48**++SMPE-M 18.60±0.72 23.39±1.77**29.11±3.90**++26.06±4.08**34.06±5.26**++ 37.10±5.15**++SMPE-H 18.34±0.42 22.72±1.72** 26.58±3.60** 24.09±3.45**30.24±4.30**+ 33.29±5.36**+阳性药组 18.68±0.81 22.35±0.89** 23.87±2.66** 24.66±2.78** 26.92±4.34** 30.09±4.20**模型组 18.46±0.75 22.77±0.93** 24.44±3.05** 24.42±3.35** 26.10±3.65** 28.23±4.77**
2.3 糖尿病小鼠建模结果
120只小鼠建模过程中,12只小鼠空腹血糖浓度未达到成模要求,最终成模率为90%。
2.4 SMPE对小鼠体质量的影响
由表2可得,正常给药组和正常对照组比较,小鼠体质量无显著性差异(p>0.05),表明SMPE不会对正常小鼠体质量造成影响。模型组与正常对照组比较,存在极显著性差异(p<0.01),表明糖尿病小鼠模型建立成功。给药四周后,与模型组相比,SMPE低、中、高剂量组小鼠体质量分别增加20.34%、23.91%和15.20%;SMPE低、中、高剂量组小鼠体质量与模型组相比,存在显著性差异(p<0.05),其中SMPE-L和SMPE-M组差异更显著,且优于阳性药组。流行病学研究显示58%以上糖尿病都归因于身体体质量指数过高。与低剂量和中剂量相比,高剂量SMPE组小鼠体质量增加较少,原因可能与SMPE高剂量能够延迟胃排空,减少食物的摄取达到降低体质量的目的[24],其具体机制仍需进一步研究。
2.5 SMPE对小鼠空腹血糖的影响
表3 SMPE对小鼠空腹血糖的影响Table 3 Effect of SMPE on fasting blood glucose of mice (ˉ±s,n=10)
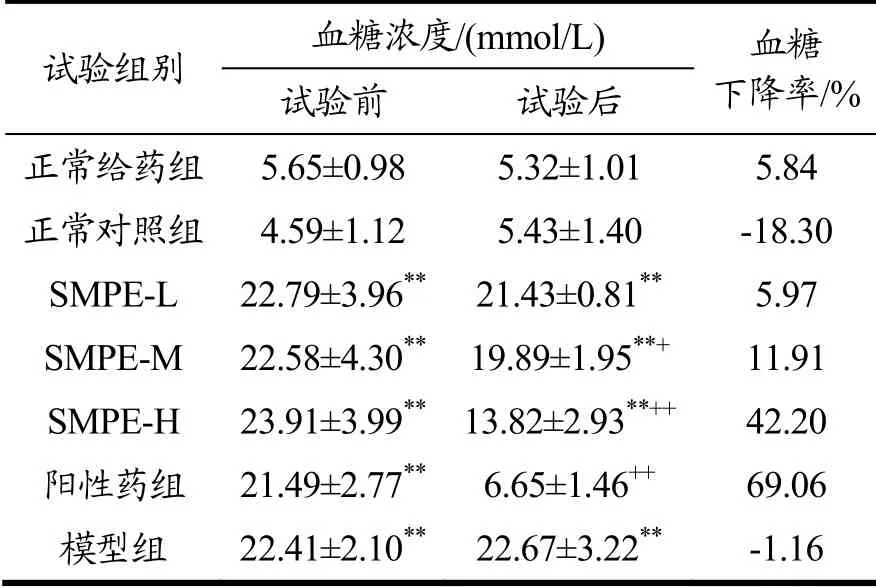
表3 SMPE对小鼠空腹血糖的影响Table 3 Effect of SMPE on fasting blood glucose of mice (ˉ±s,n=10)
试验组别 血糖浓度/(mmol/L) 血糖下降率/%试验前 试验后正常给药组5.65±0.98 5.32±1.01 5.84正常对照组4.59±1.12 5.43±1.40 -18.30 SMPE-L 22.79±3.96** 21.43±0.81** 5.97 SMPE-M 22.58±4.30** 19.89±1.95**+ 11.91 SMPE-H 23.91±3.99** 13.82±2.93**++ 42.20阳性药组 21.49±2.77** 6.65±1.46++ 69.06模型组 22.41±2.10** 22.67±3.22** -1.16
由表3可得,正常给药组和正常对照组的血糖浓度无显著差异(p>0.05),表明SMPE对正常小鼠的空腹血糖浓度没有影响;试验前SMPE各剂量组、阳性药组和模型组血糖浓度明显高于正常给药组和正常组,表明糖尿病小鼠模型建立成功。给药四周后,SMPE低、中、高剂量组小鼠血糖水平分别下降了5.97%、11.91%和42.20%。随着SPME浓度的增加,小鼠血糖浓度下降越快,表明SMPE对糖尿病小鼠空腹血糖浓度抑制作用呈剂量依赖性,高剂量组效果最好。通过上述结果和分析,表明SMPE对正常小鼠空腹血糖无影响,对糖尿病小鼠空腹血糖有抑制作用,且剂量越大抑制作用越强。糖尿病是一种非常复杂的代谢性疾病,本研究采用的四氧嘧啶诱导糖尿病模型,通过产生超氧自由基破坏小鼠胰岛B细胞导致胰岛素缺乏,表现出造模后小鼠高血糖症状。SMPE可以调控糖尿病小鼠空腹血糖浓度,其机制可能与细胞糖代谢有关的胰岛素受体信号通路、AMP激活蛋白激酶有关[25],具体机理还需进一步研究。
2.6 SMPE对糖尿病小鼠的糖耐量影响
表4 SPME对糖尿病小鼠糖耐量的影响Table 4 Effect of SMPE on glucose tolerance of diabetic mice (ˉ±s, n=10)

表4 SPME对糖尿病小鼠糖耐量的影响Table 4 Effect of SMPE on glucose tolerance of diabetic mice (ˉ±s, n=10)
试验组别 0 h血糖浓度/(mmol/L) 0.5 h血糖浓度/(mmol/L)2 h血糖浓度/(mmol/L) 血糖曲线下面积正常对照组 4.30±0.12 6.47±0.31 3.86±0.68 9.99±0.68模型组 28.70±1.12** 27.61±1.26** 26.03±2.04** 54.31±2.04**阳性药组 15.96±1.62**++ 28.52±1.47** 17.15±3.43**++ 45.37±3.43**++SMPE-L 23.14±0.09**#++ 29.72±0.93** 25.61±1.70** 54.71±1.70**SMPE-M 21.26±1.07**++ 28.56±0.84** 24.56±1.79** 52.30±1.79**SMPE-H 18.95±0.75**++ 25.15±0.59** 21.14±0.07**+ 45.74±0.07**++
由表4可得,将葡萄糖溶液灌胃小鼠后,空白对照组血糖浓度在0.5 h达到高值,2 h后血糖浓度缓慢恢复至空腹水平,符合正常机体糖耐量实验中糖代谢变化;模型组的血糖浓度基本无变化,符合糖尿病模型在糖耐量实验中糖代谢变化;SPME各剂量组和阳性药组血糖浓度先升高后下降至空腹水平,表明SMPE能增强糖尿病小鼠糖耐量能力,与正常对照组相比,各组均显示极显著性差异(p<0.01);与模型组相比,SMPE高剂量组2 h血糖浓度存在显著性差异,血糖曲线下面积与阳性药相当。上述结果表明,SMPE可调节四氧嘧啶导致的大鼠糖脂代谢紊乱,对于糖尿病的辅助治疗有积极价值。
2.7 SMPE降血糖作用机制探讨
α-葡萄糖苷酶是一类催化碳水化合物非还原末端的α-1,4-糖苷键水解、释放出葡萄糖的酶,主要存在于唾液和小肠刷状缘上皮细胞,对碳水化合物的消化吸收和餐后血糖起着非常重要的作用。α-葡萄糖苷酶抑制剂的原理是通过竞争性抑制或非竞争性抑制等机制来抑制α-葡萄糖苷酶与底物的结合,减缓对碳水化合物的吸收,降低淀粉等多糖转化为单糖,抑制碳水化合物在小肠上部吸收,从而降低餐后血糖[26]。服用葡萄糖苷酶抑制剂是治疗Ⅱ型糖尿病的首选方法之一[27]。体外α-葡萄糖苷酶抑制实验结果表明,茄皮提取物作用类似于α-葡萄糖苷酶抑制剂,具体机制可能与降低淀粉分解速度、降低葡萄糖浓度、减缓消化道对其吸收,从而降低餐后血糖浓度有关。
茄皮提取物中主要含有咖啡酰奎宁酸类物质,研究表明,咖啡酰奎宁酸类物质所含的咖啡酰氧基团对α-葡萄糖苷酶的活性抑制起到关键作用,且抑制作用强弱与所含的咖啡酰氧基团数目有关,二咖啡酰类衍生物的抑制活性强于单咖啡酰衍生物。含有两个或多个咖啡酰氧基团的物质,如SMPE中N1-咖啡酰-N8-二咖啡酰亚精胺、N1,N8-二氢咖啡酰亚精胺等,基团的键合部位对α-葡萄糖苷酶的活性抑制作用不同,处于邻位的两个咖啡酰氧基会增强抑制作用[18]。此外,该类化合物含有的酚羟基,具有良好的消除自由基的能力,有助于降糖活性的发挥。因此,茄皮提取物降糖作用主要与其所含的咖啡酰奎宁酸类物质有关,有研究基于网络药理学的方法,建立了咖啡酰奎宁酸类化合物的活性成分-靶点-疾病模型,预测了咖啡酰奎宁酸类化合物作用靶点及作用机制,其作用机制主要涉及胰岛素信号级联通路、细胞外基质降解、基质金属蛋白酶的激活和胶原降解等通路[28]。
本研究在明确了SMPE对α-葡萄糖苷酶抑制作用的基础上,进一步利用四氧嘧啶致小鼠糖尿病模型,研究SMPE体内降血糖作用。研究结果表明SMPE能够降低糖尿病小鼠的空腹血糖浓度,且剂量越大抑制作用越强,这与体外对α-葡萄糖苷酶抑制活性实验结果一致。α-葡萄糖苷酶活性实验为体内降血糖实验提供可行性依据,小鼠体内实验结果证实了SMPE的降血糖功能,其具体机制可通过测定胰岛素、胰腺组织病理变化、胰腺氧化应激水平等指标进一步探讨。
3 结论
本研究结果表明,SMPE中主要成分为咖啡酰奎宁酸、腐胺、亚精胺、氨基酸等,并对α-葡萄糖苷酶具有一定抑制作用,SMPE在10 mg/mL剂量下的抑制率达49.13%。在此基础上,通过四氧嘧啶腹腔注射小鼠建立糖尿病模型,发现SMPE可调节糖尿病小鼠体质量,降低空腹血糖浓度,增强糖耐量,证实了SMPE的降血糖作用。初步推测SMPE的降血糖作用可能与抑制碳水化合物转化、延缓肠道对葡萄糖的吸收有关,但具体机制仍需通过测定胰岛素、胰腺组织病理变化、胰腺氧化应激水平等指标,结合相关信号通路、代谢组学、蛋白质组学等方法进一步研究。本研究有利于茄的充分有效利用,对降血糖功能性食品研发具有一定的参考价值。

