自然发酵面团中分离的发酵乳杆菌对高脂饮食小鼠的降血脂作用
李慧,李晓琳*,李金龙,李保玲,刘文君,史新芮
(1.哈尔滨体育学院运动人体科学学院,黑龙江哈尔滨 150001)
(2.东北农业大学动物医学学院,黑龙江哈尔滨 150001)
近年来,人们生活水平不断提高,随着生活方式和饮食结构的改变,胆固醇过量引起的心脑血管疾病已经严重危害到人体健康[1]。目前国内外降低人体胆固醇的主要方式是药物治疗,但其存在副作用多及费用高的弊端[2]。因此,需要探寻更加安全、高效的方法来减轻胆固醇过高导致的心脑血管疾病对人类的危害。
乳酸菌作为人体肠道中的正常菌群,具有抑制病原菌、调节肠道菌群、免疫和抗肿瘤等活性,对机体有着重要的益生作用[3-5]。19世纪70年代,研究者发现经常饮用由乳杆菌发酵的乳制品的美国人及非洲马赛人体内血清胆固醇水平普遍较低[6],这为探索降低胆固醇水平的新策略提供了方向。现有研究已经证实,乳酸菌及其发酵制品具有降低血清胆固醇的能力[7,8]。因此,筛选能够降胆固醇的乳酸菌,进一步应用于研发具有降胆固醇功能的益生菌产品具有重要意义。
乳酸菌作为天然菌群广泛应用于食品发酵,其应用于面团发酵能够增强面团的流变特性,改善面团的质构特性,更重要的是增加面团中淀粉和蛋白质的利用率,提高面团的营养价值[9,10]。尽管自然发酵面团用于发酵传统面食可以追溯到13世纪,但其中作为影响发酵面食品质最主要因素的乳酸菌的具体功能并没有得到很好的研究。本研究以自然发酵面团中分离出的乳酸菌为研究对象,筛选出了一株体外降胆固醇效果最佳的发酵乳杆菌,该菌株同时具有耐酸耐胆盐和抑制致病菌的特性,进一步采用高脂模型小鼠研究该菌株在体内的降血脂功能,以期为将来降胆固醇益生菌制品的研制和生产提供理论依据。
1 材料与方法
1.1 主要材料与试剂
20个自然发酵面团分别收集自黑龙江省哈尔滨市周边不同农户家庭。大肠杆菌O157(882364株)、金黄色葡萄球菌CGMCC 1.291及鼠伤寒沙门氏菌S50333均为本实验室保藏菌株。MRS培养基和乳酸菌生化鉴定试剂盒,购自青岛高科园海博生物技术有限公司;细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;胆固醇和牛胆盐均购自西格玛奥德里奇(上海)贸易有限公司;血清总胆固醇(TC)、肝脏TC、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)含量测定试剂盒,购自南京建成生物工程研究所。
实验动物和饲料:8周龄雄性C57BL/6J小鼠购于辽宁长生生物技术有限公司,普通饲料和高胆固醇饲料购自北京科澳协力有限责任公司,高胆固醇饲料组成如下(质量分数):基础饲料83.7%、猪油10%、蔗糖5%、胆固醇1%和胆盐0.3%。
1.2 主要仪器
PCR仪,TaKaRa公司;小型离心机,Eppendorf公司;pH计,上海精密科学仪器有限公司;显微镜,日本奥林巴斯公司;电热恒温培养箱,北京市永光明医疗仪器厂;超微量紫外分光光度计,德国Implen公司;超净工作台,苏州净化设备有限公司。
1.3 乳酸菌的分离鉴定
采用平板涂布法,将20 g自然发酵面团用生理盐水溶解后取500 μL加入4.5 mL MRS培养基中,进行10倍体积梯度稀释,各取100 μL 105~107的稀释液涂布于MRS平板,分别于37 ℃培养24~48 h,挑取不同形态的单菌落,连续划线分离纯化,直至获得大小、形态一致的菌落。参照《乳酸细菌分类鉴定及试验方法》对菌株进行革兰氏染色观察细胞形态、并利用过氧化氢酶接触试验、乳酸菌生化鉴定试剂盒鉴定生化特性[11]。然后,利用试剂盒提取乳酸菌的基因组DNA,设计合成引物序列如下:27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACT T-3’)[12],利用PCR扩增16S rRNA序列,将扩增结果使用BLAST与GenBank数据库中序列进行对比分析。
1.4 乳酸菌益生特性分析
1.4.1 乳酸菌耐酸耐胆盐评价
用1 mol/L HCl调节MRS培养基的pH值至3.0和6.5,将100 μL过夜培养的乳酸菌加入5 mL不同pH的MRS培养基中,37 ℃孵育4 h,测定OD600nm值[13]。配置含0.3%胆盐的MRS培养基,以不含胆盐的MRS培养基作为对照,两种培养基各接种1%的乳酸菌,37 ℃孵育4 h,测定OD600nm值。生长速率计算方法见公式(1)[14]。

式中:
G——生长率,%;
A1——无胆盐培养基OD600nm值;
A2——对照培养基OD600nm值。
上述试验对每个菌株进行3个重复。
1.4.2 乳酸菌抑菌能力分析
利用牛津杯试验分析乳酸菌对致病菌的抑菌能力[15]。将15 mL 1.5%(m/V)琼脂培养基倒在平板上并凝固,放置好6 mm牛津杯。在45~50 ℃条件下,将每株病原菌按照1%比例接种于15 mL 0.8%(m/V)的琼脂培养基中,混匀。倾倒上层琼脂培养基并凝固,取出牛津杯后将100 μL乳酸菌培养物加入空孔中。将平板在室温下静置,然后在37 ℃下孵育18~24 h后用游标卡尺测量平板上的抑菌环直径。
1.5 乳酸菌安全性评估
1.5.1 溶血性试验
将活化两次后的乳酸菌菌株于哥伦比亚绵阳血琼脂平板上划线,37 ℃培养24~48 h,拍照记录菌落周围形态,以金黄色葡萄球菌做为阳性对照。
1.5.2 抗生素敏感试验
采用Kirby-Bauer纸片扩散试验对所有分离的乳酸菌进行药敏试验[16]。分别选择如下抗生素:红霉素(15 μg)、链霉素(10 μg)、氯霉素(30 μg)、庆大霉素(10 μg)、克林霉素(2 μg)和氨苄青霉素(10 μg),在37 ℃条件下培养24 h,然后测量抑菌圈的直径,使用临床和实验室标准协会的指导原则(CLSI 2014)对乳酸菌的抗性进行分析。
1.6 乳酸菌体外降胆固醇能力测定
参照Liu等[17]的方法绘制胆固醇标准曲线并测定乳酸菌的OD值,对乳酸菌的体外降胆固醇能力进行评价。
1.6.1 胆固醇标准曲线的绘制
用无水乙醇溶解胆固醇配置成0.1 mg/mL的胆固醇标准液。按照胆固醇终浓度分别为0、0.2、0.4、0.6、0.8和1.0 mg/mL取适量标准液用无水乙醇补齐总体积至2 mL,再缓慢加入等体积的显色剂(硫酸铁铵),充分振荡混匀后室温静置30 min,测定OD560nm值并绘制标准曲线。
1.6.2 乳酸菌OD值的测定
将乳酸菌菌株活化两次后6 000 r/min离心10 min,用无菌PBS洗涤菌体后制成菌悬液,按照2%的接种量接种至新鲜配制的降胆固醇筛选培养基(MRS-CHOL培养基)中,于37 ℃培养48 h,取0.2 mL培养液加入到4.8 mL无水乙醇中振荡混匀,5 000 r/min离心10 min,取上清液测定OD560nm值,以邻苯二甲醛比色法测定胆固醇含量,同时以未接菌的MRS-CHOL培养基作为对照。

式中:
D——胆固醇去除率,%;
A3——未接菌上清液OD560nm值;
A4——接菌后上清液OD560nm值。
1.7 乳酸菌对高脂饮食小鼠的影响
1.7.1 小鼠分组和灌喂方法
选取8周龄雄性C57BL/6J小鼠50只适应性喂养1 w后,按表1饲喂方式分为5组,连续喂食5 w。将活化后的乳酸菌菌株FD-8,用生理盐水洗涤2次并将菌体浓度分别调整至1010、108和106CFU/mL,用于小鼠灌喂试验,每天现用现配。

表1 小鼠分组及饲喂方式Table 1 Grouping of the mice and feeding method
1.7.2 小鼠体质量增加量、摄食量及饲料利用率测定
灌喂开始后每天固定时间记录小鼠摄食量,每周同一时间称量小鼠体质量,计算小鼠的饲料利用率,见公式(3)。

式中:
S——饲料利用率,%;
M增——小鼠质量增加量,g;
M食——摄食量,g。
1.7.3 小鼠脏器指数的测定
小鼠灌喂5 w后禁食12 h,处死后立即摘除心脏、肝脏、脾脏和肾脏,生理盐水清洗后用滤纸吸净水分,将分离到的各器官进行称重,按公式(4)计算脏器指数。

式中:
F——脏器指数,mg/g;
M脏——各脏器质量,mg;
M——小鼠处死前质量,g。
1.7.4 小鼠血液样品的采集与测定
小鼠饲养5 w后,眼眶静脉丛采血,常规方法分离血清,用试剂盒检测小鼠血清中的TC、TG、LDL-C和HDL-C含量。
1.7.5 肝脏TC、TG含量的测定
精确称量0.1 g肝脏组织,添加到9倍体积的生理盐水中,将肝脏组织充分匀浆后,于4 ℃,3 000 r/min离心10 min,取上清液测定肝脏的TC和TG水平。
1.8 统计学分析
实验数据按照平均值±标准误差表示。通过Graph Prism 7.0对数据进行统计分析,p<0.05,差异显著;p<0.01,差异极显著。
2 结果与讨论
2.1 乳酸菌的分离及鉴定结果
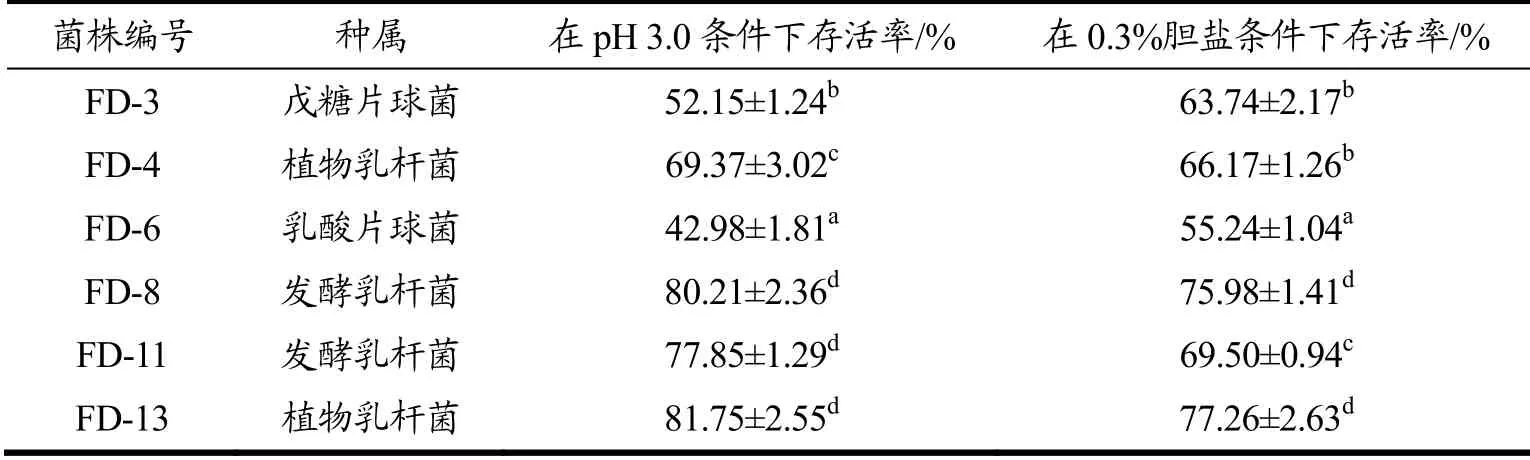
表2 乳酸菌分离株的种属及耐酸耐胆盐情况Table 2 The acid and bile salt tolerance of the lactic acid bacteria isolates of various species
自然发酵面团中含有多个菌种[18]。但研究显示,其中的细菌组成相对简单,主要以乳酸菌和酵母菌为主[19]。本研究将自然发酵面团稀释液涂布平板,挑取形态不同的菌落,经革兰氏染色和生化鉴定筛选出16株革兰氏阳性、过氧化氢酶阴性、有典型形态和生化特性的乳酸菌,经16S rRNA测序比对,这16株菌株中有植物乳杆菌5株、发酵乳杆菌5株、戊糖片球菌3株、乳酸片球菌2株和短乳杆菌1株,说明乳杆菌是自然发酵面团在自然发酵过程中的优势菌种。乳酸菌进入人体发挥益生作用的必须条件之一是能耐受胃酸环境以及肠道的高浓度胆盐环境,这也是乳酸菌菌株应用于医药或者商业用途的重要限制性因素之一[20]。对分离得到的16株乳酸菌进一步进行耐酸耐胆盐分析,结果如表2所示,以30%存活率为界限,其中6株乳酸菌对酸性及胆盐环境均有良好的耐受能力,且不同菌株之间有一定的差异,在酸性条件下的存活率在42.98%~81.75%之间,而在胆盐条件下的存活率在55.24%~77.26%之间,进一步选取这6株符合条件的候选菌株开展后续试验。
2.2 乳酸菌分离株的益生特性
随着对抗生素耐药性的普遍关注,乳酸菌对病原菌的抑菌活性也受到了广泛的关注,成为评价其益生特性的重要指标之一[21]。从表3乳酸菌体外抑菌试验结果显示,6株乳酸菌均对大肠杆菌和金黄色葡萄球菌有抑制作用,其中发酵乳杆菌FD-13对大肠杆菌的抑菌作用最强,FD-8对金黄色葡萄球菌的抑菌作用最强,二者的抑菌圈直径均大于15 mm。除FD-4以外的5株菌株对鼠伤寒沙门氏菌均有抑制作用,FD-8对其抑制作用最强,抑菌圈直径约14.69 mm。以上结果表明,本研究筛选得到的6株乳酸菌对革兰氏阴性和革兰氏阳性病原菌均具备不同程度的抗菌活性,其中菌株FD-8和FD-13的抑菌活性最强。
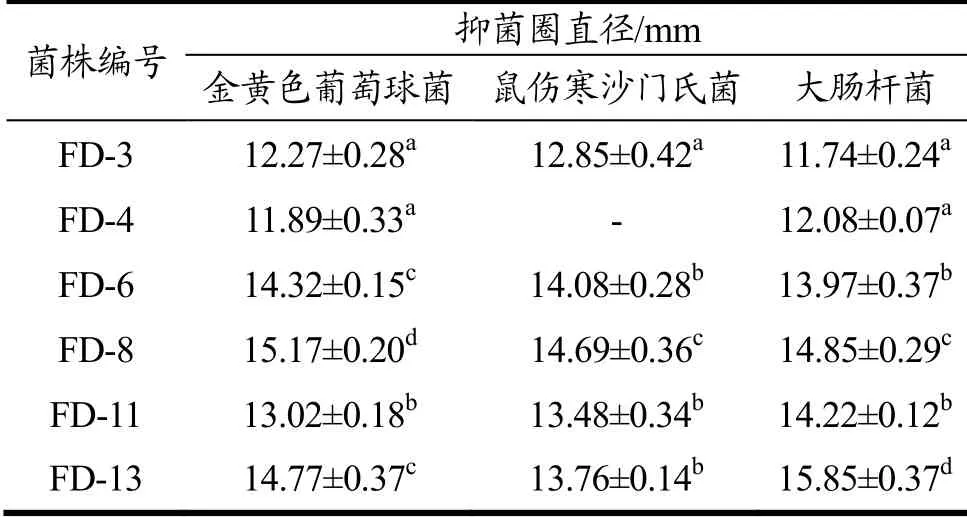
表3 乳酸菌对致病菌的抑制作用Table 3 The inhibitory effects of selected lactic acid bacteria strains against pathogenic microorganisms
2.3 乳酸菌的安全性评价
在应用安全方面,传统的乳酸菌菌种已有很长的历史,由于大多数乳酸菌菌种是从食品或健康动物肠道内分离出来的,因此被认为是没有致病可能性的食品级安全微生物[22]。但对通过不同方法得到的乳酸菌菌株在应用前做严格的安全性检测仍是十分必要的。溶血试验的结果显示,培养基上的金黄色葡萄球菌周围出现了透明溶血环(图1g),为β-溶血,6株乳酸菌菌株未产生溶菌环(图1a~1f)。6株分离菌株对常见的几种抗生素均表现一定的敏感性(表4)。
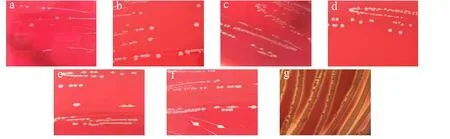
图1 乳酸菌的溶血性(2×)Fig.1 The hemolytic activity of six lactic acid bacteria (2×)

表4 乳酸菌的抗生素敏感性Table 4 Antibiotic sensitivity of lactic acid bacteria
2.4 体外筛选降胆固醇的乳酸菌
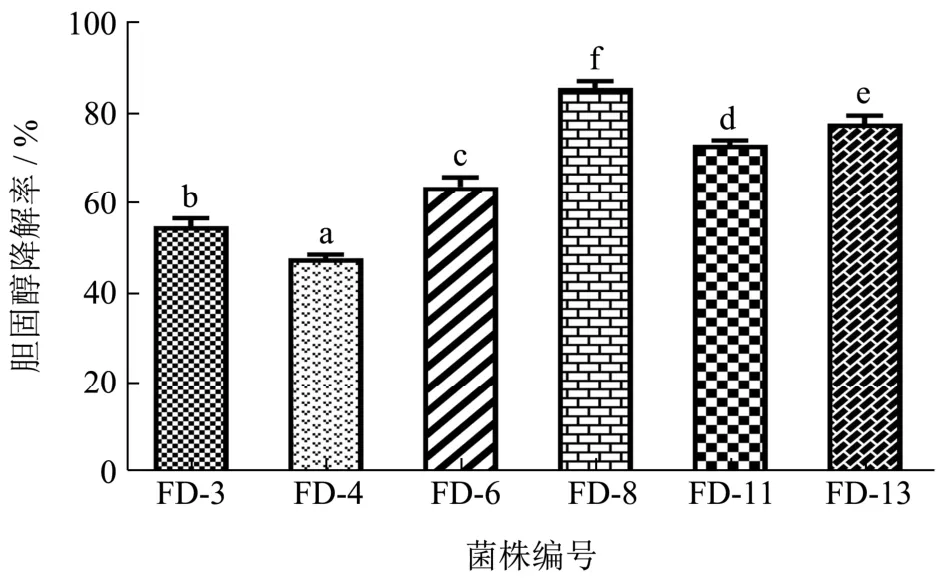
图2 乳酸菌的体外降胆固醇率测定Fig.2 Determination of cholesterol-lower in grate of lactic acid bacteria in vitro
国内针对乳酸菌降胆固醇作用及机理研究的起步比国外同行晚,且大多局限于体外试验[23,24]。测定乳酸菌菌株在高胆固醇培养基中培养后发酵液上清中胆固醇的减少量是确定乳酸菌是否具有降胆固醇特性的主要方法[25]。为了比较上述6株乳酸菌分离株的降胆固醇能力,本试验利用该方法测定候选乳酸菌的胆固醇降解率,首先以胆固醇浓度为横坐标,吸光度为纵坐标,绘制标准曲线,其中胆固醇浓度在0~1 mg/mL的范围内,吸光度与胆固醇浓度呈良好的线性关系。图2表示利用领苯二甲醛比色法测得的6株乳酸菌的体外胆固醇降解率。结果显示,所有乳酸菌的体外胆固醇降解率都达到45%以上,其中乳酸菌FD-8对胆固醇降解率最高(85.66%),而乳酸菌FD-4的胆固醇降解率最低(47.66%),因此选择FD-8菌株开展下一步的体内试验。
2.5 乳酸菌FD-8对高脂饮食小鼠的影响
2.5.1 乳酸菌FD-8对高脂饮食小鼠各项指标的影响
如表5所示,在试验进行5 w后,对照组小鼠的最终体质量平均为33.26 g,而高脂模型组小鼠的平均体质量明显增高达到38.59 g(p<0.05),说明成功建立了小鼠的高脂模型。不同浓度乳酸菌FD-8饲喂组小鼠的体质量、摄食量、饲料利用率与对照组相比无显著差异(p>0.05)。灌喂不同浓度乳酸菌FD-8的小鼠平均体质量分别为33.01、33.72和34.08 g,显著低于高脂模型组小鼠(p<0.05),说明FD-8对高脂小鼠体质量增加具有明显抑制作用,其中高剂量的FD-8对体质量抑制作用更大。同时,整个试验过程中,各组小鼠均未出现异常表现和非正常死亡现象,表明乳酸菌FD-8饲喂对小鼠不会产生不良影响。
2.5.2 乳酸菌FD-8对高脂饮食小鼠脏器指数的影响
从表6中可以看出,饲喂高脂饲料5 w后,高脂模型组小鼠的肝脏指数为5.63 mg/g,比对照组小鼠的肝脏指数4.89 mg/g显著升高了0.74 mg/g(p<0.05),表明高脂饲料中的胆固醇有一部分在肝脏组织内沉积下来而没有得到完全代谢,导致肝脏的质量增加[25];高剂量和中剂量乳酸菌饲喂组小鼠的肝脏指数分别为4.75 mg/g和4.98 mg/g,显著低于高脂模型组小鼠(p<0.05),这说明灌喂一定剂量乳酸菌FD-8可以减少脂类在小鼠肝脏内的沉积;而心脏、脾脏和肾脏的指数无显著差异(p>0.05)。
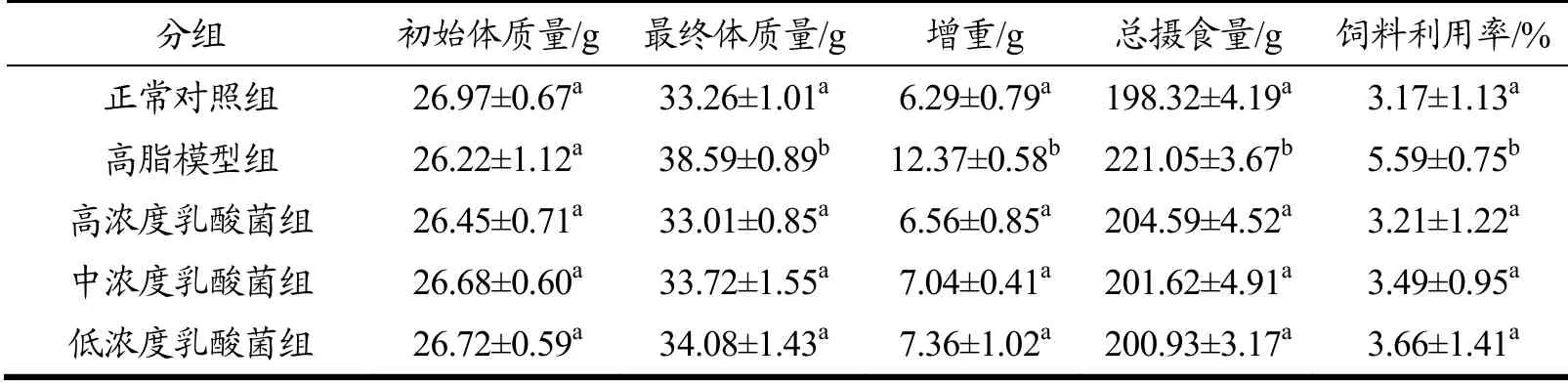
表5 小鼠的体质量增加量、摄食量和饲料利用率Table 5 Body weight, total food intake, and food efficiency of mice in different groups
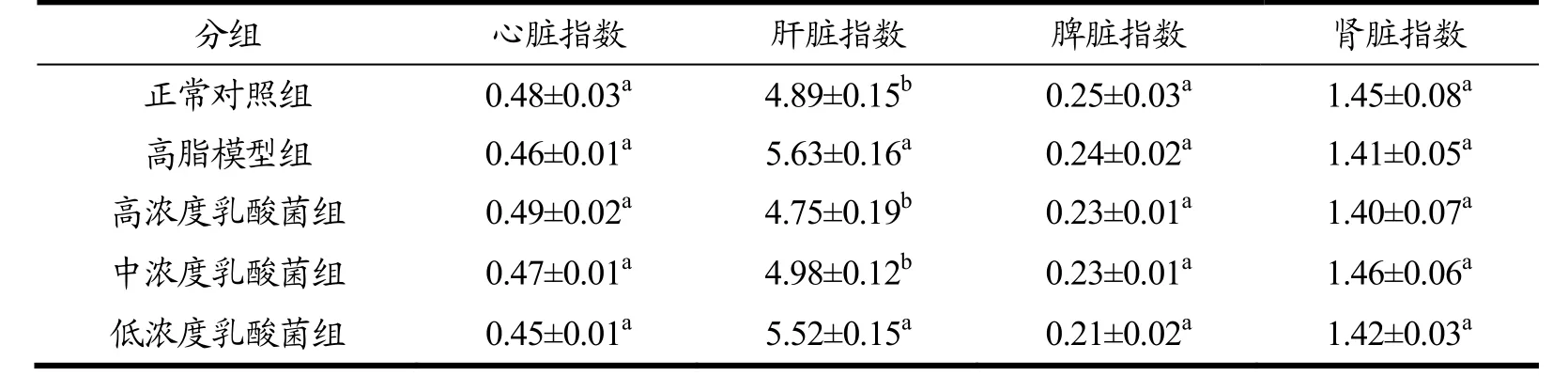
表6 各组小鼠的脏器指数Table 6 Organ indices of mice in each group (mg/g)
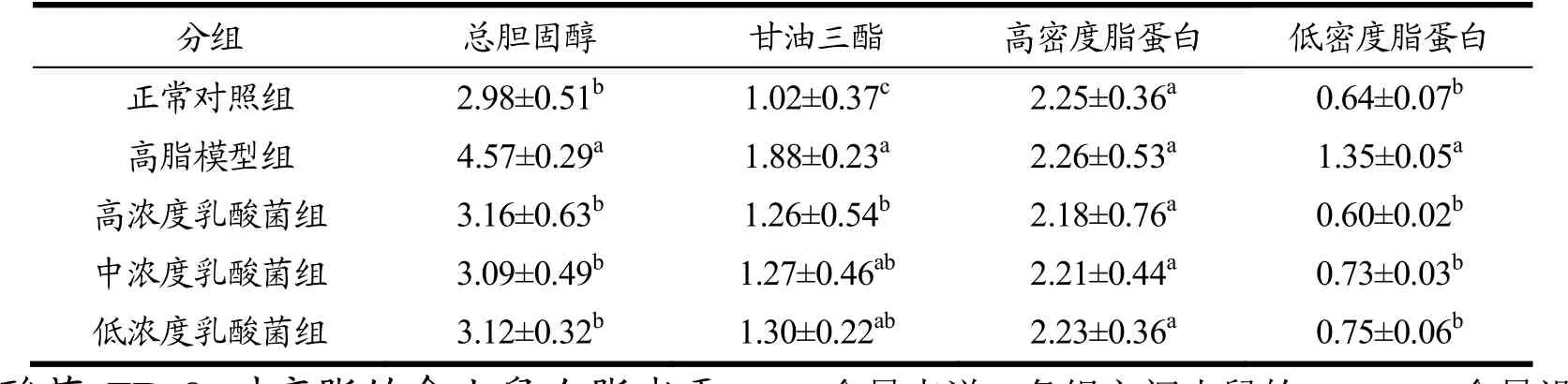
表7 小鼠血清总胆固醇、甘油三酯、高密度脂蛋白和低密度脂蛋白含量Table 7 TC, TG, HDL-C, and LDL-C contents in serum of mice in different groups (mmol/L)
2.5.3 乳酸菌FD-8对高脂饮食小鼠血脂水平的影响
TC是衡量脂代谢的重要指标,代表了血清中含有的胆固醇总和[26],而TG由长链脂肪酸和甘油组成,主要存在于心脏和肝脏,是引起人体病变的重要因素之一[27]。LDL-C作为含胆固醇的脂蛋白是内源性胆固醇的载体,LDL-C浓度越高,冠心病的发病率就越高[28]。本试验中,不同浓度乳酸菌饲喂组小鼠的TC、TG和LDL-C含量均显著低于高脂模型组(p<0.05),表明乳酸菌FD-8具有抑制血清中TC、TG和LDL-C含量增加的作用,其中高浓度FD-8饲喂组的效果更明显,TG含量为1.26 mmol/L,LDL-C含量为0.60 mmol/L,均是各组中最低的(表7)。对于HDL-C含量来说,各组之间小鼠的HDL-C含量没有显著差异(p>0.05),表明灌喂乳酸菌FD-8对血清HDL-C含量没有明显作用。已有研究表明,乳酸菌可以降低血清TC、TG 和LDL-C含量,而对HDL-C的作用较小[29],这与我们试验的结果相一致。
2.5.4 乳酸菌FD-8对高脂饮食小鼠肝脏脂质水平的影响
肝脏是脂质代谢的重要器官,高脂饮食会引起肝损伤。因此,为了进一步研究发酵乳杆菌FD-8对高脂饮食小鼠肝脏的影响,测定了肝脏中TC和TG的含量。与预期的结果一致的是,试验进行5 w后,高脂模型组小鼠肝脏中TC和TG含量分别达到0.13 mmol/g和2.86 mmol/g,显著高于对照组小鼠0.08 mmol/g和1.63 mmol/g(p<0.05);乳酸菌灌喂后小鼠的肝脏中TC和TG含量则显著降低(p<0.05),高浓度乳酸菌组的小鼠TC含量降至0.07 mmol/g,TG含量降至1.15 mmol/g,说明灌喂乳酸菌FD-8可以促进体内胆固醇代谢,减少胆固醇在高脂小鼠肝脏中的存积(见表8)。
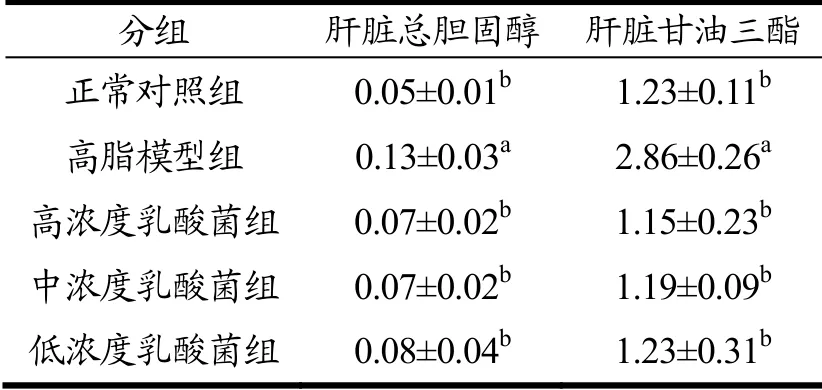
表8 小鼠肝脏总胆固醇和甘油三酯含量Table 8 TC and TG contents in livers of mice in different groups (mmol/g)
3 结论
自然发酵面团是一种有着悠久应用历史的传统面食发酵剂,而乳酸菌构成了其主要菌种。本研究从哈尔滨周边农户家的自然发酵面团中分离得到一株发酵乳杆菌FD-8,经分析该菌株具备良好的耐酸、耐胆盐及抑菌活性,同时无溶血性且对某些抗生素具备一定敏感性,更重要的是能够发挥体外降胆固醇作用和降低高脂饮食小鼠血脂的作用,为进一步开发降胆固醇功能性乳酸菌制品及其他功能性食品提供了理论依据。

