牙膏中鼠李糖乳杆菌检测方法的建立
郑方媛 吴 渊 梁媛媛 夏琪琪 周志南 刘鹏鹏
(浙江方圆检测集团股份有限公司,浙江省市场监管生物安全重点实验室,浙江 杭州 310018)
近年来,口腔疾病已成为我国最为多发的常见病之一,涉及人群高达90%以上,菌群失调是引起口腔疾病的重要因素[1,2]。益生菌(Probiotics)对口腔健康的促进及调节作用已有诸多研究论证[3-7],在牙膏中添加益生菌或其功效成分,可以有效改善口腔菌群失调。鼠李糖乳杆菌(Lactobacillus rhamnosus)是应用最广泛的益生菌之一,Elgamily等[8]实验证明L.rhamnosus抗菌性和再矿化潜力优于多种生物活性多肽,推荐作为牙膏中的有效抗菌抑菌治疗剂。
由于缺乏有效的牙膏中益生菌鉴定技术手段及监管措施,益生菌牙膏市场存在产品质量参差不齐的状况,市售益生菌牙膏存在如益生菌标识与实际使用菌株不一致等现象。在中国益生菌行业中,除了根据《食品安全国家标准—食品微生物学检验—乳酸菌检验(GB4789.35-2016)》进行活菌数的测定和《食品用益生菌通则》团体标准外,并无其他相关标准用于益生菌产品的生产和经营。而传统表型鉴定方法在菌种检测对象上受限,操作复杂,耗时长,迫切需要建立快速、可靠的牙膏益生菌种类鉴定方法。
聚合酶链式反应(Polymerase chain reaction,PCR)广泛应用于医学和食品安全等领域病菌检测[9,10]。相对于传统表型鉴定方法,稳定性好、特异性好、灵敏度高。为适应市场益生菌牙膏检测技术开发需求,本研究基于PCR检测技术,以添加了L.rhamnosus的牙膏为研究对象,以德氏乳杆菌(Lactobacillus delbrueckii)等4种菌种为对照,以促旋酶基因gyrB为靶标建立益生菌牙膏中L.rhamnosus成分的检测技术并对其灵敏度和含量进行检测和评价,旨在为益生菌牙膏产品的质量控制提供技术参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
实验用参考菌株:3株乳杆菌属参考菌株(鼠李糖乳杆菌L.rhamnosus,菌株编号:CICC6224、德氏乳杆菌L.delbrueckii,菌株编号:CICC6077、莱士曼氏乳杆菌Lactobacillus.leichmannii,菌株编号:ATCC7830),2株非乳杆菌属参考菌株(蜡样芽孢杆菌Bacillus.cereus,菌株编号:CICC23828、动物双歧杆菌Bifidobacterium,菌株编号:ATCC7830)由中国工业微生物保藏管理中心提供。
乳杆菌属以及动物双歧杆菌采用MRS琼脂[11]平板划线,厌氧培养,分离与纯化;蜡样芽孢杆菌采用营养琼脂[12]平板划线、分离与纯化。
1.1.2 试剂
细菌基因组DNA提取试剂盒(离心柱型)购自天根生化科技(北京)有限公司;PCR引物(纯化方法:PAGE,polyacrylamide gel electrophoresis)、DL 2000DNA marker、琼脂糖(Agarose Regular)、10×TBE缓冲溶液(Tris-EDTA)、1000×D-HelixRed核酸染料和双蒸馏水(ddH2O)购自宝日医生物技术(北京)有限公司;2×PCR TaqMix 购自北京美莱博医学科技有限公司;MRS琼脂和普通琼脂平板培养基购自北京陆桥生物技术有限责任公司。
1.2 主要仪器与设备
Microfuge 16台式微量离心机,美国贝克曼库尔特有限公司;Nano-300超微量分光光度计,杭州奥盛仪器有限公司;D1200板式加热器,美国Labnet’s公司;ABI Veriti 梯度PCR仪,美国应用生物系统公司;Powerpac HC 1645052伯乐高流核酸电泳仪,美国Bio-Rad公司;Gel-Doc-XR+凝胶成像系统,美国Bio-Rad公司。
1.3 试验方法
1.3.1 样品前处理
牙膏样品A(L.rhamnosus浓度:0.01%)、B(浓度:0.03%)、C(浓度:0.05%)、D(浓度:0.10%),各取1.0g加入10g无菌水于离心管中充分混匀,制成浓度10%的牙膏水溶液,取1.0mL牙膏水溶液加至1.5mL离心管中,10000rpm离心2min弃上清,收集沉淀,标记-20℃保存备用。
1.3.2 DNA提取
参照细菌基因组DNA提取试剂盒使用手册提取A、B、C、D牙膏样品菌种DNA。乳杆菌属以及动物双歧杆菌接种于MRS琼脂,37℃厌氧培养16~24h,蜡样芽孢杆菌接种于营养琼脂,37℃培养16~24h,用50 μL ddH2O收集培养物,置于95℃板式加热器内裂解10min作为阳性和对照菌种DNA样本。提取的DNA用超微量分光光度计检测,并将其浓度调整为约20 ng·μL-1,-20℃保存备用。
1.3.3 PCR扩增体系及程序
参考杨小红等[13]所用的L.rhamnosus特异性PCR引物组(rhaF,rhaR),经国家生物技术信息中心(NCBI)进行同源性比对验证,该区段基因为L.rhamnosus促旋酶基因gyrB的一段序列,具有特异性。利用细菌通用编码16S rRNA相对应的染色体基因16sr DNA引物序列组对提取的牙膏中添加的L.rhamnosus有效成分进行扩增测序。
以提取的牙膏中菌种DNA和参考菌株的基因组DNA为模板,利用rhaF,rhaR引物组进行PCR扩增。20 μL PCR体系见表1,使用梯度PCR仪扩增,程序设置为:95℃ 5min,30个循环(95℃ 15s,57℃ 30s,72℃ 30s),72℃ 10min,4℃保存。
核酸电泳检测方法为在1%琼脂糖凝胶上以120 V的电压对7.0μL扩增产物进行30min电泳,在凝胶成像系统上观察并拍照记录扩增结果。
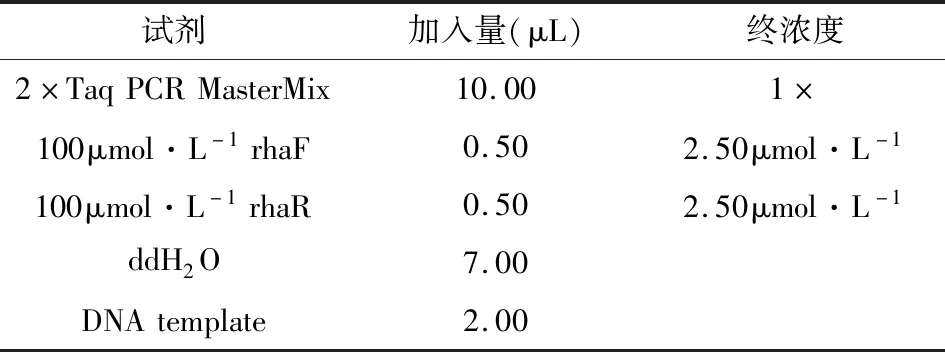
表1 PCR反应体系
1.3.4 PCR反应特异性测试
用rhaF,rhaR引物组分别对菌株L.rhamnosus,CICC6224、 L.delbrueckii,CICC6077、L.leichmannii, ATCC783、B.cereus,CICC23828、Bifidobacterium,ATCC7830进行扩增,以等体积ddH2O为模板空白对照,以不含以上菌株的DNA作为阴性对照。所有DNA均使用ddH2O稀释至1 ng·μL-1作为模板,反应结束后分别取7.0μL扩增产物利用核酸电泳进行检测。
1.3.5 对含不同浓度鼠李糖乳杆菌牙膏的PCR测试及测序
用rhaF,rhaR引物组分别对A(浓度:0.01%)、B(浓度:0.03%)、C(浓度:0.05%)、D(浓度:0.10%)4个牙膏提取的DNA(0.10 ng/μL)进行PCR扩增,以等体积L.rhamnosus,CICC6224阳性菌株的DNA为阳性对照,ddH2O为模板空白对照,以不含鼠李糖乳杆菌的DNA作为阴性对照。产物经1%琼脂糖凝胶电泳检测。
用细菌16S rDNA通用引物组(27F,1492R[14])对L.rhamnosus,CICC6224进行PCR扩增,并对其PCR产物经纯化后测序,所测16S rDNA序列与GenBank数据库中的L.rhamnosus序列进行BLAST比较。反应体系(25μL):2×Taq PCR MasterMix 10μL,引物16SrDNA F和16SrDNA R(100 μmol·L-1)各0.5 μL,模板DNA 2.0μL,加ddH2O补足。扩增程序:95℃ 5min,30个循环(95℃ 15s,57℃ 30s,72℃ 130s),72℃ 10min,4℃保存。引物由上海生工生物工程技术服务有限公司完成测序。
1.3.6 PCR反应灵敏度测试
将L.rhamnosus浓度为0.05%的牙膏提取的DNA(20ng·μL-1)进行梯度稀释至DNA浓度为:1ng·μL-1、0.5ng·μL-1、0.1ng·μL-1、0.05ng·μL-1、0.01ng·μL-1,用rhaF,rhaR引物组分别对这5个浓度梯度DNA进行PCR扩增,以等体积L.rhamnosus,CICC6224阳性菌株的DNA为阳性对照,ddH2O为模板空白对照,以不含L.rhamnosus的DNA作为阴性对照。产物经1%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 PCR反应特异性测试结果
使用rhaF,rhaR引物组分别对5种菌株进行PCR扩增实验,电泳结果见图1。以ddH2O为模板的空白对照以及阴性对照无扩增产物,说明反应系统自身不发生扩增;以L.rhamnosus DNA为模板的反应产物在电泳图上显示核酸条带,条带长度与理论长度376bp相符,以L.delbrueckii、L.leichmannii、B.cereus、Bifidobacterium DNA为模板的扩增结果中无PCR特征条带。说明以L.rhamnosus gyrB基因设计的特异性引物系统对L.rhamnosus DNA检测具有良好的特异性。
2.2 对含不同浓度鼠李糖乳杆菌牙膏的PCR试验及测序结果
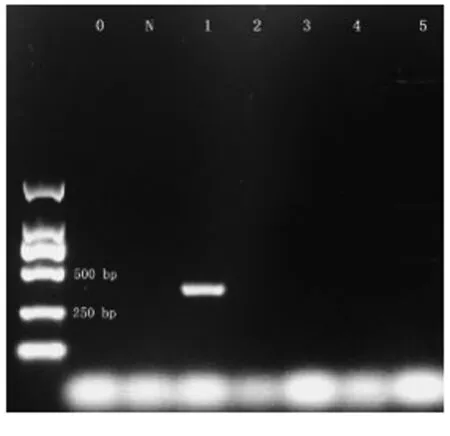
将含0.01%、0.03%、0.05%、0.10%四个浓度的L.rhamnosus牙膏提取的DNA(0.10ng·μL-1)用作PCR反应的模板。电泳图显示条带的亮度随着L.rhamnosus浓度的增大而增强,且条带长度与理论长度376 bp相符,空白及阴性对照均无条带,阳性对照组显示阳性(图2),说明扩增有效,并且通过PCR反应可以检测到牙膏样品中的L.rhamnosus,且根据条带亮度可以判断浓度范围。
注:0:ddH2O模板;N:阴性对照;1-5表示各种菌的DNA模板1:鼠李糖乳杆菌L.rhamnosus,2:蜡样芽孢杆菌B.cereus,3:德氏乳杆菌L.delbrueckii,4:莱士曼氏乳杆菌L.leichmannii,5:动物双歧杆菌Bifidobacterium。
注:0:ddH2O模板;N:阴性对照;P:阳性对照;1-4:不同浓度鼠李糖乳杆菌的牙膏提取DNA 1:0.01%,2:0.03%,3:0.05%,4:0.10%。
将含有L.rhamnosus浓度为0.10%的牙膏C提取的DNA进行16S rDNA扩增,测序后与GenBank数据库中的L.rhamnosus 序列进行比较,结果均显示与L.rhamnosus的序列一致性最高,说明牙膏中所添加的为L.rhamnosus的有效成分,含有L.rhamnosus DNA,并且建立的L.rhamnosus PCR体系能实现对牙膏中L.rhamnosus成分的有效检测。
2.3 PCR反应灵敏度测试结果
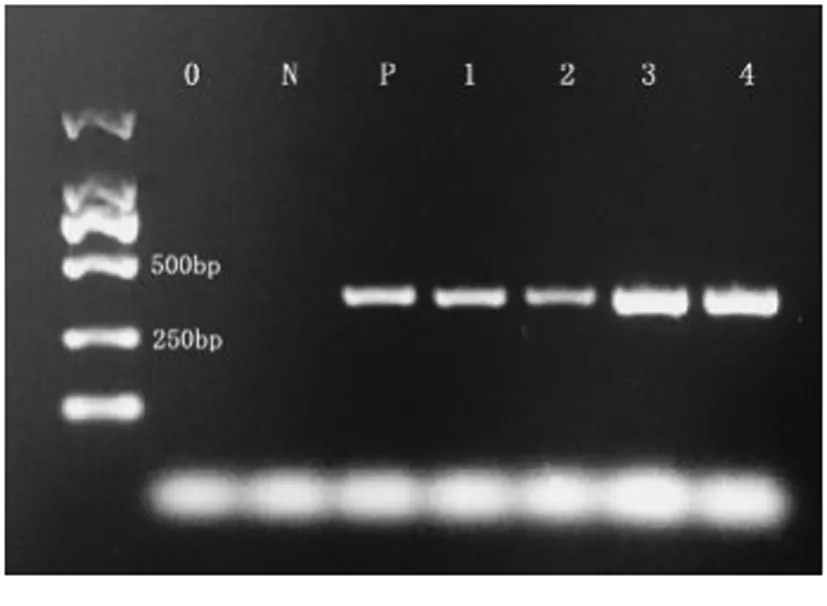
将含L.rhamnosus牙膏提取的DNA浓度稀释为1ng·μL-1、0.5ng·μL-1、0.1ng·μ-11、0.05ng·μ-11、0.01ng·μ-11,并用作PCR反应的模板。电泳图在DNA浓度大于0.1ng·μ-11时显示阳性结果(图3)。在小于0.1ng·μ-11浓度下阳性较弱,结果判读不可靠。因此对检测牙膏中L.rhamnosus成分的PCR扩增方法灵敏度为0.1ng·μ-11。
注:0:ddH2O模板;N:阴性对照;P:阳性对照;1-5:DNA浓度 1:1ng·μ-11,2:0.5ng·μ-11,3:0.1ng·μ-11,4:0.05ng·μ-11,5:0.01ng·μ-11。
3 结论
益生菌牙膏产品的菌种组成与含量是产品质量的关键,基于L.rhamnosus gyrB基因的PCR方法对L.rhamnosus菌株检测具有良好的特异性,且能实现牙膏中L.rhamnosus菌株的精确鉴定,该方法灵敏度为0.1ng·μ-11,该检测限和灵敏度可基本满足需求。构建适合益生菌产业应用的快速、精准的菌株检测技术已成为益生菌行业的重要研究方向,本研究为建立和完善牙膏益生菌产品的质量控制提供技术参考,有助于提升产品评价、质量控制及市场监管水平。
由于试验样品的限制,为适应更广的益生菌产品市场检测应用领域,该方法设计的益生菌牙膏产品的菌种特异性扩增体系结合电泳的检测方法对除本试验中的L.rhamnosus外的其他益生菌菌株(如副干酪乳杆菌、双岐杆菌等)的特异性扩增试验有待进一步研究与填充,且益生菌牙膏产品中菌株有效成分的微量/痕量的检测还需进一步稳定性研究。

