红毛丹果皮花色素苷鉴定及其稳定性分析
李奕星,陈 娇,李芬芳,洪克前,袁德保
(1.中国热带农业科学院海口实验站 海南省香蕉遗传改良重点实验室,海南 海口 571101;2.中国热带农业科学院南亚热带作物研究所 海南省热带园艺产品采后生理与技术重点实验室,广东 湛江 524088)
果实外观色泽是其品质性状的重要评价指标之一,良好的色泽能提高果实的商品性。红毛丹因其果实鲜红的色泽、独特的风味而深受消费者喜爱。然而,红毛丹诱人的果皮极易褪色与褐变,这是限制红毛丹长期贮运、导致其货架期短和商品价值降低的主要因素。据报道,红毛丹的果皮色素为花色素苷[1]。花色素苷属于多酚类物质,分布于植物的根、茎、叶、花、果实等液泡中,赋予植物以红、橙、黄、蓝、紫等种颜色[2],富含花色素苷的果蔬历来是人们喜欢的食物原料,而花色素苷的变化是影响花与果实外观颜色变化的重要因素。花色素苷是一种水溶性黄烷类植物色素,在自然状态下,植物组织中的花色素苷非常稳定,日照、温度等对其几乎没有影响。但是,由于花色素苷母核中有活跃的羟基,且花色素苷的阳离子因缺少电子易发生化学反应,其稳定性易受到温度、pH 值、光照、氧气等因素的影响,导致花色素苷降解,呈色也会发生变化,这也会使得贮藏加工过程中果蔬品质下降[3]。如在低pH 值下花色苷较为稳定,其呈红色;但是,随着pH 值的升高,花色素苷迅速变色及降解,促使果皮迅速褐变[4]。过氧化物酶及多酚氧化酶在酚的作用下,可以促进花色素苷的降解,使果皮进一步褐变[5-6]。因此,了解红毛丹果皮中花色素苷的主要组成成分及稳定性,对于揭示红毛丹的褐变机理,防止或减轻果皮褐变具有重要的理论和实践意义。
1 材料与方法
1.1 材 料
1.1.1 试材与试剂
供试的‘保研-7号’红毛丹Nephelium lcrppuceumLinn.果实购于海南省海口市,选择成熟度一致、色泽一致、无虫无病害的新鲜果实作为供试样品。
甲醇和乙腈(色谱纯),德国Merck 公司生产;甲酸(液质纯),美国赛默飞世尔科技公司生产;色谱用水为蒸馏水,屈臣氏集团有限公司生产;分析用水为纯水机自制水,其他试剂均为分析纯。矢车菊素-3-O-葡萄糖苷(批号为wkq19403131)和对照品原花青素B2(批号为wkq19042903)均购于四川省维克奇生物科技有限公司,其纯度均大于98%。
1.1.2 仪器与设备
Thermo Dionex UltiMate 3000 高效液相色谱仪、Thermo Q-Exactive Focus Orbitrap 质谱仪,美国赛默飞世尔科技公司;EVOLUTION 300 紫外可见分光光度计,上海莱睿科学有限公司;LRH-250-SE 恒温恒湿培养箱,广东泰宏君科学仪器股份有限公司;FE28-TRI pH 计,梅特勒-托利多仪器有限公司。
1.2 方 法
1.2.1 红毛丹果皮花色素苷提取液的制备
精密称取一定量的粉碎的新鲜红毛丹果皮,加入料液比为1∶5(g∶mL)的酸化乙醇(95%的 乙 醇∶1.5 mol·L-1的HCl = 85∶15,V∶V),于40 ℃的温度条件下浸提1 h,以4 000 r·min-1的转速离心15 min,反复浸提3 次,合并上清液,并用酸化乙醇定容。
1.2.2 红毛丹果皮中花色素苷的组分分析
色谱条件:Thermo Scientific Hypersil GOLD aQ 色谱柱(100 mm × 2.1 mm,1.9 μm), 美国赛默飞世尔科技公司;所用检测器为二极管阵列(DAD)检测器,流动相(体积分数)由A(0.1%的甲酸水)与B(100%的乙腈)组成。流动相洗脱梯度:0 ~2 min,95%~90%,A;2 ~5 min,90% ~85%(A);5 ~12 min,85% ~55%(A);12 ~15 min,55%~25%(A);15 ~20 min,25%~5%(A);20 ~20.1 min,5%~95%(A);20.1 ~25 min,95% (A)。流速为0.3 mL·min-1,柱温为35 ℃,进样量为2 μL。
质谱条件:电喷雾离子源(ESI);正离子模式下检测(Positive);数据采用一级母离子全扫描和数据依赖性前三强二级子离子扫描模式(Full Scan-ddMS2);扫描范围:120 ~1 500 m·z-1;分辨率:35 000;毛细管温度:320 ℃;鞘气压力为30 Arb;辅助气压力为 10 Arb;喷雾电压为3.5 kV;碰撞能量:50 V。
1.2.3 红毛丹果皮中花色素苷质量分数的测定
用紫外可见分光光度计,在波长为400 ~700 nm 处,对红毛丹果皮花色素苷的提取液进行光谱扫描,以确定最大吸收波长;采用pH 示差法[7]测定红毛丹果皮中花色素苷的质量分数,设3次重复,按如下公式计算花色素苷含量(JT,mg·kg-1):
JT(mg·kg-1) = (A/ε)×MW×DF×V/Wt;
A=ApH1.0(A535nm-A700nm)-ApH4.5(A535nm-A700nm)。
式中:ε表示消光系数(L·mol-1),取值为26 900 L·mol-1;MW表示矢车菊素-3-O-葡萄糖苷的摩尔质量(g·mol-1),取值为449.2 g·mol-1;DF表示稀释倍数;V表示提取液体积(mL);Wt表示样品质量(g);A表示提取液在pH 值分别为1.0 和4.5 时吸光值的差值,ApH1.0、ApH4.5分别表示提取液pH 值分别为1.0 和4.5 时的吸光值,A535nm表示提取液在535 nm 处的吸光值,A700nm表示提取液在700 nm 处的吸光值。
1.2.4 温度对红毛丹果皮中花色素苷稳定性的影响
取4 份红毛丹果皮的花色素苷提取液,每份各取1 mL,用酸化乙醇定容至25 mL,然后将其分别置于4、12、25、40 ℃的温度条件下避光恒温保存,再分别于保存后的0、2、4、6、8 d 测定波长为535 nm处的吸光值(A)。每个处理各设3 次重复,以花色素苷的保存率(R)表示测定结果,以此分析不同温度对红毛丹果皮花色素苷稳定性的影响情况。
R=A/A0,A0为初始吸光值。
1.2.5 光照对红毛丹果皮花色素苷稳定性的影响
参照吴春太等[8]的方法,取3 份红毛丹果皮花色素苷提取液,每份各取1 mL,用酸化乙醇定容至25 mL,然后将其分别置于日光灯、自然光、黑暗条件下保存,每隔1 h 取样1 次,测定波长为535 nm 处的吸光值,计算花色素苷的保存率(R)。每个处理各设3 次重复。
1.2.6 食品添加剂对红毛丹果皮花色素苷稳定性的影响
取4 份花色素苷提取液,每份各取1 mL,分别加入24 mL 的蒸馏水、5%的葡萄糖溶液、5%的蔗糖溶液、5%的柠檬酸溶液,摇匀,避光保存5 d,每天取样测其在波长为535 nm 处的吸光值,计算花色素苷的保存率(R)。以蒸馏水为对照(CK),每个处理各设3 次重复。
1.2.7 pH 值对红毛丹果皮花色素苷稳定性的影响
参照于聪等[9]的方法(稍有改动)测定红毛丹果皮中花色素苷的稳定性。取4 份花色素苷提取液,每份各取1 mL,然后用pH 值分别为1、2、3、4、5、6、7 的缓冲液将其定容至25 mL,定容24 h 后,测定其波长为535 nm 处的吸光值,计算花色素苷的保存率(R)。每个处理各设3 次重复。
1.2.8 氧化剂和还原剂对红毛丹果皮花色素苷稳定性的影响
参照宋鹏等[10]的方法(稍有改动)测定红毛丹果皮中花色素苷的稳定性。以H2O2为氧化剂,以Na2SO3为还原剂,配制浓度分别为0.5%、1.0%、2.0%、3.0%的H2O2溶液和Na2SO3溶液,取2 mL红毛丹果皮花色素苷提取液,分别加入不同浓度的H2O2溶液或Na2SO3溶液至25 mL,摇匀后将其置于暗处,2 h 后测定其在波长为535 nm 处的吸光值,计算花色素苷保存率(R),每个处理各设3 次重复。
1.3 数据处理
使用SPSS 19.0 软件进行数据统计与分析;所有试验均设3 次重复,取其(平均值±标准偏差)表示试验结果。
2 结果与分析
2.1 红毛丹果皮花色素苷组分分析
红毛丹果皮中花色素苷的化学成分见表1。由表1可知,红毛丹果皮花色素苷共检测出36 种化合物,通过与已有文献比对,推断出的化合物有32 种,其分别为:芍药花素[11]、原花青素B2[12]、天竺葵素异构体[11]、天竺葵素异构体[11]、儿茶素[12]、矢车菊素-3-O-葡萄糖苷[13]、矢车菊素-3-O-芸香糖苷[13]、芍药花素-3-O-芸香糖苷[14]、矢车菊素-3-O-木糖苷[13]、(-)-儿茶素没食子酸酯[15-16]、矢车菊素-3-O-戊糖[17]、原花青素B 型[12]、飞燕草素-3-O-芸香糖苷[13]、飞燕草素-3-O-葡萄糖苷[13]、矢车菊素-3-O-芸香糖苷异构体[18]、矢车菊素-3-O-芸香糖苷异构体[18]、矢车菊素-3-O-己糖苷[19]、飞燕草素-3-O-阿拉伯糖苷[12]、(-)-表儿茶素没食子酸酯[15-16]、矢车菊素-3-O-芸香糖苷[14]、矮牵牛素-3-O-芸香糖苷[14]、矢车菊素异构体[11]、矮牵牛素-3-O-葡萄糖苷[13]、芍药花素-3-O-芸香糖苷[13]、芍药花素-3-O-葡萄糖苷[13]、锦葵色素-3-O-葡萄糖苷[12]、矢车菊素-3-O-戊糖苷[20]、原花青素A2[21]、飞燕草素[11]、矢车菊素异构体[11]、矮牵牛素[11]、锦葵色素[11]。可见,红毛丹果皮花色素苷的主要成分分别为矢车菊素(cyanidin)、飞燕草素(delphinidin)、天竺葵素(pelargonidin)、矮牵牛素(petunidin)、芍药花素(peonidin)、锦葵色素(malvidin),其连接的糖主要有葡萄糖和芸香糖。
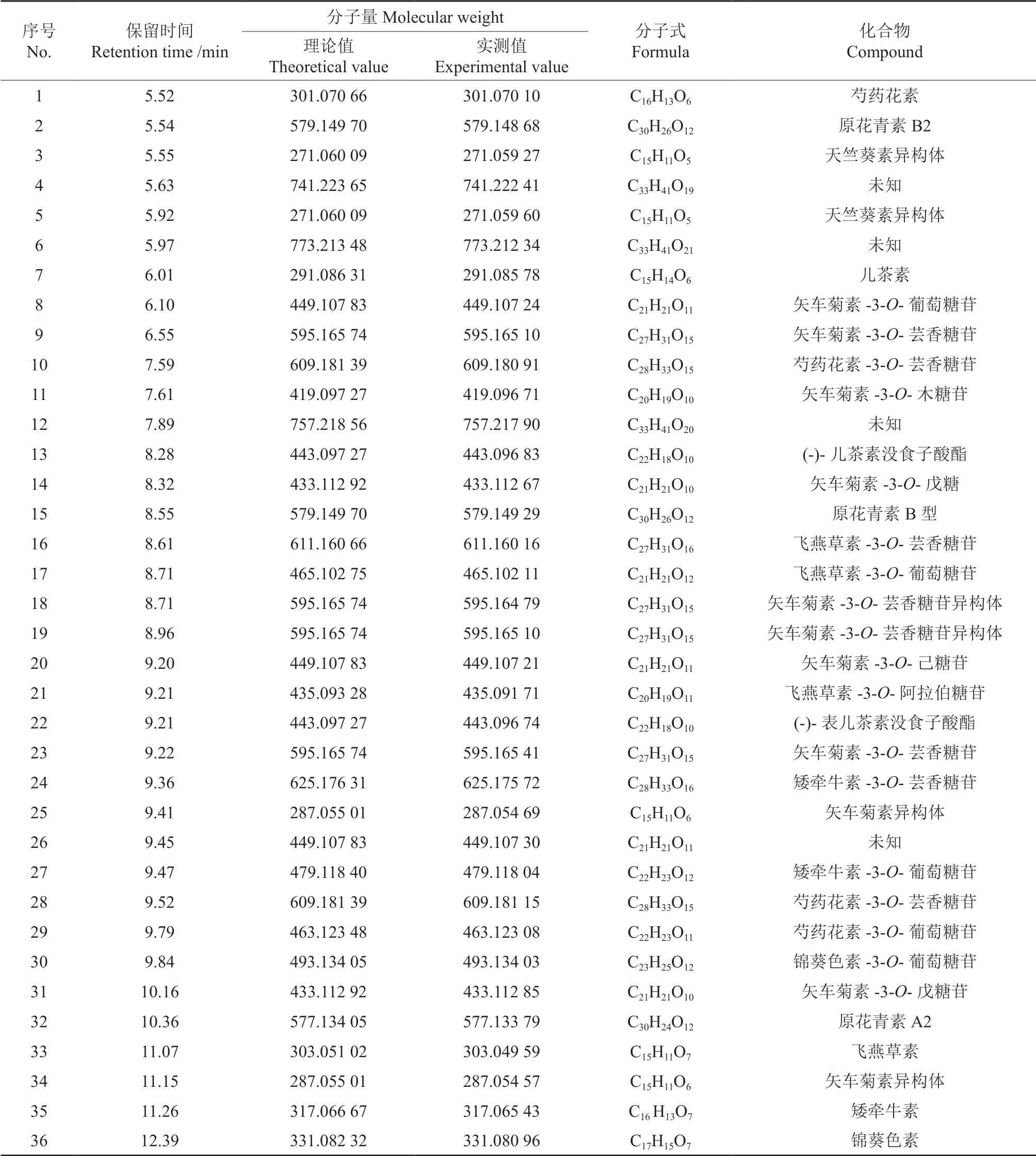
表1 红毛丹果皮中花色素苷类的化学成分Table 1 Anthocyanins composition of rambutan pericarp
2.2 红毛丹果皮花色素苷的紫外最大吸收波长及质量分数
扫描可知,红毛丹果皮花色素苷提取液的最大吸收波长为535 nm。用pH 示差法计算得出的红毛丹果皮花色素苷的质量分数为(0.119±0.003)mg·g-1。
2.3 温度对红毛丹果皮花色素苷稳定性的影响
将红毛丹果皮花色素苷提取液分别放置于不同的温度条件下,不同天数后其花色素苷的保存率如图1所示。由图1可知,放置于不同温度下的花色素苷提取液,其花色素苷的保存率随着放置时间的延长均下降,且不同温度条件下花色素苷保存率的差异显著,说明温度对红毛丹果皮花色素苷有较大的影响。放置8 d 后,置于4、12、25、40 ℃下的提取液其花色素苷保存率分别为87.96%、78.32%、36.53%、23.03%。由此可见,花色素苷的耐热性差,低温可以抑制其降解。
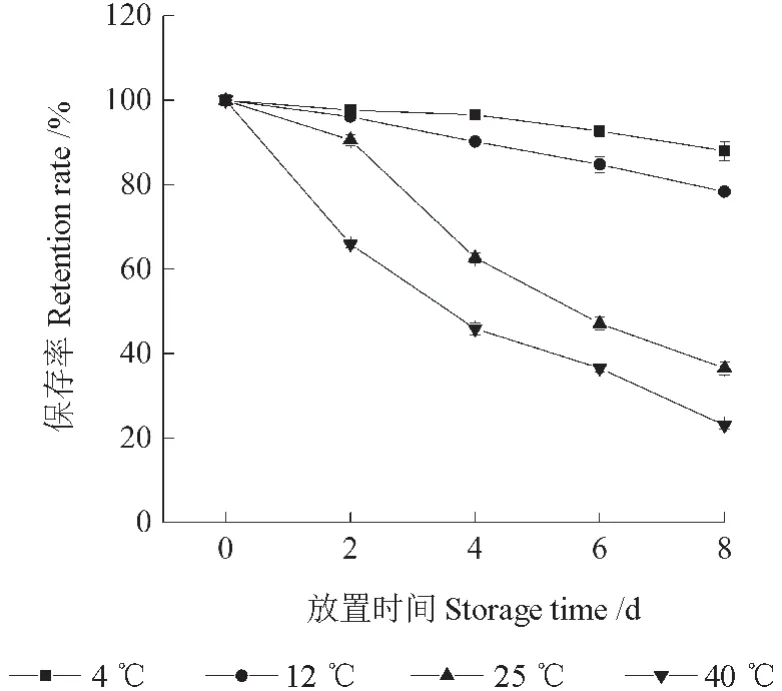
图1 温度对红毛丹果皮花色素苷稳定性的影响Fig.1 Effects of temperature on the stability of the anthocyanins in rambutan pericarp
2.4 光照对红毛丹果皮花色素苷稳定性的影响
将红毛丹果皮花色素苷提取液分别放置于自然光、日光灯、避光条件下,不同天数后其花色素苷的保存率如图2所示。由图2可知,放置于自然光、日光灯、避光条件下8 d 后,提取液中花色素苷的保留率分别为35.50%、49.37%、53.70%,其保存率均呈下降趋势。其中,放置于自然光下的提取液其花色素苷保留率的下降最为显著,其次是放置于日光灯下的,说明避光条件可以有效抑制花色素苷的降解。因此,应注意将红毛丹果皮花色素苷置于避光条件下保存。

图2 光照对红毛丹果皮花色素苷稳定性的影响Fig.2 Effects of light on the stability of the anthocyanins in rambutan pericarp
2.5 食品添加剂对红毛丹果皮花色素苷稳定性的影响
将分别加入了3 种食品添加剂的红毛丹果皮花色素苷提取液置于避光条件下保存不同天数后,提取液中花色素苷的保存率如图3所示。由图3可知,3 种食品添加剂对提取液中的花色素苷均有降解作用,添加了柠檬酸的提取液其花色素苷相对稳定,放置8 d 后,其花色素苷的保存率一直显著高于其余3 个处理的,放置期结束后,其花色素苷的保存率为70.85%,而添加了葡萄糖、蔗糖的处理组与对照组的提取液中花色素苷的保存率分别为35.97%、46.77%和40.94%。因此,柠檬酸可以维持红毛丹果皮花色素苷的稳定性。
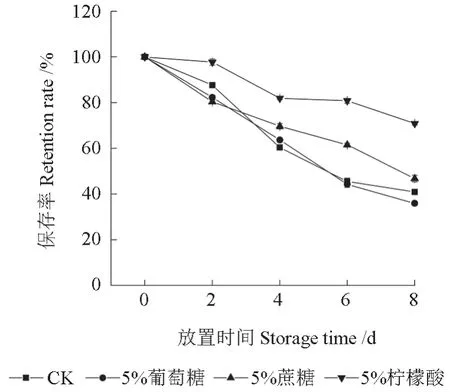
图3 食品添加剂对红毛丹果皮花色素苷稳定性的影响Fig.3 Effects of food additives on the stability of the anthocyanins in rambutan pericarp
2.6 pH 值对红毛丹果皮花色素苷稳定性的影响
用于定容红毛丹果皮花色素苷溶液的缓冲液的pH 值对其花色素苷的最大吸收波长及稳定性的影响情况见表2。由表2可知,当缓冲液的pH值≤3 时,红毛丹果皮花色素苷的最大吸收波长为535 nm,且保存24 h 后其保存率较高;当缓冲液的pH 值为1 时,其保存率最高。随着缓冲液pH 值的不断增大,其最大吸收波长发生红移现象,花色素苷的保存率迅速下降,当缓冲液的pH 值为6 时,花色素苷的保存率仅为35.50%;而当缓冲液的pH 值为7 时,红毛丹果皮花色素苷溶液变成了褐色,且无特征吸收峰。由此可见,酸性条件更利于红毛丹果皮花色素苷的保存。
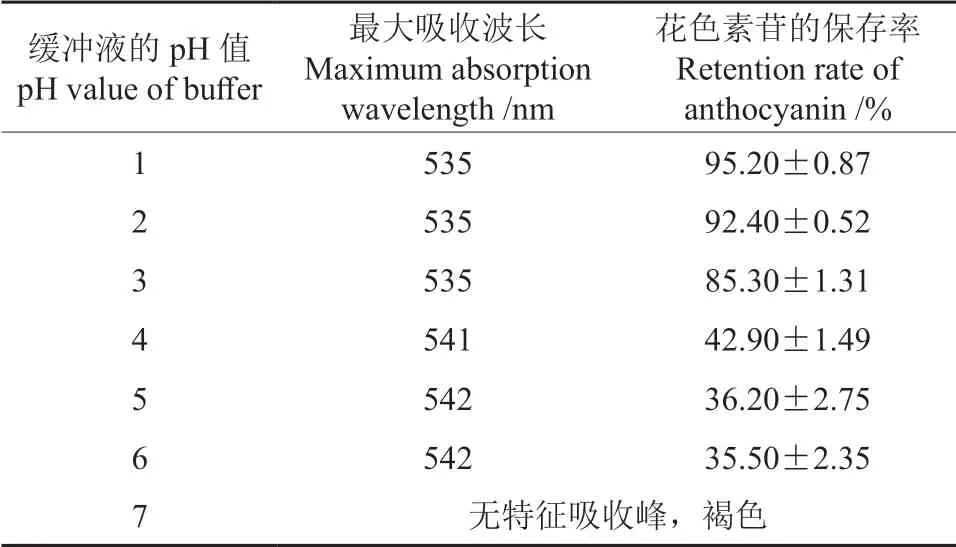
表2 缓冲液的pH 值对红毛丹果皮花色素苷的最大吸收波长及稳定性的影响Table 2 Effects of pH value of buffer on the stability of the anthocyanins in rambutan pericarp
2.7 氧化剂和还原剂对红毛丹果皮花色素苷稳定性的影响
氧化剂H2O2和还原剂Na2SO3对红毛丹果皮花色素苷稳定性的影响情况见表3。由表3可知,红毛丹果皮花色素苷对不同浓度的氧化剂和还原剂的耐受性都差,随着氧化剂H2O2或还原剂Na2SO3浓度的增加,其花色素苷的保存率均急剧下降,说明氧化剂H2O2和还原剂Na2SO3对红毛丹果皮花色素苷的破坏性均较大。
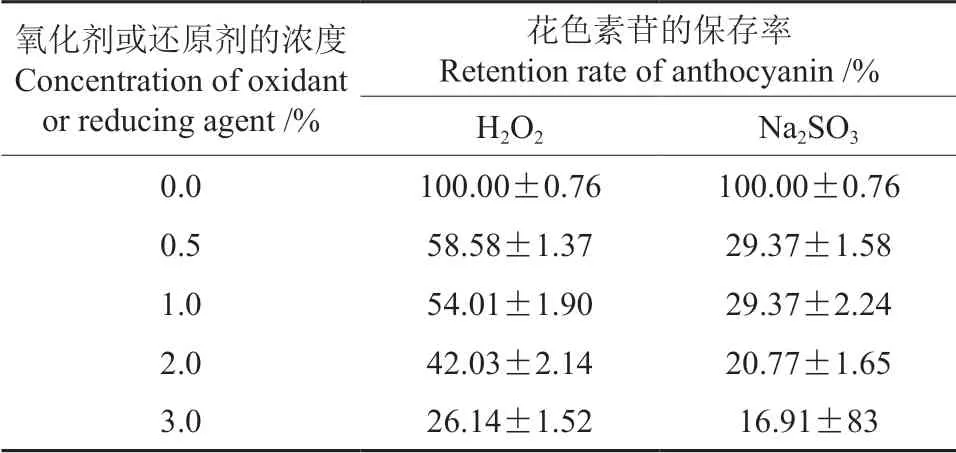
表3 氧化剂H2O2 和还原剂Na2SO3 对红毛丹果皮花色素苷稳定性的影响Table 3 Effects of H2O2 and Na2SO3 on the stability of the anthocyanins in rambutan pericarp
3 讨 论
花色素苷是天然色素的主要成分之一,影响着果实的商品特性,然而其稳定性差。在采后贮运中,果皮中的花色素苷会因为温度、光照、食品添加剂等因素的影响而发生变化,这给果实品质的保持带来了困难。本研究分析了红毛丹果皮花色素苷的主要成分,并考察了温度、光照、食品添加剂、缓冲液的pH 值、氧化剂及还原剂对其稳定性的影响情况。
不同植物所含花色素苷的主要成分是不同的,相关研究报道很多,而关于红毛丹果皮花色素苷的主要成分的研究尚未见诸报道。本研究分析了‘保研-7 号’红毛丹果皮中花色素苷的组成,结果表明,‘保研-7 号’红毛丹果皮花色素苷的主要成分为矢车菊素、飞燕草素等,连接的糖主要有葡萄糖和芸香糖。而同为无患子科的荔枝果皮,其花色素苷的主要成分为矢车菊-3-芸香糖苷、矢车菊-3-葡萄糖苷[22]。同一物种不同品种,其花色素苷的主要成分也不一定相同,如‘广紫9’紫薯花色素苷的主要成分为芍药素3-咖啡酰-p-羟基苯甲酰槐糖苷-5-葡糖苷和芍药素3-咖啡酰-阿魏酰槐糖苷-5-葡糖苷,而‘广紫12-87’紫薯花色素苷的主要成分为矢车菊素3-咖啡酰-p-羟基苯甲酰槐糖苷-5-葡糖苷和矢车菊素3-p-羟基苯甲酰槐糖苷-5-葡糖苷[23]。本研究仅对‘保研-7 号’红毛丹果皮花色素苷进行了定性分析,而有关红毛丹不同品种果皮花色素苷的主要成分及含量,有待进一步研究。
花色素苷稳定性受理化因素的影响较大,容易通过不同途径降解为无色或者棕褐色的可溶或不溶性产物[24]。低温条件下,红毛丹果皮花色素苷较为稳定,随着温度的上升和放置时间的延长,花色素苷迅速降解,这与温度对荔枝果皮[4]、黑果腺肋花楸果[25]花色素苷的影响情况均相似,保存温度过高时,花色素苷会发生水解或去糖基开环反应,从而形成无色查耳酮或其同分异构体α-二酮,然后继续降解为酚酸和醛类物[26]。避光条件可以有效抑制红毛丹果皮花色素苷的降解,这可能因为花色素苷的降解受光照的影响,基态的花色素苷吸收光能后,转变为激发态,激发态花色素苷的C4位发生水解,生成中间产物C4加合物,随后该C4 加合物的C2 位水解开环形成另一中间产物,生成查尔酮,该中间产物继续降解生成酚酸和醛类[27]。添加柠檬酸及酸性条件均能维持红毛丹果皮花色素苷的稳定性,这是因为随着pH 值的升高,花色素苷的结构发生变化,无色的甲醇假碱其比例逐渐增大[28]。花色素苷本身是抗氧化物质的,具有较强的清除自由基能力。研究中发现,氧化剂H2O2会使红毛丹果皮花色素苷的稳定性显著下降,这可能与H2O2为强氧化剂有关,其可直接亲核攻击花色苷的C2位,使其开环,引起花色素苷的降解[29-30];此外,还原剂Na2SO3对红毛丹果皮花色素苷的破坏性较大,说明红毛丹果皮花色素苷对还原剂的耐受力极差。
4 结 论
红毛丹果皮中花色素苷的组成成分非常丰富且种类多,其主要苷元为矢车菊素与飞燕草素,连接的糖主要有葡萄糖和芸香糖;其紫外最大吸收波长为535 nm;低温更利于其保存;避光保存可抑制其降解;添加5%的柠檬酸可以维持其稳定性;保存于酸性条件下其稳定性好;其对氧化剂和还原剂的耐受性均差。该结果能为防止或减轻红毛丹果皮褐变提供理论参考依据。

