产后抑郁症病因 临床治疗及动物模型研究进展
张 彦 刘孟华 石碧锐 张 丽
产后抑郁症(postpartum depression,PPD)是指产妇分娩后出现的一系列精神异常与行为障碍,其病因较为复杂。与其他生理阶段相比,产后的女性不论是激素、神经递质还是代谢水平都和其他时期不同,这就使PPD病因呈现出复杂性,与单纯的抑郁症有明显区别[1]。目前,药物与心理治疗是PPD主要的治疗手段。鉴于产妇身心情况特殊,PPD在人体上的研究很难顺利开展,存在着许多局限性,所以PPD发病相关机制的阐明和药物研发都十分依赖于模型的成功构建。常用PPD模型包括激素诱导模型、应激模型和转基因动物模型,不同PPD模型优缺兼具,如何选用合适的模型为PPD临床治疗和病因阐明提供基础值得研究者深入探讨。本文针对PPD研究现状,综述了PPD病因、临床治疗、常用的动物模型及其评价方法,为进一步研究PPD提供参考。
1 PPD的病因
1.1 性腺类固醇激素分泌失调 持续给予啮齿类动物高水平的妊娠相关激素(雌二醇和孕酮)并突然停撤,会在啮齿类动物中产生“类似抑郁”的症状[2],提示性腺类固醇可能参与PPD的发生。一些转位蛋白如18 kDa转位蛋白(18kDa translocator protein,TSPO)主要位于神经系统类固醇合成细胞的线粒体外膜上,其主要功能之一是将胆固醇转运到线粒体中,这是类固醇合成的先决过程[3]。Li等[4]用TSPO配体治疗PPD大鼠,发现其能提高TSPO水平并减轻大鼠产后的抑郁样行为;此外,在对入院产妇进行研究中发现,PPD的发生可能与血清雌二醇、孕酮水平的急剧降低相关,并且雌二醇、孕酮水平变化越大,产妇越容易患抑郁症。激素水平迅速下降一方面会直接导致脑内儿茶酚胺的作用能力下降,另一方面可引起脑组织中神经递质水平发生变化,从而引发相应的抑郁情绪和行为改变[5]。这些结果均提示:PPD的发生可能是由产前妊娠相关激素维持在高水平状态而产后迅速下降导致的。
1.2 下丘脑-垂体-肾上腺轴调节失调 抑郁症通常与皮质醇(corticosterone, CORT)增多和下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis, HPAA)功能异常有关[6],HPAA能释放皮质醇相关激素,以应对压力,控制应激反应。给予啮齿动物高剂量皮质醇对调节母性行为十分重要,比如产后服用高剂量皮质醇会增加母鼠的抑郁样行为,且无论是在孕期还是产后使用高剂量的皮质醇都能改变母鼠对仔鼠的护理行为,如减少了筑巢时间和哺乳时间[7]。
1.3 炎症反应 免疫系统、细胞因子也参与了PPD的发生和发展[4,8]。在产后,与严重抑郁障碍有关的大脑区域其细胞因子的水平会发生显著变化,如大鼠脑内侧前额叶皮质区白细胞介素(interleukin-1β, IL-1β)水平显著降低,而IL-6和IL-4水平显著升高[8],这与是否有额外的应激源无关。NOD样受体蛋白3(NOD-like receptor protein 3, NLRP3)炎性体的缺乏可改善小鼠抑郁样行为,并且Caspase-1和NLRP3 mRNA水平在抑郁症患者血细胞中增加[9],提示PPD也可能与炎症反应相关。
1.4 脑电生理变化 PPD妇女在静息状态下(即在没有任何特定外部刺激的情况下)发生的大脑活动经常出现偏侧化[10],如与健康产后妇女相比,PPD患者左侧额叶在静息状态下活动较少,而右侧的活动较多。通过磁共振功能成像显示PPD患者多个脑区图像中峰值t较低,说明在静息状态下PPD患者各个脑区之间的连通性降低,其中包括皮质和皮质边缘,杏仁核(amygdala,AMG)、前扣带回皮质(anterior cingulate cortex, ACC)、前额叶背外侧皮质(Dorsolateral Prefrontal Cortex, DLPFC)和海马之间的连接明显减弱。海马体容易受到压力的影响,并在抑郁症中发挥重要作用;抑郁症患者可能表现为海马体积减小[11]。在成人中,慢性应激和高水平的皮质酮都抑制海马神经发生,提示在神经发生、皮质酮和抑郁症之间存在联系[12]。
1.5 遗传因素 目前,关于PPD的发病倾向于多基因遗传模式。与正常人相比,PPD患者有雌激素受体α基因、单胺氧化酶A等多个基因表达具有差异[13-14]。陈丽华等[15]发现脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)基因和儿茶酚-O-甲基转移酶(catechol-Omethyl transferase, COMT)基因的某些位点发生突变与高领产妇PPD存在明显的相关性。
1.6 其他因素 妊娠时期各方面的应激压力也被证明可以诱导母亲产后出现抑郁样行为、改变母亲的护理行为,并对幼崽产生有害的影响[16-18]。慢性压力应激主要包括婚姻问题、社会经济地位低、缺乏社会支持、婆媳关系不佳、对产后母亲照顾减少、生活环境差等一系列负性生活事件及家庭社会方面的因素[19],均与PPD发生相关[14,20]。另外,分娩方式比如剖宫产会增加PPD的发生率[21]。
2 PPD的治疗
2.1 心理治疗 由于药物有从乳汁进入婴儿体内的风险,并且哺乳期女性一般不会轻易选择给孩子断奶,所以对于轻至中度的PPD,可优先选择心理治疗,无需转诊到精神科即可处理。心理治疗主要包括支持性心理治疗、认知行为治疗、家庭治疗等[14],其中认知行为疗法最为常用。认知行为治疗的重点是改变患者不健康的思维习惯、思维观念或是思维推理方式并落实到行为上,逐步调整。何雪雪等[22]研究表明,采用多种心理干预手段,如音乐治疗、认知行为治疗、团体心理治疗及心理健康教育可以有效减轻孕产妇的焦虑、抑郁情绪。如果经心理治疗后症状无改善或治疗应答效果不佳,更严重者出现伤害自己或他人的观念、躁狂及精神病性症状时,则需转诊至精神科并使用药物治疗。
2.2 药物治疗 由于药物很可能通过哺乳期妇女的乳汁传递给婴儿,用药前需对药物的潜在风险和好处进行严格的评估。目前,针对PPD治疗药物主要包括选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor, SSRIs)、去甲肾上腺素再摄取抑制剂、三环类抗抑郁药、雌激素等[14]。SSRIs为治疗此类患者的一线药物,代表药物有氟西汀、帕罗西汀、舍曲林等,对于使用母乳喂养的健康足月儿而言,此类药物一般可与母乳兼容。针对新发的PPD患者,通常推荐使用舍曲林为一线治疗药物。舍曲林是强效、选择性的神经元5-羟色胺再摄取抑制剂,其服用后进入乳汁的量较少。考虑到产后生理的变化对药物消除速率的影响,专家建议从低剂量开始,慢慢增加剂量,并仔细监测新生儿的不良反应,靶剂量应该是最低有效剂量[23],待到疗效满意后,继续服用舍曲林还可有效地防止疾病的复发和再发。对药物的选择需要考虑个体化差异,比如对于复杂或耐药的病例,可能需要使用苯二氮类药物、抗精神病药物和情绪稳定剂进行增强治疗[24]。
对于心理治疗及药物治疗都无效的重度PPD,建议进行长期住院治疗。由于重度PPD患者容易出现自杀甚至杀婴现象,所以需要在医院进行系统性的积极治疗,可联合药物、心理及物理康复治疗,并及时调整生活及饮食状态。物理治疗包括经颅磁刺激技术(transcranial magnetic stimulation,TMS)、电休克治疗(electroconvulsive therapy, ECT)等。
2.3 其他治疗 研究[24-25]表明,富含Ω-3的人工鱼油可改善PPD大鼠的抑郁样行为,并显著降低体内皮质酮及促炎细胞因子含量。产时、产后护理,如生产时由丈夫及助产士陪伴、产后让家庭成员理解关心产妇等也可改善产后抑郁症状[26]。
3 PPD的主要动物模型及评价指标
3.1 激素诱导模型
3.1.1 激素模拟妊娠(hormone-simulated pseudopregnancy, HSP)后激素停撤模型 该模型的方法是对母鼠进行去卵巢手术,术后每天注射不同比例生殖激素(低剂量的苯甲酸雌二醇2.5 μg和高剂量的黄体酮4 mg)连续16 d,从第17天到第23天,雌二醇的剂量增加到50 μg,并于术后第24天(生产第1天)突然停撤注射[20,27]。其优点是母鼠体内的雌性激素在一个相对可控的水平里,重复性好,个体差异较小;缺点是不能很好地模仿临床上社会关系导致的PPD症状,操作难度相比于社会应激模型更高。另外,停用雌二醇可使大鼠出现快感减退,而对人类无影响,所以复杂的生殖激素环境不能仅靠停用雌二醇来模拟[28]。
3.1.2 持续给予高水平的皮质醇模型 该模型是由Brummelte等[7,12,29]发展起来。高水平皮质醇的长期治疗对产妇保健、海马细胞增殖和抑郁样行为有负面影响,可作为PPD的有效动物模型。建立该模型一般是在母鼠分娩后2~24 d,每天皮下注射CORT[27],或者自受孕第1天起,每天皮下注射1 mL/(kg·d)的生理盐水,受孕第15天起,皮下注射0.2 mg/(kg·d)的地塞米松磷酸钠,直到22或23天后产崽[30]。其优势是能更好地控制母鼠体内的激素水平,减少个体差异性。
3.2 应激模型
3.2.1 慢性社会应激(chronic social stress,CSS)模型 Carini等[31]利用雄性入侵者作为应激源来观察其对哺乳期大鼠的影响,建立慢性社会应激的PPD模型。此模型也可结合其他压力应激如适当禁食和水、改变生存环境(潮湿垫料、明暗交替)、电击或束缚等刺激来诱导建立PPD模型[32]。有些研究者可能会采用与CSS相似的慢性不可预知的轻度应激模型(chronic unpredictable mild stress,CUMS)或者是慢性不可预测应激模型(chronic unpredictable stress,CUS),CUMS和CUS的应激源与CSS类似,包括明暗交替、鼠笼倾斜、饮食剥夺、通宵照明、生存空间缩小等[33],小鼠被暴露于各种随机安排的、低强度的社会和环境应激源中,每天2~3次,持续4~8周[9,11]。其强调所有的应激源都是单独和连续施加的,贯穿整个白天和夜晚,并且为了防止习惯性和确保应激源的不可预测性,所有应激源被随机安排在1周的时间内,并在整个实验期间重复[34]。单纯的妊娠应激模型、CUMS模型、CUS模型与CSS模型的不同之处在于CSS主要是利用引入雄性入侵者来模仿社会应激并结合其他刺激作为辅助,这种模型的优势是引入社会影响因素,能较真实地模拟PPD患者的某些病因。
3.2.2 习得性无助(learned helplessness,LH)模型 LH模型是经多次给予实验动物难以忍受的不可逃避的刺激(如电击),即便在可逃避的环境中,也呈现出逃避行为缺失。LH行为和抑郁症有非常类似的表现,而且多种抗抑郁药也被证明可改善实验动物LH的行为[35]。Kurata等[36]在研究LH模型产后抑郁状态对子代的影响中发现,LH大鼠在哺乳期对幼崽的关爱行为减少,抑郁样行为增加,这说明了LH模型在PPD动物模型中的可用性。此模型与人类长期受到轻中度应激(外来刺激伤害事件)患抑郁症的疾病发展历程相似,也能很好地模仿PPD患者的病因。
3.2.3 母子分离模型(maternal separation models,MS) 母婴分离模型被广泛应用于对母鼠和仔鼠的研究,每次母婴分离的时间长短和持续天数的不同都对母鼠和雌性/雄性仔鼠有不同程度的影响[37-39]。具体操作一般是在仔鼠出生后的2~14 d或2~21 d,每天将仔鼠与母鼠分离3~6 h不等。该模型的优点是能较真实地模拟社会压力应激而导致的社会关系破裂,且该模型也多用于研究早期应激对后代的影响。
3.3 转基因抑郁动物模型 目前,转基因抑郁大鼠有Wistar Kyoto(WKY)大鼠、Flinders Sensitive line(FSL)大鼠等[40-42]。FSL模型是通过选择性饲养对胆碱能激动剂敏感的SD大鼠而建立的,其在与抑郁症相关的中枢神经化学物质和外周激素系统方面不同于普通大鼠;WKY大鼠则表现出对压力的敏感性,同时表现出非源于压力的特征性抑郁样行为,并且在神经化学系统和外周激素方面不同于普通大鼠[41]。转基因抑郁动物模型的优点是模型稳定、个体差异小、重现性较高。
3.4 评价指标
3.4.1 行为学指标评价 由于临床上确诊产后抑郁主要是通过产后妇女自身的心理情感描述和异常行为的表达以及产后抑郁筛查量表来评定,所以评判产后抑郁模型是否建立成功,动物的行为学评价是极其重要的一个指标。行为学指标主要包括糖水偏爱实验、旷场实验、强迫游泳实验、悬尾实验等(表1)。需要注意的是,不论是人类还是实验动物,其在抑郁样行为上的表达都是有高度异质性的,患者表现出不同的抑郁情绪或快感缺乏症状,但不一定所有症状都有[43]。
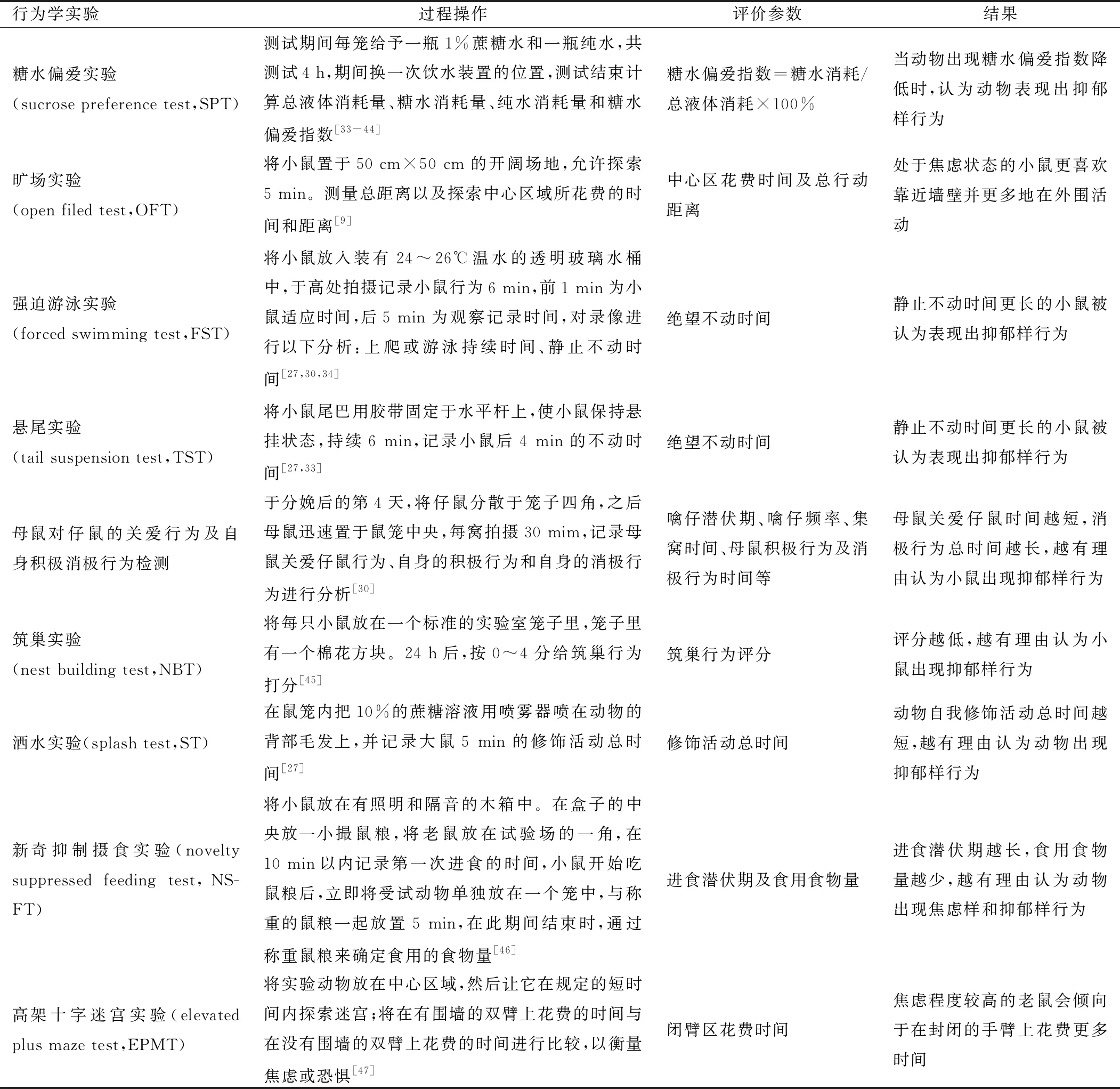
表1 PPD动物模型行为学评价方法
3.4.2 生理学指标评价 目前,关于PPD的生理学指标研究较少,主要有4类:①与HPA轴相关激素,包括促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH)、促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)和CORT;②雌性激素,如雌二醇和孕酮;③中枢单胺神经递质,如五羟色胺、去甲肾上腺素、多巴胺和体内脑源性神经营养因子;④一些与炎症反应相关的细胞因子,如IL-1β、IL-6及肿瘤坏死因子-α等,对具有特异性的生理学指标尚需进一步研究。
4 小结与展望
PPD发病率高,不管是对母亲还是胎儿都有诸多不良的影响。然而,人类对于其病因和相关生物学机制知之甚少。该疾病的研究也主要取决于动物模型,因此成功的模型构建是研究该疾病的前提。但目前各种动物模型发生的病理、生理机制各异,且实验动物存在个体差异,很难保证不出现假阳性的结果,且每种模型可能只能表现出抑郁症的某一方面症状,存在局限性[27,33],所以将多种模型结合来提高实验结果的可信性值得考虑。对于行为学评价指标,每种试验也只能评判出某一方面行为特征,也存在着较大的局限性,故目前倾向于用多种测试来分析最终结果,但要考虑测试相互之间的影响。如何合理的结合多种模型和行为学评价指标是目前研究的难点,并且由于实验动物品系、时间、实验环境等各种因素不同,实验结果差异也很大,特别是对于某些造模方法和行为学测试需要建立一套完整的标准操作程序。
随着临床对新型的抗产后抑郁药物需求的不断增加,动物模型构建和行为评价指标的不断改进对PPD的病因和机制研究具有重要意义,也将为新型PPD药物的开发和研究提供较大的帮助。

