猪嵴病毒结构蛋白VP0与VP1原核表达及间接ELISA方法的建立
沈俊强 张莉萍 于瑞明 王永录 潘丽 刘霞 刘新生
(1.甘肃农业大学生命科学技术学院,兰州 730070;2.中国农业科学院兰州兽医研究所,兰州 730064)
猪嵴病毒(porcine kobuvirus,PKV)自2007年在匈牙利首次分离出经典毒株S-1-HUN后[1],相继在中国[2]、日本[3]、韩国[4]、美国[5]等国家猪粪便样品中检测出该病毒,使得PKV逐渐在国内外受到广泛关注。2013年国际病毒分类委员会的病毒分类报告中对Kobu病毒属中的病毒进行重命名,将PKV、人爱知病毒(Aichi virus,AiV)与牛嵴病毒(bovine kobuvirus,BKV)正式确定为Kobu病毒属中的3成员[6]。研究发现PKV基因组结构与嵴病毒属其余两个病毒同源性较高,AiV已被证实与人类腹泻疾病相关,PKV作为与AiV同属的病毒,也可能是猪腹泻疾病的诱因。近年来有研究报道无论猪是否感染PKV,其血清样品中都可检出PKV,且在具有猪腹泻症状的猪场中PKV阳性率明显高于无症状猪群,表明PKV感染可能是引起猪腹泻的的重要因素之一[7-10]。近年来国内PKV流行越来越广泛,阳性率不断升高[11-12],但目前国内外尚未报道适合分离培养PKV的细胞系,无法深入研究PKV的致病机理,不能确切证实PKV感染与仔猪腹泻之间的关系。因此,在现阶段建立有效的PKV检测方法以确证其感染,同时结合相关流行病学和病理学研究,对于研究该病的致病机制十分重要。
PKV为小RNA病毒科的无囊膜单股正链RNA病毒,在电镜下呈凹凸不平的球型,病毒粒子直径约为20-30 nm,结构为二十面体[13-16]。该病毒基因组全长约为8.5 kb,由5′端非编码区、开放阅读框和3′端非编码区组成,5′端非编码区长度一般在576-808 nt左右,末端与VPg蛋白连接,二级结构可能与PKV病毒基因的复制相关[17],3′端非编码区长度由167-237 nt组成,后面连接PolyA尾序列,其功能与结构尚未有研究报道。开放阅读框由无剪切活性的前导蛋白L、结构蛋白P1、非结构蛋白P2和P3基因序列组成,编码的多聚蛋白在自身蛋白酶的作用下被剪切为结构蛋白VP0、VP3和 VP1,非结构蛋白2A,2B,2C,3A,3B,3C 和 3D,前导蛋白L无剪切活性,不参与多聚蛋白的剪切,研究表明可能与病毒RNA的复制与衣壳化有关[18-19]。结构蛋白VP0具有良好的反应原性,且突变率相对较低,VP1蛋白作为衣壳蛋白暴露在病毒粒子的表面,含有大量的抗原表位且免疫原性最强,是PKV的优势免疫蛋白,也是参与中和作用的主要蛋白[15,20-22]。相比于 VP0来说,利用 VP1建立的ELISA方法敏感性可能更好,可能更适合作为间接ELISA的检测抗原。因此,我们选择VP0与VP1蛋白作为包被抗原分别建立间接ELISA检测方法并比较分析两种方法的特异性和敏感性。
目前检测PKV方法主要包括血清学检测、PCR技术和实时荧光定量PCR技术等[23-24]。血清学检测为PKV最常用的诊断方法,其中ELISA检测方法与其他血清学方法相比,具有可重复、易自动化和标准化的特点,还可用于定性和定量检测。近年来有研究成功利用HB-BD、CH441、XD株建立PKV结构蛋白的间接ELISA检测方法[25-28],但多数基于较易发生突变的VP1蛋白和免疫原性相对较差的VP3蛋白,这些ELISA方法的敏感性不稳定。本研究首次以甘肃地区毒株AH6基因组序列为参考序列优化密码子后合成了稳定性较好的VP0和抗原性较好的VP1结构蛋白基因,构建表达VP0与VP1蛋白的重组质粒pET-32a-VP0和重组质粒pET-32a-VP1,纯化重组蛋白pET-32a-VP0和重组蛋白pET-32a-VP1并检测其反应原性,将其作为包被抗原,建立间接ELISA 检测方法,并对两种间接ELISA方法进行比较,探讨更适合作为包被抗原的重组蛋白,为进一步建立PKV快速诊断技术及检测试剂盒的开发提供重要参考。
1 材料与方法
1.1 材料
1.1.1 材料 猪嵴病毒参考毒株AH6由中国农业科学院兰州兽医研究所口蹄疫防控技术团队基因工程实验室提供并保存、猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪德尔塔冠状病毒(porcine deltacorona virus,PDCoV)、猪轮状病毒(porcine rotavirus,PRoV)、猪传染性肠胃炎病毒(transmissible gastroenteritis of swine virus,TGEV)、猪瘟病毒(swine fever virus,CSFV)、伪狂犬(pseudorabies virus,PRV)的阳性血清和猪嵴病毒的阴性与阳性血清,原核表达载体pET-32a、大肠杆菌DH5α、感受态细胞BL21均由本实验室保存;优化密码子的VP0与VP1全长基因序列(附件1)由武汉金开瑞生物科技有限公司合成。
1.1.2 主要试剂 琼脂糖购自北京索莱宝技术有限公司,DNA Mark、T4 DNA连接酶购自宝生物工程(大连)有限公司,限制性内切酶BamHⅠ与XhoⅠ购自美国Cell Biolabs公司,质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒购自Omega Bio-Tek公司,三色预染蛋白Mark购自上海雅酶生物医药科技有限公司,山羊抗猪IgG/HRP 购自Invitrogen公司,蛋白浓度测定Bardford试剂购自赛默飞世尔公司。
1.2 方法
1.2.1 重组表达质粒的构建 根据PKV AH6毒株结构蛋白VP0与VP1基因序列对其密码子优化后,由武汉金开瑞生物技术有限公司合成目的基因。对重组质粒和pET-32a表达载体进行双酶切。再经连接得到重组质粒pET-32a-VP0和pET-32a-VP1,转化至感受态细胞BL21,涂布于含氨苄青霉素(Amp 100 mg/mL)的LB固体琼脂培养基上,37℃恒温培养12-16 h。挑取长势均匀的单菌落,接种于5 mL含Amp(100 mg/mL)的LB液体培养基中,37℃、220 r/min培养12-16 h。使用质粒小提试剂盒进行质粒提取,由北京擎科生物科技有限公司测序。
1.2.2 重组蛋白的诱导表达与鉴定 将测序正确的重组质粒pET-32a-VP0和pET-32a-VP1再次摇菌培养,提取质粒,双酶切鉴定正确后,原菌液按1∶100的浓度加入LB液体培养基(含100 mg/mL Amp)中,37℃、220 r/min培养,待菌液OD600值在0.6-0.8时优化诱导条件诱导重组蛋白表达,表达的重组蛋白分别命名为重组蛋白pET-32a-VP0与重组蛋白pET-32a-VP1。诱导后的菌液离心收集沉淀,加入PBS进行超声破碎后,进行SDS-PAGE电泳,考马斯亮蓝染色法染色40 min,脱色后观察分析。
1.2.3 重组蛋白的可溶性分析和Western blotting鉴定 利用优化后的诱导条件分别诱导1.5 L已表达重组蛋白pET-32a-VP0与pET-32a-VP1的菌液,收集菌体,进行可溶性分析,在Ni柱中用不同浓度的尿素纯化重组蛋白并进行复性处理,测定浓度,纯化的蛋白质经Western blotting进行分析,His标签一抗(1∶5 000)室温孵育2 h,山羊抗鼠IgG/HRP二抗(1∶10 000)室温孵育1 h,洗膜后曝光观察分析。
1.2.4 重组蛋白pET-32a-VP0与pET-32a-VP1间接ELISA方法的建立
1.2.4.1 最佳抗原包被浓度和血清稀释度的确定 采用棋盘法将纯化后的重组蛋白用碳酸盐缓冲液(pH 9.6)稀释为 5 μg/mL、2.5 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL 和 0.1 μg/mL,酶标板纵向梯度每孔加100 μL,每个样品设置两个重复,37℃包被2 h,PBST洗涤3次;封闭液选择5%脱脂乳,每孔加150 μL,37℃封闭2 h,PBST洗涤3次;用血清稀释液将阴阳性血清分别稀释至1∶100、1∶200、1∶250、1∶300、1∶400、1∶500, 酶 标板横向梯度每孔加100 μL,37℃孵育1 h,PBST洗涤3次;将山羊抗猪IgG/HRP按1∶20 000稀释,每孔加100 μL,37℃孵育1 h,PBST洗涤3次;每孔加50 μL TMB底物溶液室温避光15 min,每孔加50 mL H2SO4(2 mol/L)终止反应,计算OD450处P/N值;挑选阳性值2.0-2.5,P/N值接近于10的为最佳抗原包被浓度与血清稀释度。
1.2.4.2 反应条件的优化 进一步采用棋盘法确定封闭液最佳反应条件、血清最佳孵育条件、山羊抗猪IgG/HRP(二抗)最佳孵育条件和TMB底物最佳反应条件,以1%BSA、3%BSA、5%脱脂乳作为封闭液,每种封闭液封闭时间选择1 h、2 h、3 h,每个梯度设置2个重复确定最佳封闭条件;利用优化后的抗原最佳包被浓度,包被时间选择1 h、2 h和3 h,每个梯度设置2个重复确定抗原最佳包被条件;利用优化后的阴性血清与阳性血清最佳稀释度,孵育时间选择30 min、60 min、90 min,每个梯度设置2个重复确定血清最佳反应时间,山羊抗猪IgG/HRP(二抗)稀释倍数选择 1∶5 000、1∶10 000、1∶20 000、1∶40 000,二抗孵育时间选择30 min、60 min、90 min,每个梯度设置2个重复确定二抗最佳反应条件,TMB底物溶液反应时间选择5 min、10 min、15 min,每个梯度设置2个重复确定最佳反应时间。
1.2.4.3 血清阴阳临界值的判定 利用重组蛋白pET-32a-VP0与pET-32a-VP1为抗原采用Western blotting方法筛选出20份PKV阴性血清,利用建立的间接ELISA方法检测筛选出的20份PKV阴性血清,测得OD450值,计算20份PKV阴性血清平均值(x-)和标准差(s)。根据统计学分析,血清阴阳临界值=x-+ 3s,确定间接ELISA检测方法的临界值。
1.2.4.4 重复性实验 将重组蛋白pET-32a-VP0与pET-32a-VP1分3批包被,选取3份PKV阴性血清与阳性血清样品,每份血清设置3个重复,利用建立好的间接ELISA方法检测,测得OD450值,进行统计学分析,计算批内和批间变异系数CV=s/x-×100%确定其重复性。
1.2.4.5 特异性实验 采用建立的间接ELISA检测方法同时检测已知PKV、猪流行性腹泻(PEDV)、猪德尔塔冠状病毒(PDCoV)、猪轮状病毒(PRoV)、猪传染性肠胃炎病毒(TGEV)、猪瘟病毒(CSFV)、伪狂犬(PRV)阳性血清,每个血清设置3个重复,测得OD450值,以确定的临界值为对照,统计分析其特异性。
1.2.4.6 敏感性实验 采用建立的间接ELISA方法检测已知PKV阳性血清,利用血清稀释液2倍倍比稀释(1∶100-1∶12 600),每个梯度设置3个重复,以确定的临界值为对照,判断该方法可检出PKV阳性血清最小稀释比例,统计分析其敏感性。
1.2.4.7 临床样本检测与符合率实验 采用建立的间接ELISA检测方法对46份采集自甘肃地区的血清样本检测,并以重组蛋白为抗原,46份血清为一抗,利用Western blotting试验验证其阴阳性。通过对比两种方法测得的结果计算建立的间接ELISA检测方法的符合率大小。
1.2.5 数据统计 数据处理及统计分析采用Microsoft Excel 2019软件整理数据,应用SPSS19.0软件计算OD450的平均值、标准差、变异系数等。
2 结果
2.1 重组质粒的酶切鉴定
构建的重组质粒pET-32a-VP0与pET-32a-VP1分别经BamHⅠ和XhoⅠ限制性内切酶内切,1%琼脂糖凝胶电泳结果显示重组质粒pET-32a-VP0酶切后得到大小为1 110 bp的特异性条带(图1-A);pET-32a-VP1重组质粒酶切后得到大小为777 bp的特异性条带(图1-B)。
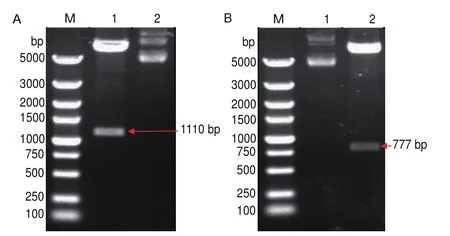
图1 重组质粒pET-32a-VP0与pET-32a-VP1双酶切鉴定Fig.1 Double digestion identification of recombinant plasmid pET-32a-VP0 and pET-32a-VP1
2.2 重组蛋白的表达及鉴定
构建成功的重组质粒pET-32a-VP0与pET-32a-VP1转入大肠杆菌感受态细胞BL21中,挑选阳性克隆在LB液体培养基中培养诱导重组蛋白表达,诱导后SDS-PAGE电泳,考马斯亮蓝染色,结果显示重组蛋白pET-32a-VP0在24℃时诱导12 h后在58 kD出表达带有His标签的蛋白(图2-A);重组蛋白pET-32a-VP1在37℃时诱导6 h后在45 kD处表达带有His标签的蛋白(图2-B)。
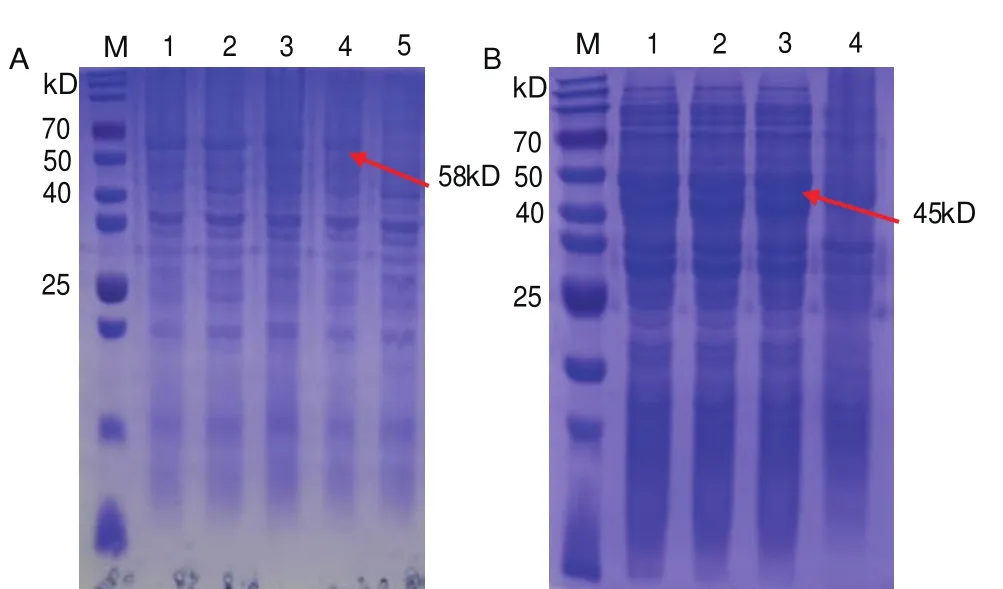
图2 重组蛋白pET-32a-VP0与pET-32a-VP1诱导表达Fig.2 Induced expression of recombinant protein pET-32a-VP0 and pET-32a-VP1
2.3 重组蛋白的可溶性分析及Western blotting鉴定
大量诱导重组蛋白pET-32a-VP0与pET-32a-VP1菌液并进行可溶性分析,结果显示重组蛋白pET-32a-VP0在包涵体中表达(图3-A),重组蛋白pET-32a-VP1在上清中表达(图4-A)。在Ni柱中用不同浓度尿素纯化,以纯化复性的重组蛋白pET-32a-VP0与pET-32a-VP1作为抗原进行Western Blotting检测,结果显示重组蛋白pET-32a-VP0在58 kD处检测到重组蛋白(图3-B);重组蛋白pET-32a-VP1在45 kD处检测到重组蛋白(图4-B)。
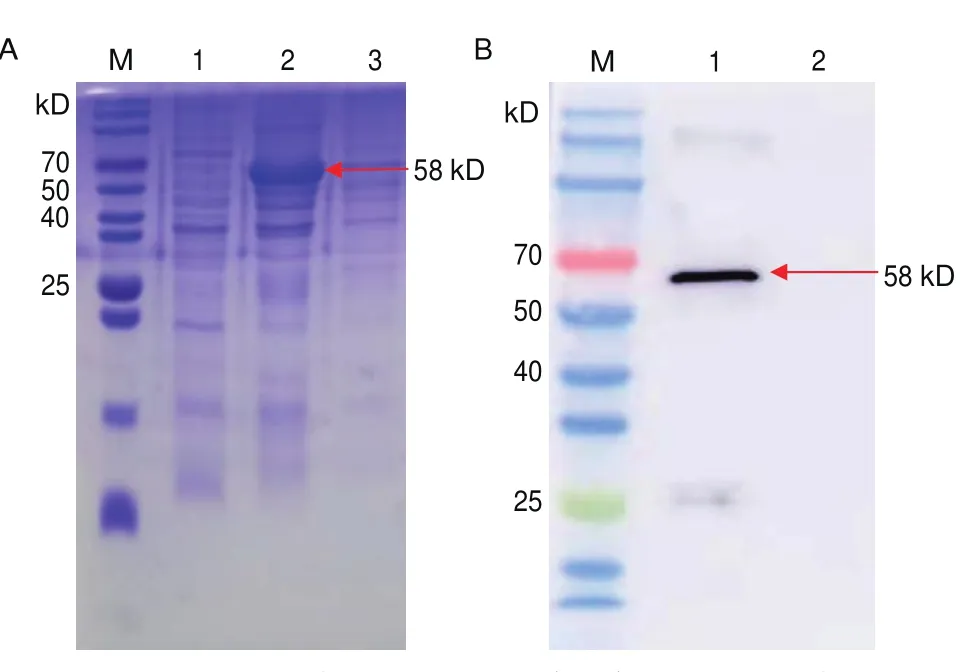
图3 重组蛋白pET-32a-VP0可溶性分析及Western blotting验证Fig.3 Solubility analysis and Western blotting validation of recombinant protein pET-32a-VP0
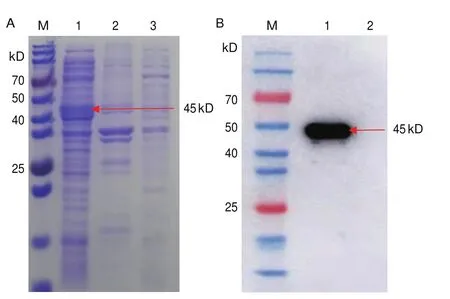
图4 重组蛋白pET-32a-VP1可溶性分析及Western blotting验证Fig.4 Solubility analysis and Western blotting validation of recombinant protein pET-32a-VP1
2.4 重组蛋白pET-32a-VP0与pET-32a-VP1间接ELISA方法的建立
2.4.1 最佳抗原包被浓度和血清稀释度的确定 采用棋盘法确定重组蛋白pET-32a-VP0与pET-32a-VP1最佳抗原包被浓度和血清稀释度。重组蛋白浓度设置7个梯度,阴性血清与阳性血清稀释度设置6个梯度,每个血清设置两个重复进行检测,读取OD450值。结果显示重组蛋白pET-32a-VP0最佳抗原包被浓度为2 mg/mL,最佳血清稀释度为1∶200(表1);重组蛋白pET-32a-VP1最佳抗原包被浓度为2.5 mg/mL,最佳血清稀释度为1∶200(表2)。
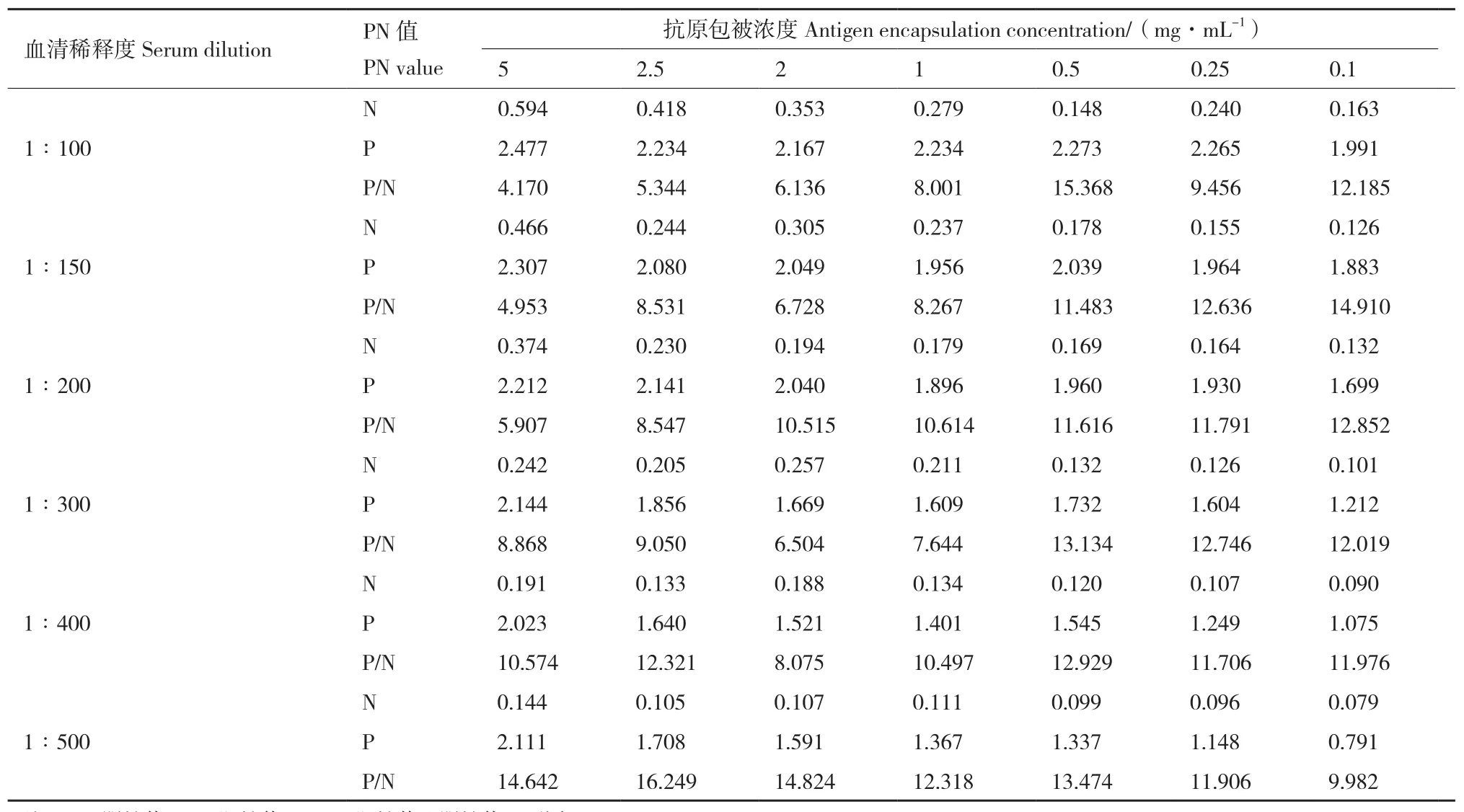
表1 棋盘法测定重组蛋白pET-32a-VP0抗原最佳包被浓度与血清稀释度Table 1 Optimal encapsulation concentration of recombinant protein pET-32a-VP0 antigen with serum dilution determined by checkerboard method
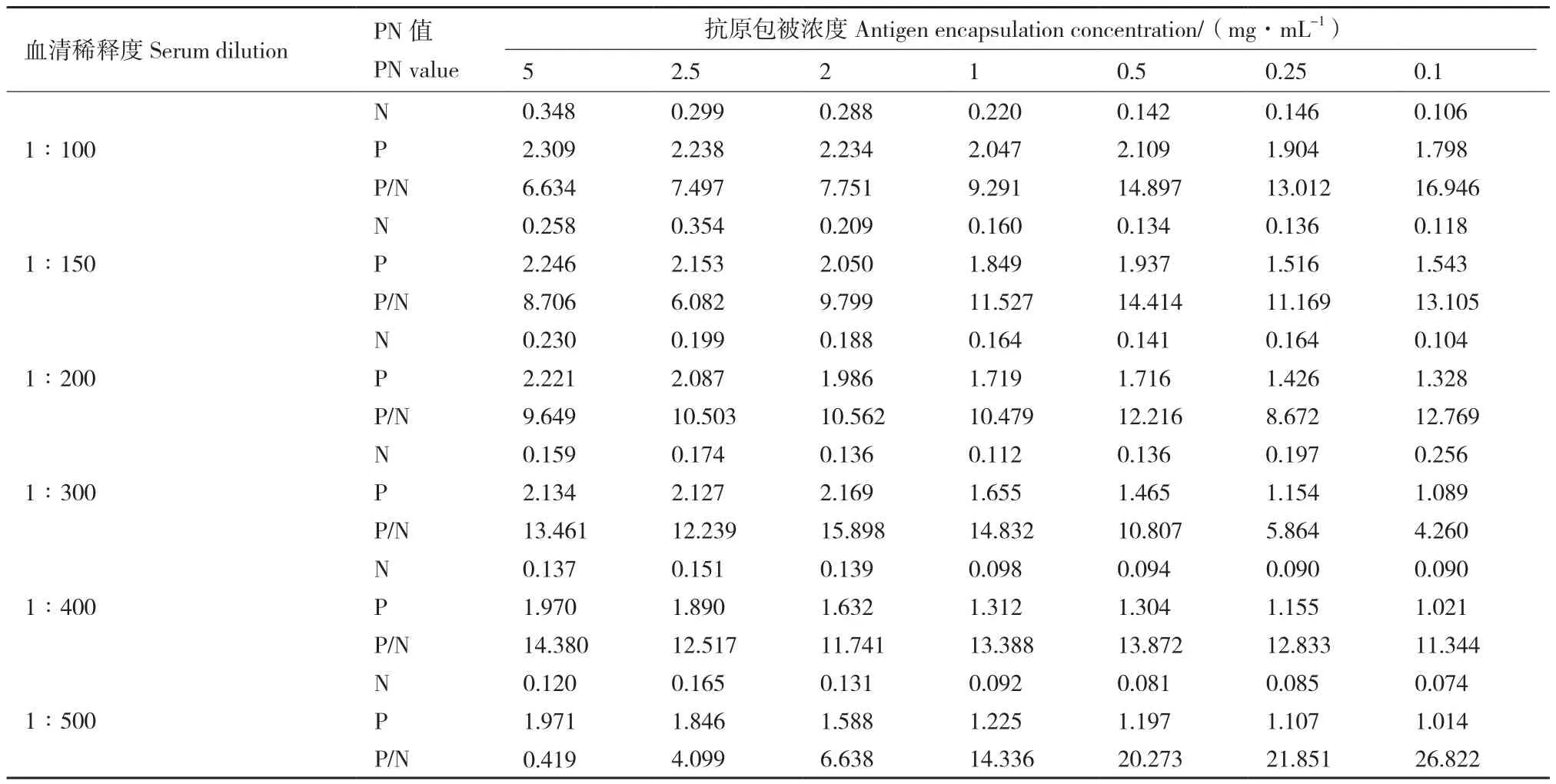
表2 棋盘法测定重组蛋白pET-32a-VP1抗原最佳包被浓度与血清稀释度Table 2 Optimal encapsulation concentration of recombinant protein pET-32a-VP1 antigen with serum dilution determined by checkerboard method
2.4.2 反应条件的优化 采用棋盘法确定封闭液最佳反应条件、抗原最佳包被条件、PKV血清最佳孵育条件、二抗最佳孵育条件和TMB底物最佳反应条件实验结果显示重组蛋白pET-32a-VP0与pET-32a-VP1最佳封闭液均为5%脱脂乳,最佳封闭条件均为37℃、2 h;抗原最佳包被条件均为37℃、1 h;PKV血清最佳孵育条件均为37℃、1 h;最佳二抗孵育浓度分别为1:20 000,1:15 000,孵育条件均为37℃、1 h;TMB底物最佳显色时间为10 min(表3)。

表3 反应条件优化结果Table 3 Optimization results of reaction conditions
2.4.3 血清阴阳临界值的判定 根据已经建立的间接ELISA检测方法检测20份PKV阴性血清的OD450值,结果显示重组蛋白pET-32a-VP0平均值(x-)为0.198,方差(s)为0.036,根据SPSS19.0软件统计学分析,血清阴阳临界值=x-+ 3s,可知当样品OD450≥0.306时为阳性;OD450<0.306为阴性;重组蛋白pET-32a-VP1平均值(x-)为0.184,方差(s)为0.031,可知当样品OD450≥0.277时为阳性;OD450<0.277 为阴性。
2.4.4 重复性实验 利用建立好的间接ELISA方法检测对阴阳性血清各3份进行批内、批间重复试验,利用SPSS19.0软件统计学分析,计算批内和批间变异系数CV=s/x-×100%。结果显示重组蛋白pET-32a-VP0批内变异系数为2.6%-5.9%之间,批间变异系数为2.9%-7.0%之间(表4);重组蛋白pET-32a-VP1批内变异系数为3.1%-7.2%之间,批间变异系数为3.4%-8.2%之间(表5);均小于10%。
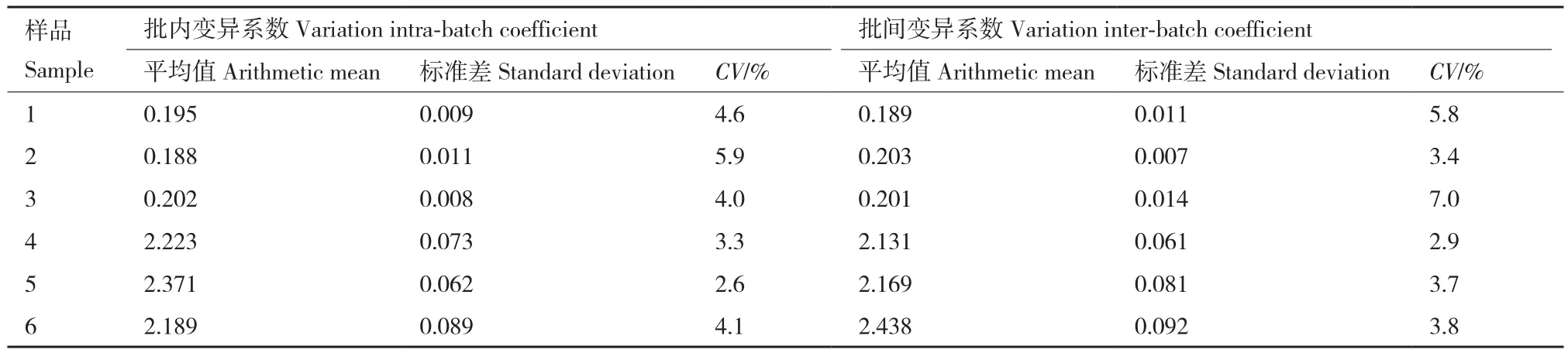
表4 重组蛋白pET-32a-VP0重复性实验Table 4 Reproducibility experiments of recombinant protein pET-32a-VP0
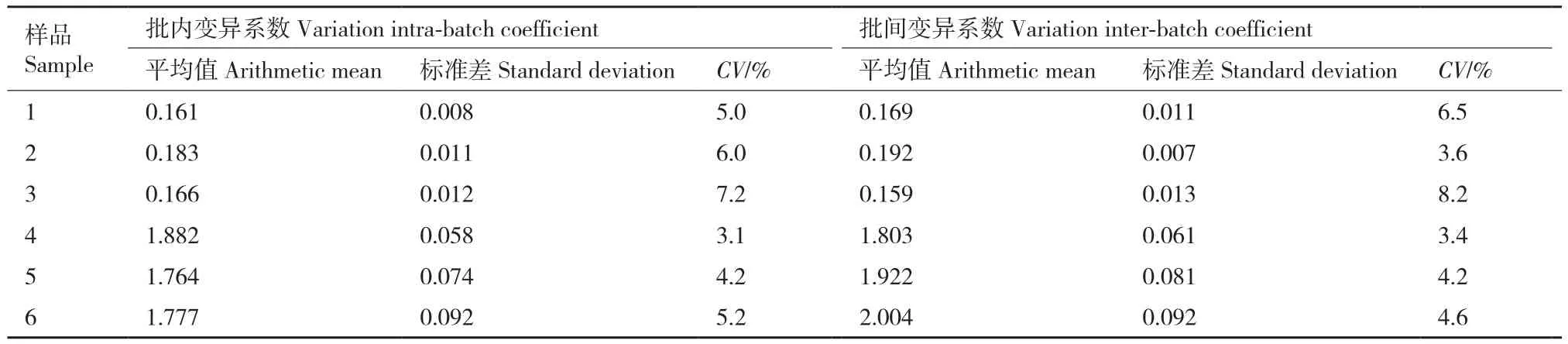
表5 重组蛋白pET-32a-VP1重复性实验Table 5 Reproducibility experiments of recombinant protein pET-32a-VP1
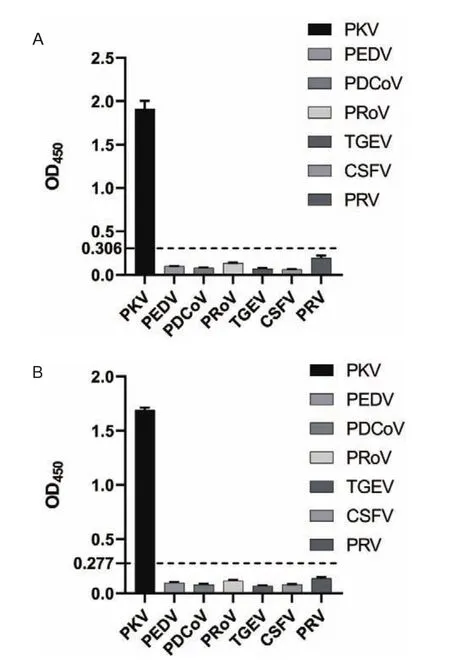
2.4.5 特异性实验 利用建立的ELISA检测方法对PEDV、PDCoV、PRoV阳性血清和已知PKV阴阳性血清样品进行检测,每个血清设置3个重复,结果显示重组蛋白pET-32a-VP0与pET-32a-VP1除PKV阳性血清检测结果为阳性之外,PEDV、PDCoV、ProV、TGEV、CSFV、PRV阳性血清的检测结果均为阴性(图5)。
2.4.6 敏感性实验 利用血清稀释液2倍倍比稀释(1∶100-1∶12 600)检测两种方法的敏感性结果显示,重组蛋白pET-32a-VP0的敏感性实验中,当PKV阳性血清稀释至1∶6 400时,OD450仍大于0.306(图6-A);重组蛋白pET-32a-VP1的敏感性实验中,当PKV阳性血清稀释至1∶3 200时,OD450仍大于0.277(图6-B)。
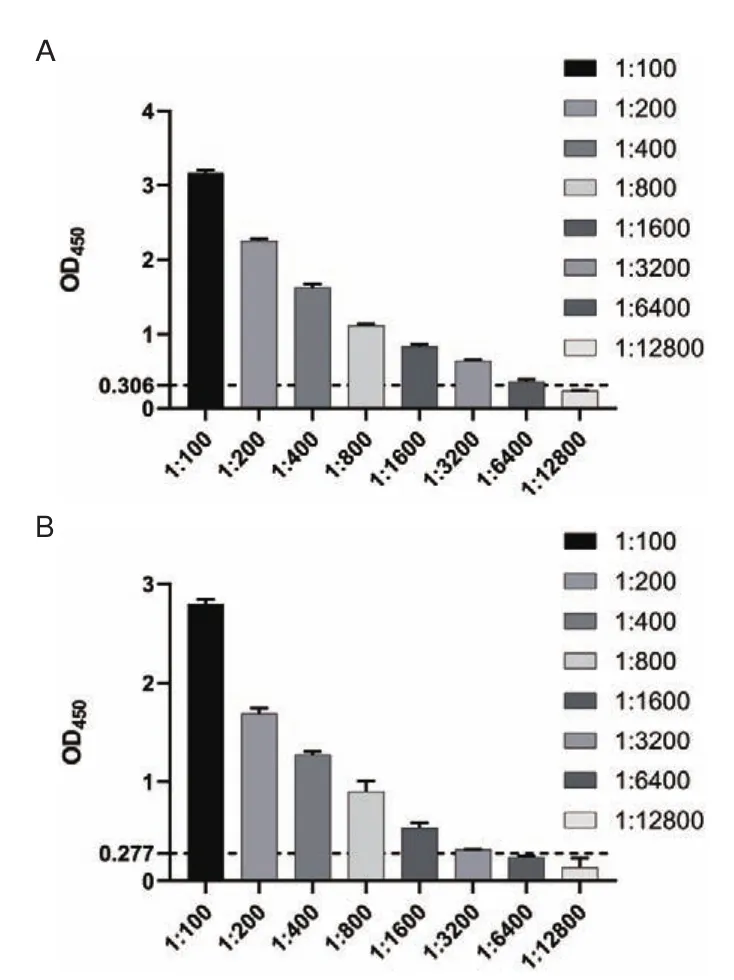
图6 重组蛋白pET-32a-VP0与pET-32a-VP1敏感性实验Fig.6 Sensitivity assay of recombinant protein pET-32a-VP0 and pET-32a-VP1
A:重组蛋白pET-32a-VP0;B:重组蛋白pET-32a-VP1A:Recombinant protein pET-32a-VP0.B:Recombinant protein pET-32a-VP1
2.4.7 临床样本检测与符合率实验 利用建立的间接ELISA检测方法对46份采集自甘肃地区的血清样本检测,结果显示重组蛋白pET-32a-VP0间接ELISA方法检出12份阳性血清,34份阴性血清,Western bloting方法检出11份阴性血清,35份阳性血清,符合率为94.4%;重组蛋白pET-32a-VP1间接ELISA方法检出10份阴性血清,36份阴性血清,Western blottibng方法检出11份阴性血清,35份阳性血清,符合率为94.1%。
3 讨论
PKV自匈牙利首次被报道至今[1],已有越来越多的国家相继在腹泻猪和健康猪体内检出PKV。相关临床研究发现有腹泻症状的猪群PKV阳性率远高于无腹泻症状的猪群,提示该病毒感染与猪腹泻相关[28],但多国研究者对PKV进行研究尚未发现适用于PKV体外增殖培养的细胞系,所以该病毒感染与猪腹泻的关系尚未明确。目前PKV在国内流行较为广泛,且阳性率高并呈上升趋势,可能会成为其他病毒或疾病的诱发因素,所以建立该病毒的检测方法对PKV的诊断与监测及深入研究具有重要意义。
近年来国内已利用不同毒株建立数种间接ELISA方法,韩磊等[25]利用毒株HB-BD的VP0蛋白、田野等[26]利用毒株XD的VP1蛋白、祝俊鹏等[27]利用毒株swKOV CH441的VP3蛋白、朱庆贺等[28]利用毒株JXDX的VP3蛋白分别建立了间接ELISA方法。众所周知,小RNA病毒基因组结构易变异重组,且有研究对不同PKV毒株进行完整的基因测序分析后发现PKV ORF编码的VP1蛋白的氨基酸序列较容易发生突变[29],氨基酸序列的突变可导致所编码的蛋白的结构与功能的改变,并在一定程度上影响蛋白的免疫原性[30]。与韩磊和田野研究不同的是,本研究以毒株AH6为参考序列建立新的间接ELISA方法,可为毒株AH6的感染提供更准确的检测方法。同时基因序列分析表明PKV VP0蛋白不易发生突变,具有良好的免疫原性,而VP1蛋白暴露在病毒粒子表面,含有抗原表位多,是PKV的优势免疫抗原[15,20-22],所以本研究分别以VP0与VP1为包被抗原建立新的PKV检测的间接ELISA方法。
本研究利用大肠杆菌原核表达系统表达PKV重组蛋白pET-32a-VP0与pET-32a-VP1,经Western blotting检测显示PKV阳性血清与纯化的重组蛋白发生特异性反应,表明表达的两个重组蛋白具有良好的免疫原性,可作为间接ELISA的包被抗原。以重组蛋白pET-32a-VP0与pET-32a-VP1作为检测抗原,用棋盘法建立间接ELISA检测方法。与韩磊与田野等建立的方法不同的是,本研究建立的方法在抗原包被时不需要4℃过夜,提高了实验室检测效率。另外,本研究的ELISA方法敏感度可达到 1∶3 200,优于前人建立的同类检测方法。通过对两种ELISA方法进行特异性、敏感性、重复性实验和临床检测后,证明这两种ELISA方法检测的准确率较高且可用于PKV的实验室与临床检测。同时,在建立ELISA方法的过程中发现在同等条件下以重组蛋白pET-32a-VP0为包被抗原建立的间接ELISA检测方法的特异性反应更强、灵敏度更高,可能是因为VP1是PKV突变频率最高的结构蛋白,导致用其作为包被抗原检测某些血清时特异性与敏感性降低,因此PKV AH6株结构蛋白VP0更适合作为包被抗原建立间接ELISA检测方法与检测试剂盒的开发。
4 结论
本研究通过原核表达PKV AH6株结构蛋白VP0与VP1,分别建立了基于猪嵴病毒AH6毒株VP0与VP1蛋白的ELISA抗体检测方法。结果显示,两种ELISA方法检测猪血清时以重组蛋白pET-32a-VP0为包被抗原时血清样品OD450≥0.306时为阳性,OD450<0.306时为阴性;重组蛋白pET-32a-VP1为包被抗原时血清样品OD450≥0.277时为阳性;OD450<0.277为阴性。建立的两种间接ELISA方法通过重复性、特异性、敏感性实验和临床检测证明两种方法都可作为PKV的有效检测手段,但以重组蛋白pET-32a-VP0为包被抗原建立的间接ELISA方法特异性反应更强、灵敏度更高。
文章附件请到本刊官网下载(http://biotech.aiijournal.com/CN/1002-5464/home.shtml)。

