植物SINA E3泛素连接酶功能的研究进展
汤晓丽 姜福东 张洪霞
(1.鲁东大学农林工程研究院,烟台 264025;2.烟台市农业科学研究院,烟台 264000)
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是真核生物细胞中重要且广泛存在的蛋白平衡调节系统,通过介导细胞中错误折叠、受损伤、寿命较短的特别是具有调节作用的蛋白质(转录因子和信号激酶)的泛素化降解,几乎参与细胞中所有的生物学过程,是细胞中一种重要的翻译后调节机制,更是细胞正常生命活动秩序不可或缺的重要调节系统[1-4]。UPS由泛素激活酶E1、泛素结合酶E2、泛素连接酶E3、含76个氨基酸的泛素分子及26S蛋白酶体构成[5]。其中,泛素连接酶E3的种类和数量复杂多样决定UPS所降解靶蛋白的特异性[3]。
SINA(seven in absentia)E3泛素连接酶是一类RING(really interesting new gene)型E3泛素连接酶,蛋白的N端具有负责与E2酶结合的RING结构域,C端是典型的SINA结构域,负责蛋白的二聚体化以及与底物蛋白的结合[6-7]。最早关于SINA E3泛素连接酶的报道来自果蝇。在果蝇眼睛R7视光细胞的分化发育过程中,果蝇SINA发挥重要作用[8]。哺乳动物小鼠的SINA在脊椎动物的发育衍化过程中具有重要作用[9]。果蝇SINA编码的E3泛素连接酶与转录抑制子Tramtrack(TTK)互作,介导TTK泛素化降解,影响果蝇眼睛R7细胞向视光细胞的分化[10]。同年,在人类中也发现了SINA的同源基因,随着研究的不断深入,越来越多的研究表明SINA编码的E3泛素连接酶在生物体中的作用重要且广泛[11-16]。然而,与动物相比,SINA E3泛素连接酶在植物中的研究起步较晚(表1)。本研究对目前SINA在植物中的功能研究进展进行总结概述。
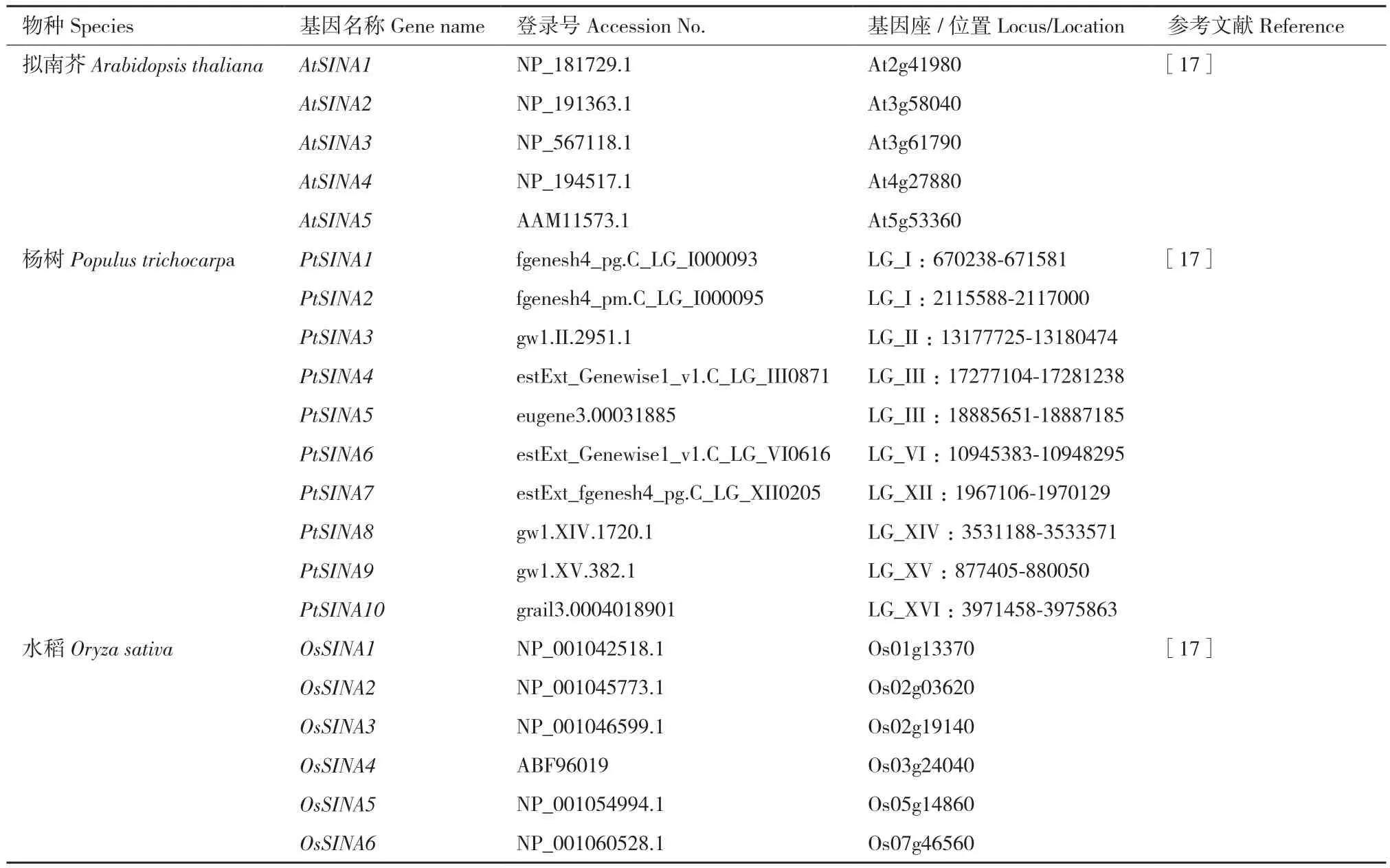
表1 目前研究报道的植物体中的SINATable 1 Reported SINA genes in plant at present
1 SINA E3泛素连接酶在植物生长发育中的功能
拟南芥(Arabidopsis thaliana)SINAT5是植物体中第一个被发现的SINA E3泛素连接酶。2002年,Xie等[23]以AtNAC1为诱饵蛋白,寻找互作蛋白时发现了SINAT5。进一步研究发现,SINAT5与AtNAC1互作,并将其泛素化,进而通过泛素介导的蛋白酶体途径将其降解,终止植物体由AtNAC1传导的生长素信号,实现了对植物侧根发育的调控。虽然生长素信号可以同时诱导SINAT5和AtNAC1(2个在生长素信号传导中具有拮抗作用的基因)的表达,但是,在生长素信号的传导中,SINAT5对AtNAC1的翻译后调节发挥了最终的决定性作用,调
节了植物的生长发育。另外,置换SINAT5的RING结构域酶活位点的关键氨基酸,使其丧失泛素连接酶活性,其对应的超表达株系则表现出侧根数量增加。SINAT5以二聚体形式发挥作用,虽然突变的SINAT5仍可以参与二聚体化,但不具有连接酶的活性,因此,突变的SINAT5竞争性抑制了活性二聚体的产生,发挥了相反的生物学作用[23]。2008年,den Herder等[18]在苜蓿中进行了SINAT5异源表达,得到了相同的结果。超表达SINAT5转基因苜蓿侧根数量明显减少,而SINAT5功能缺失突变体(SINAT5DN)的侧根数量明显增加[18]。超表达SINAT5DN转基因植株的地上部长势和叶片大小明显优于野生型[18]。综上所述,SINA E3泛素连接酶对植物正常生长发育具有重要作用。
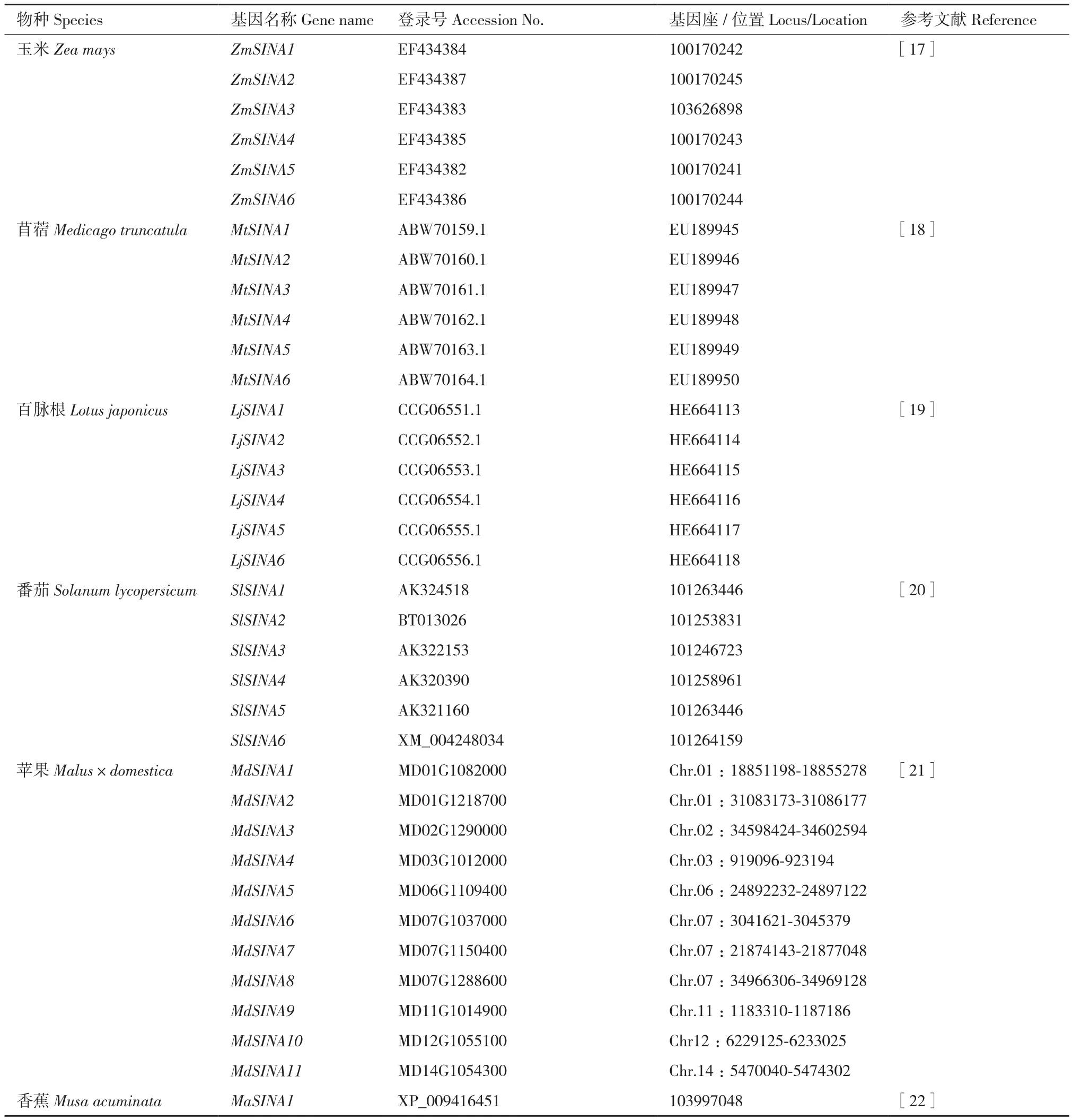
续表Continued
Park等[24]发现在拟南芥由营养生长向生殖生长转变的过程中,SINAT5参与调控了拟南芥的开花。FLC(flowering locus C)是一个MADS-box转录因子,与SINAT5互作,通过抑制成花诱导过程中的一系列基因(如FT、SOC1等),进而抑制植物的开花过程[24-26]。LHY蛋白是拟南芥生物周期节律的一个关键组分,能够根据外界光照和温度的变化调节细胞的生物学活动和植物体的生理适应。SINAT5介导LHY(late elongated hypocotyl)蛋白的泛素化降解,进而调节拟南芥的开花时间[27-29]。研究还发现,光信号的传导蛋白DET1(DE-ETIOLATED1)可以抑制SINAT5对LHY的泛素化降解。因此,SINAT5通过对靶蛋白的泛素化降解建立了光周期与植物开花时间的联系,对植物的生长发育特别是由营养生长向生殖生长的转变发挥重要作用。
拟南芥SINA E3泛素连接酶基因家族有5个成员,SINAT2是拟南芥中第二个被发现的SINA E3泛素连接酶基因,也参与了拟南芥正常生长发育的调节过程。Welsch等[30]研究发现,SINAT2通过与RAP2.2(乙烯响应元件结合蛋白转录因子)互作,影响拟南芥类胡萝卜素的合成。油菜素内酯(BRs)是一类新型的广谱植物生长调节剂,参与调节植物的营养生长、生殖生长、种子发芽以及衰老等一系列的生长发育过程[31]。BRI1-EMS-SUPPRE SSOR 1(BES1)是BR信号通路中一个重要的转录因子,调节BR信号下游基因的表达[32]。拟南芥5个SINA E3均能与BES1互作,促进光下BES1的降解,抑制其下游基因的表达,从而光下植株下胚轴的伸长生长被抑制[33]。相反,在黑暗条件下,SINAs发生自泛素化降解,BES1蛋白正常发挥生物学功能,促进植株下胚轴的伸长生长。同时,该研究还发现,SINAs光下积累量增加,反之减少,BES1含量也随之发生变化[33]。因此,表明SINA E3通过介导BES1的降解,连通了光信号和BR信号,调节了植物的光形态建成。Wang等[20]研究发现超表达SlSINA2转基因番茄的叶片颜色变浅,叶绿素含量降低,植株生长发育迟缓,严重影响了番茄正常的生长发育,还发现超表达SlSINA5转基因番茄的花发育出现异常,花萼、花瓣、雄蕊以及整朵花均不同程度地变小,但具体的作用机制还有待进一步探究。因此,不同的SINA E3通过靶向介导各种各样靶蛋白的降解,调节植物复杂多样的生长发育过程。
2 SINA E3泛素连接酶在植物响应逆境胁迫中的功能
随着研究的不断深入,越来越多的研究发现,SINA E3除了调节植物生长发育外,还参与了植物对多种逆境胁迫的响应。植物中第一个被发现参与逆境胁迫响应的SINA E3是水稻(Oryza sativa)的OsDIS1(Oryza sativa drought-induced SINA protein 1)。2011年Ning等[34]筛选获得受干旱诱导表达的OsDIS1,OsDIS1抑制了水稻的抗旱性。随后,Ning等[35]进一步研究发现OsDIS1通过与OsSKIPa(干旱和盐胁迫的正调因子)互作,影响了下游胁迫应答响应基因的表达,进而调节水稻的抗旱性。
与水稻SINA E3功能恰恰相反,AtSINA2提高了拟南芥的干旱胁迫抗性,超表达AtSINA2后,转基因拟南芥的抗旱性明显增强。进一步研究发现,干旱条件下AtSINA2促进ABA介导的植物叶片气孔的闭合,降低水分散失,进而提高了转基因植株的抗旱性[36]。与拟南芥 5 个 SINA E3(SINAT1-SINAT5)相比,AtSINA2(也被称为SINAT6)的N端含有一个不完整的RING结构域,认为与SINAT5DN一样,AtSINA2没有E3泛素连接酶的活性,竞争性抑制了活性二聚体的产生,因此,发挥了与OsDIS1截然相反的作用[36]。然而,2018年Chen等[37]研究发现,AtSINA2蛋白N端的B-box结构域弥补了不完整的RING结构域,使其仍具有E3泛素连接酶的活性。同时,该研究还发现AtSINA2可以与CDKG1(细胞周期蛋白依赖的蛋白激酶G1)互作,而CDKG1对AtSINA2的磷酸化直接影响了AtSINA2的稳定性,进而调节了植物体对ABA和渗透胁迫的响应[37],表明SINA E3调节其靶蛋白稳定性的同时,其自身的活性功能同样受蛋白的磷酸化和去磷酸化调节,因此,SINA E3发挥功能的机制复杂而多样。ICE(INDUCER OF CBF EXPRESSION)是一类MYC型bHLH转录因子,目前,ICE-CBF-COR转录级联途径是已知植物体中重要的冷胁迫响应信号途径[38]。2017年,Fan等[22]研究发现香蕉SINAE3还参与了植物对冷胁迫的响应,发现MaSINA1通过泛素化降解转录因子MaICE1,进而抑制MaICE1下游冷胁迫重要调节因子MaNAC1的表达,调节植物对冷胁迫的应答响应。
ABA是所有植物激素中最重要也是作用最广泛的一种激素,其处于植物对非生物胁迫应答调节的核心,被称为“植物逆境激素”。AtSINA2通过调节由ABA介导的气孔闭合而提高植物的抗旱性[36]。2020 年 Li等[21]发现苹果 MdSINA2 可以被ABA诱导表达,超表达MdSINA2转基因苹果愈伤和拟南芥均表现出ABA敏感,说明与AtSINA2一样,MdSINA2参与了ABA信号调节植物对干旱等多种逆境胁迫的应答响应[21]。同时,苹果SINA E3还调节植物对营养元素匮乏的响应。2020年,Xia等[39]发现超表达SINAT1、SINAT2、SINAT3和SINAT4的转基因植株对ABA的敏感性增加,SINATs通过泛素化降解FREE1和VPS23A(蛋白运输的胞内分拣复合体的关键组分),解除它们对ABA受体PYR和PYL4的抑制作用,进而参与植物的ABA信号传导。当植物体中ABA含量升高,SINATs受诱导含量升高,与FREE1和VPS23A发生互作,将其降解,此时ABA的受体被释放发挥作用,启动ABA的传导及响应基因的表达,植物体表现出对ABA的应答响应。
3 SINA E3泛素连接酶在植物与其他生物互作中的功能
植物固着生长的特性使植物被动遭受外界环境的各种有利因素和不利因素的影响,SINA E3不仅调节植物在适宜条件下的生长发育,同时也参与植物对各种不利环境条件的应答。当外界环境营养条件匮乏时,植物一方面通过改变根系的构型,尽可能多地从外界土壤中吸收养分;另一方面,植物利用根系与土壤中各类生物建立共生关系来吸收养分[40]。在根系的构型方面,SINAT5通过影响根毛的多少来发挥作用。SINA E3在植物根系与土壤中各类生物相互作用中也发挥着重要作用。
den Herder等[18]发 现 异 源 表 达 SINAT5和SINAT5DN的苜蓿,不仅影响了它的正常生长发育,同时也影响了根毛与根瘤菌之间的相互作用,抑制了根瘤菌与根毛形成稳定的共生关系和共生结构。共生类受体蛋白激酶(symbiosis receptor-like kinase,SYMRK)是微生物信号分子刺激植物根细胞后,植物体进行共生信号传导的关键组分[41]。2012年,den Herder等[19]发现百脉根中的LjSINA4 E3可以与SYMRK互作,并且超表达LjSINA4后,SYMRK蛋白含量降低,抑制了与微生物进行互利共生信号的传导,进而抑制了百脉根与根瘤菌的相互作用。
SINA E3除了参与植物与共生微生物之间的相互作用外,还参与了植物与病原微生物之间的相互作用。2016年Miao等[42]发现番茄SlSINA3可以将转录因子SlNAC1泛素化降解。SlNAC1是番茄胁迫相关NAC转录因子,可以被病原微生物假单胞菌(Pseudomonas)诱导表达,是植物防御病原微生物侵染的有效策略。当烟草SlNAC1同源基因被抑制表达后,烟草对假单胞菌的敏感性明显增强[43]。超表达SlSINA3后,抑制了阻力蛋白R(resistance)蛋白诱导的超敏反应(hypersensitive response,HR)。因此,SlSINA3通过翻译后水平的调节作用,抑制了番茄对病原微生物的防御反应。除了SlSINA3以外,番茄其他SINA E3也参与了番茄对病原微生物的防御响应。其中,SlSINA4可以激活细胞中防御相关信号的传导,促进植物体对病原微生物侵染的应答响应。与SlSINA4不同,SlSINA1、SlSINA2、SlSINA5和SlSINA6则是通过降解R蛋白下游的相关组分,发挥与SlSINA3相同的功能,抑制植物对病原微生物的防御响应[43]。因此,面对外界病原微生物的入侵,植物体中不同SINA E3发挥着各自不同的作用,有的相互协同发挥作用,有的相互拮抗发挥作用,共同调节植物体对病原微生物的响应。
4 SINA E3泛素连接酶在植物细胞自噬中的功能
与UPS对细胞中蛋白平衡调节作用一样,细胞自噬(autophagy)是细胞中另一个重要的蛋白平衡调节系统。其中,UPS是对寿命较短、错误折叠以及受损伤蛋白的主要降解途径,细胞自噬主要负责清除大的胞质组分,包括聚集的蛋白、丧失功能的细胞器和侵入的病原菌[39]。两个蛋白平衡调节系统分别发挥不同的作用,又保持着千丝万缕的联系。如前所述,SINA E3通过泛素化调节植物BR信号途径BES1转录因子的稳定性,进而参与植物的光形态建成[33]。同时还发现SINAT2可以与泛素结合受体蛋白DOMINANT SUPPRESSOR OF KAR 2(DSK2)直接互作,参与BES1-DSK2-ATG8复合体的构成,介导BES1经细胞自噬途径的降解,表明植物在逆境胁迫和N或C元素缺乏的条件下,SINA E3可以通过同时激活泛素蛋白酶途径和细胞自噬途径对BES1的降解[33]。因此,SINA E3在细胞自噬过程中具有抑制植物在逆境下生长发育,提高植物抗逆性的作用,维持了植物在逆境条件下生长和抗性能力的平衡。
2017年,Qi等[44]研究发现SINAT1、SINAT2和SINA2均可直接与细胞自噬相关蛋白ATGs发生互作,参与细胞自噬过程的调节。SINAT1/SINAT2和SINA2在调节细胞自噬方面发挥着相反作用,当植物体的营养条件良好时,SINAT1和SINAT2促进ATG6蛋白的泛素化降解,抑制细胞自噬;当营养条件匮乏时,SINA2被诱导表达,发挥相反作用,抑制ATG6的泛素化降解,促进细胞自噬[44]。同时研究还指出,SINAT1和SINAT2在调节ATG6方面具有一定程度的功能冗余。因此该研究表明,植物体中SINA E3对细胞生命活动的调节精准而多样,不仅可以通过UPS途径直接发挥作用,同时也可以通过间接影响与UPS平行的其他调节途径来发挥作用,实现了功能的进一步强化。而对于每一个SINA E3及其家族成员具体的生物学功能还需要更深入细致的研究和探索。2020年,Qi等[45]再次发现SINAT1、SINAT2和SINA2还可以与自噬相关蛋白ATG13互作。ATG13通过与ATG1互作形成蛋白激酶复合体调节自噬小体的形成,进而调节植物细胞自噬的过程[46]。植物体在不同的营养条件下,就是通过SINAT1、SINAT2和SINA2调节ATG1和ATG13复合体的稳定性,调节了细胞自噬过程,进而决定植物在不同营养条件下的应答响应。综上所述,ATGs是细胞自噬的关键组分,在细胞自噬中发挥重要作用。SINA E3通过调节ATGs的稳定性,间接参与了细胞自噬[47-49]。因此,UPS和细胞自噬是细胞中两个非常重要的蛋白平衡调节系统,两者彼此独立同时又相互依存,SINA E3的存在介导了两个系统之间千丝万缕的联系,UPS通过SINA E3实现了对细胞自噬的调节和影响,同时细胞自噬也通过SINA E3实现了自身功能的完善和强大。
5 总结与展望
SINA E3是一类重要的E3泛素连接酶,通过调节细胞中不同信号通路上游的转录因子或蛋白激酶等调节蛋白发挥生物学功能,作用广泛而深入。他的调节作用赋予了植物面对外界复杂环境条件“文武之道,一张一弛”的智慧。条件适宜时,植物正常生长发育;环境恶劣时,通过牺牲生长速度换取继续活下去的能力;当有益微生物来临时,调节微生物与植物的和谐相处进行互利共生;当有害微生物侵入时,将其限定在一定范围内,防止其对植物进一步侵害。当然,植物中SINA E3的功能研究起步较晚,还有很多问题有待未来发现和探索。包括:(1)AtSINA2的E3泛素连接酶活性受其蛋白磷酸化状态的影响,其他的SINA E3活性是否也同样存在蛋白的翻译后调节?(2)植物中SINA E3以同源或异源二聚体发挥作用的具体机制是什么?(3)动物中研究发现有的SINA E3可以以多聚体的形式发挥作用,植物中是否也存在相同的作用机制?(4)是否有更好的挖掘SINA E3互作蛋白的研究方法,进而更高效的研究SINA E3在植物体中重要的生物学功能。(5)为什么植物中大多数目前研究已知的SINA E3均发挥负调作用?不论是SINA E3蛋白自身的磷酸化,还是同源和异源二聚体的形成机制以及SINA E3通过蛋白与蛋白的互作靶向降解不同的靶蛋白(调节蛋白或者功能蛋白),均涉及到蛋白与蛋白的互作,因此在未来SINA E3功能的研究中需综合利用多种蛋白互作的研究技术解决目前SINA E3功能研究中遇到的诸多问题,进而对植物中SINA E3功能进行进一步的挖掘和探索。SINA E3多样化的功能也让我们初步领略了植物体庞大复杂的调控网络,为未来探索植物体中更多、更复杂的调节机制和功能途径奠定基础。

