植物中C-糖基转移酶的结构与应用
赵玉雪 王芸 余璐瑶 刘京晶 斯金平 张新凤 张磊,,
(1.浙江农林大学省部共建亚热带森林培育国家重点实验室,杭州 311300;2.上海大学医学院生物医药创新研发中心,上海 200444;3.海军军医大学药学院药用植物学教研室,上海 200433)
糖基化是植物次生代谢中较为普遍的修饰反应[1],催化该反应的后修饰酶是糖基转移酶(glycosyltransferases,GT;EC 2.4.x.y),几乎存在于所有植物中[2],植物糖基转移酶参与不同生命过程,包括特化代谢、植物激素修饰、外源性生物解毒以及植物与病原体相互作用等[1,3-7]。例如苹果O-糖基转移酶参与的根皮苷合成是高品质苹果培育的重要调控靶点[8];茶叶中的糖基转移酶广泛参与多酚类物质的合成,直接影响茶饮的口感[9];茶树中的橙花叔醇糖基化参与调控冷胁迫响应[10]。
糖基化反应机制一直是植物代谢研究中的重要领域,在植物的糖基化反应中,常见的糖基供体为UDP-葡萄糖、UDP-半乳糖、UDP-木糖和UDP-鼠李糖等[11-15];而糖基受体比较多样,不仅包括脂类、氨基酸、多糖类初生代谢产物,也包括木脂素、萜类、生物碱、黄酮类等次生代谢产物。糖基转移酶能够将糖基从活化的供体分子转移到受体分子上,形成糖苷键,从而直接参与单糖苷、二糖、低聚糖、聚糖苷和多糖的生物合成[16-17],提高了植物天然产物的复杂性和多样性[18-19]。
根据催化受体分子的糖基化位点的差异,糖苷产物分为O-型糖苷、C-型糖苷、N-型糖苷和S-型糖苷,对应的催化酶分为O-、C-、N-、S-四种糖基转移酶。O-糖基转移酶(O-glucosyltransferases,OGTs)的研究最为广泛、深入,普遍参与植物次生代谢产物和激素的糖基化修饰,催化底物呈现出较为明显的特征[20]。其催化产物对植物生长发育环境抗逆性等方面具有重要意义[21-22]。N-糖基化和S-糖基化是蛋白翻译后修饰的重要方法,但植物中N-糖基转移酶(N-glucosyltransferases,NGTs)和S-糖基转移酶(S-glucosyltransferases,SGTs)的相关研究较少。番茄中O-糖基转移酶对其茎尖的长度有着调控作用[23],穿心莲中二萜糖基转移酶ApUGT参与活性成分穿心莲内酯的合成[24];模式植物拟南芥中发现的N-糖基转移酶UGT76C1、UGT76C2可以催化玉米素、激动素、6-苄基氨基嘌呤等细胞分裂素[25],UGT76C4和 UGT76C5可以催化烟酸 N-糖基化[26];银杏中的N-糖基转移酶GbNGT1完善了生长素的代谢通道[27]。通过探究UGT74B1参与拟南芥硫代葡萄糖苷的生物合成,以及突变体的表型观察,初步探索了S-糖基转移酶的生物学功能[28]。
随着糖基转移酶研究的深入以及结构生物学的发展,C-糖基转移酶(C-glucosyltransferases,CGTs)开始进入研究者的视野,有些C-糖苷类化合物具有抗氧化、抗糖尿病等多种生物活性和较高的药用价值[29],如葛根素(大豆苷元8-葡萄糖苷)广泛用于治疗心血管疾病,芹菜苷元糖基化后能表现出明显的抗病毒、抗糖尿病、抗阿尔茨海默病及抗炎等作用。
C-糖基转移酶是天然和非天然产物C-糖基化的有力工具,但糖苷类化合物的化学合成困难,来源、结构多样性及药物研究受到一定程度的制约[30-34]。C-糖基化反应中,糖基供体的含量、C-糖基转移酶的活性、蛋白表达量、底物的浓度等与碳苷化合物的产量密切相关[29]。目前对植物体内的碳苷类化合物的生物合成途径和CGT的调控机制还有待深入研究。为了发现植物中的CGT,现阶段最常用的方法是构建系统进化树,将已表征的这些CGT以最大似然法构建系统进化树(图1),发现它们是一个同源性极高的基因家族,可以通过同源比对的方法对CGT进行挖掘和筛选。对糖基转移酶及其基因家族的研究不仅有助于解析糖苷类化合物生物合成与调控的机制,还可以为研究合成有生物活性的糖苷类化合物提供新的路径。本文综述了植物中C-糖基转移酶分类、空间结构与生物技术应用的研究进展,以期此类酶为今后的研究提供可借鉴的思路。
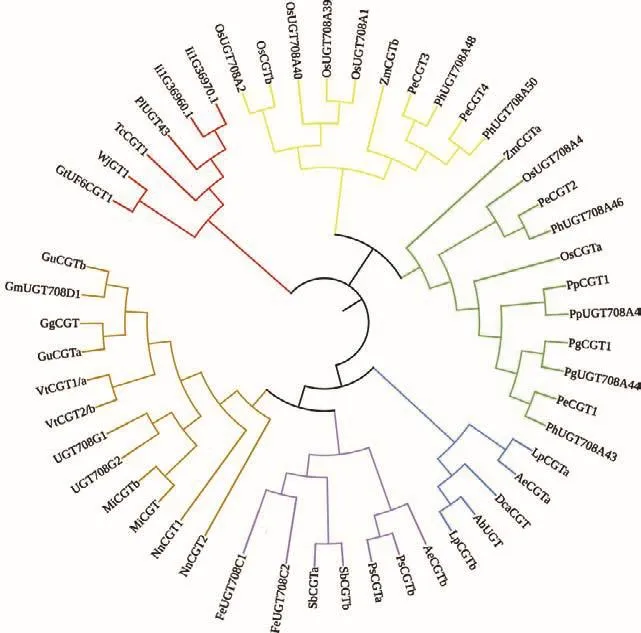
图1 已有功能验证C-糖基转移酶的系统进化树Fig.1 Phylogenetic tree of functionally validated C-glycosyltransferases
1 植物C-糖基转移酶
C-糖基转移酶催化糖基供体和受体形成C-C键,合成C-糖苷类化合物,此过程具有高效性和区域特异性。目前已报道的C-糖基转移酶介导糖基化的底物主要以黄酮类化合物为主,也有部分苯丙素类和酚类化合物(图2,相关CGTs见表1)。
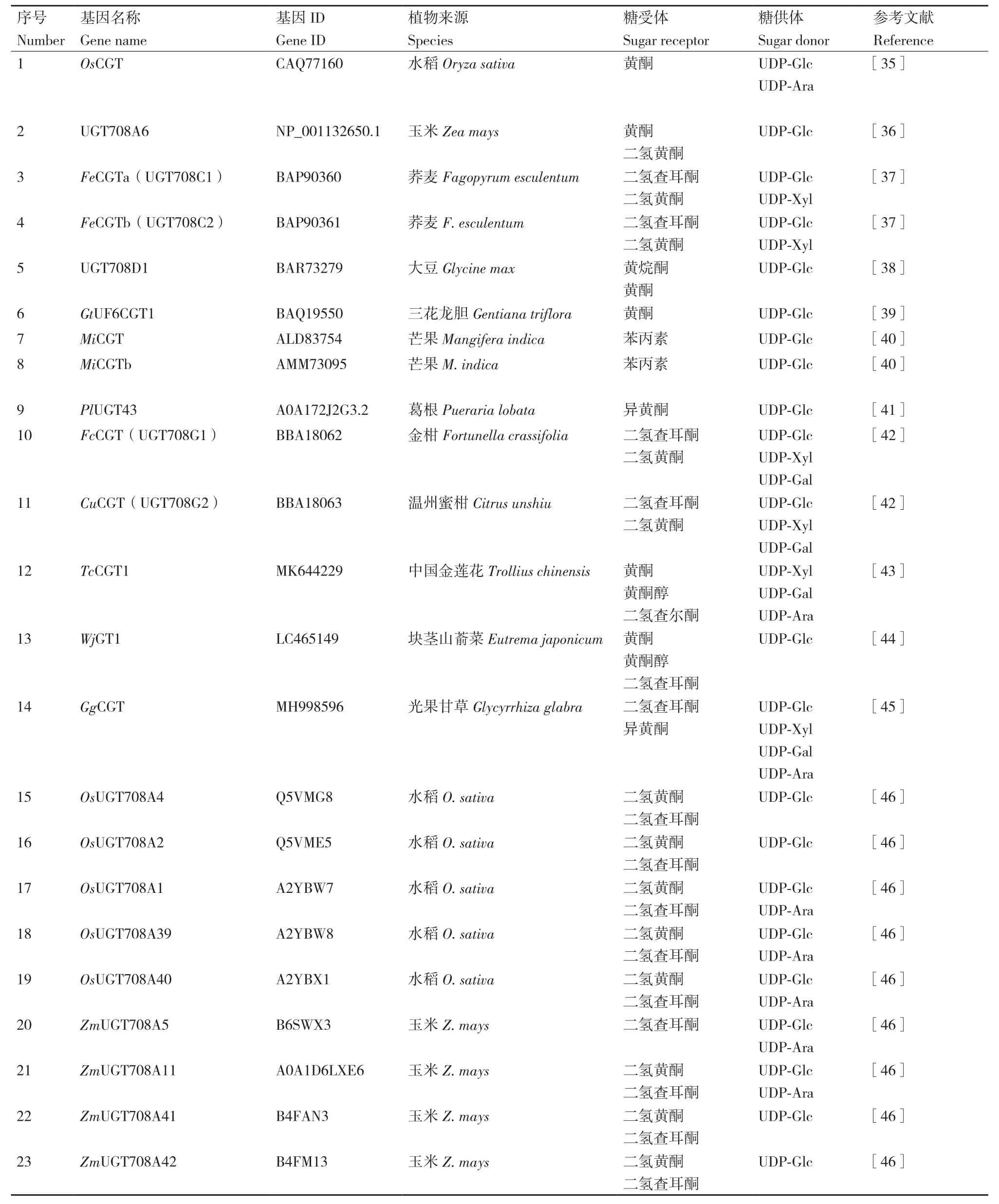
表1 已有报道的CGT基因研究汇总Table 1 Summary of reported CGT gene studies
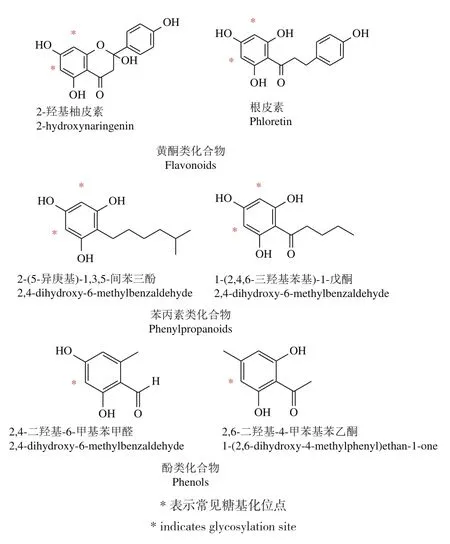
图2 CGT介导糖基化的主要底物结构示例Fig.2 Example structures of major substrates for CGT-mediated glycosylation
2 C-糖基转移酶的结构
2.1 CGT结构解析
对C-糖基转移酶晶体结构的探索能够为理解酶-底物的相互作用机制提供科学依据,同时也奠定了蛋白质改造工程的基础[51]。2019年中国金莲花TcCGT1晶体结构的解析,开启了探索植物功能酶CGT晶体结构的大门[43]。截至目前,已有6种植物共15个CGT的实际晶体结构经过X-射线衍射解析(表2、图3)。
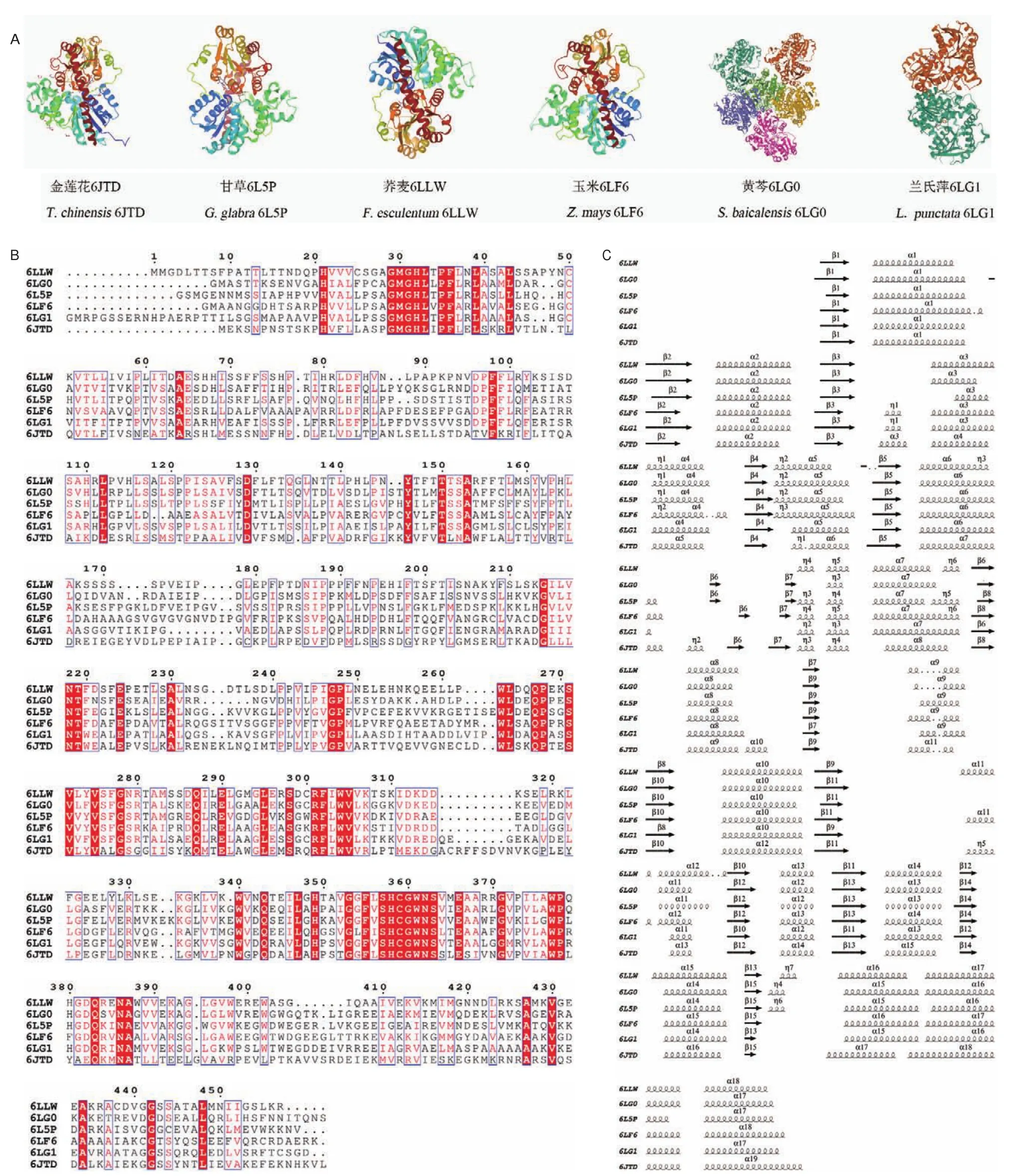
图3 已有结构解析的植物CGT的蛋白结构Fig.3 Protein crystal structure of structurally resolved plant CGT

表2 已有解析晶体结构的CGT蛋白Table 2 Resolved crystal structures of available CGT proteins
CGT作为催化形成C-糖苷键的生物合成关键酶,相比于其他类型植物糖基转移酶发现较少,其蛋白质三维结构与UGT大致相似,具有UGT普遍的结构特征,以GT-B折叠方式呈现:在单分子蛋白的状态下,其蛋白结构含有两个Rossmann折叠的β/α/β结构域,分为N-端结构(NTD)和C-端结构域(CTD),它们之间的联系并非十分紧密,以一个面对的姿势呈现,从而形成一个能够与底物结合的细长裂缝。其中N-端结构域其保守性稍差,负责与糖基受体的结合;C-端结构域中相对保守的PSPG(putative secondary plant glycosyltransferase)区域则由44个氨基酸组合而成,糖基供体通过与PSPG区域的氨基酸残基之间的多个氢键相互作用从而与糖基转移酶稳定地结合[53-58]。
2.2 CGT底物杂泛性的结构基础
现有研究发现,目前植物CGT的催化过程表现出底物杂泛性的特点,N-端结构域和C-端结构域之间所形成的底物结合口袋,是决定CGT糖受体和糖基供体结合性质的结构基础[43]。底物在糖基转移酶活性口袋中的立体结合构像,会影响双功能糖基转移酶催化性质的偏好性,即倾向于生成C-苷或O-苷。在中国金莲花TcCGT1的催化研究中发现,宽敞的糖受体结合口袋有利于TcCGT1高效催化36种碳苷类化合物,基于晶体结构解析结果进行关键氨基酸残基的定点突变,在具体催化时,对其宽敞的糖受体结合口袋周围的残基进行定点诱变,改变了立体构象,口袋宽敞时,更易接纳较长基团,TcCGT1表现C-活性,口袋较小时迫使与较短的基团结合,故TcCGT1催化出O-苷产物。由底物的自发去质子化,可使得TcCGT1实现由C-糖基化向O-糖基化的功能转变。即在糖基化底物相同的情况下,口袋宽敞时,更易接纳较长基团生成C-苷产物,口袋较小时则被迫与较短的基团结合,催化生成O-苷产物[43]。
同时,对光果甘草中的双C-糖基转移酶GgCGT进行研究,采用X-射线晶体学方法对其进行结构解析(图4),证明His27作为碱性氨基酸辅助底物脱质子,从而起到催化作用,确定了GgCGT催化双C-糖基化反应的最佳结构单元为弗洛丙酮,其口袋的立体构象发生的位置偏转导致糖基部分与周围氨基酸形成氢键作用的强弱发生变化,影响酶与糖供体的结合作用强弱,进而决定糖基供体的偏好性顺序[45]。
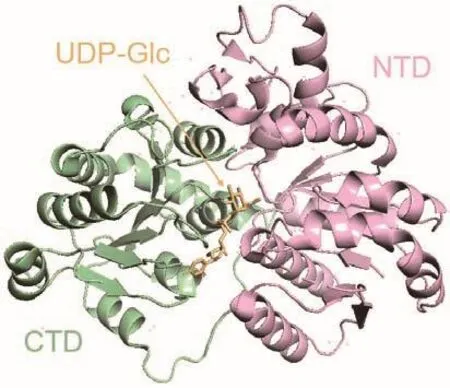
图4 光果甘草GgCGT的晶体结构Fig.4 Crystal structure of GgCGT of Glycyrrhiza glabra
3 C-糖基转移酶的应用
糖基化反应机制一直是植物代谢研究中的重要领域,2009年水稻中首个植物C-糖基转移酶的发现拉开了植物C-糖基转移酶研究的序章[35]。数十年来,对植物体内催化各种活性成分物质合成的糖基转移酶进行了解析,其中催化黄酮类化合物的CGT为主,例如水稻 OsCGT[35]、荞麦 FeCGTa 和 FeCGTb[37]、日本三花龙胆GtUF6CGT1[39]等。黄酮类化合物作为底物时,多进行6-C-糖基化,鲜见8-C-糖基化产物,而双C-糖基转移酶可以将这两个位点同时或分步催化[59],例如柑橘类植物金桔和温州蜜桔的FcCGT 和 CuCGT[42],铁皮石斛的 DcaCGT[47],荷花的NnCGT1和NnCGT2[48]。有些CGT是既产生C-糖苷类,又可以产生O-糖苷类物质的双功能糖基转移酶,如玉米UGT708A6[36]。开展C-糖基转移酶的应用研究,可以调控重要活性成分生物合成途径,同时也是生物催化剂定向改造的基础。
续表Continued
3.1 药物发现与异源合成
随着对糖基转移酶的挖掘和认识的深入,其催化途径逐渐明确,基于糖基化的药物设计和开发日趋成熟。竹子和谷类作物的叶片中含有一类具有止痛功能的C-糖基化黄酮(C-glycosylated flavones)CGFs[60-63],优于阿司匹林等临床药物,对其合成过程中C-糖基转移酶的解析[46],可为新药发现鉴定基础。芦荟中新颖的C-糖基转移酶AbCGT[50]能将缺乏乙酰基团的酚类化合物进行C-糖基化,且AbCGT具有底物杂泛性,可以通过化学酶法先合成苷元再合成C-糖苷的方式,实现多种新颖C-糖苷的化学-酶法合成,此结果对抗糖尿病创新药物的发现及绿色制造提供了新的思路。葛根中主要药用活性物质葛根素合成的关键酶PlUGT43是一类C-糖基转移酶[41,64],该发现有利于实现葛根素的异源合成。
3.2 晶体解析与定向改造
通过在蛋白晶体结构中找到糖供体及受体结合所需的氨基酸残基位点以及蛋白空间结构发生的变化阐明糖基转移酶的催化机制,为设计有效的糖基化生物催化剂并定向改造提供基础,定向改造不仅能够提高其对底物的杂泛性,同时也能够提高其催化活性[65]。
通过同源模拟和分子对接预测活性位点,再对其突变加以验证,是判断关键氨基酸位点的常用方法之一。大豆UGT708D1[27]验证的3个残基位点是预测的活性位点,取代关键残基位点可破坏其催化活性,也可阻断C-糖基转移酶的催化活性,增强O-糖基转移酶的催化的专属性,能够达到定向调控。芒果中发现的两步催化香豆素MiCGTb[40]也验证了关键氨基酸残基位点,通过对MiCGTb进行突变,其糖受体槲皮素的糖基化活性大幅提升,且糖基化选择过程更为严格[66]。
糖基转移酶的绿色、高效,能够为药物的靶向合成提供新的方向,实际晶体结构的解析对明确催化机制有着重要的作用,进一步阐明糖基化活性和糖供体选择性的分子催化机理,推动了C-糖苷类化合物的生物合成和以此为基础的药物研发进程。金莲花 TcCGT1[43]、甘草 GgCGT[45]以及荞麦CGT708C1[52]等晶体结构都已解析并应用。学者们还鉴定了玉米、兰氏萍和黄芩等6种植物夏佛塔苷合成途径中的12个关键CGT,并对部分酶的晶体结构进行了解析[49],为阐明植物糖基化次生代谢的进化机制提供了重要理论基础。
4 展望
糖基化反应是天然产物生物合成的重要后修饰方式,一些植物次生代谢产物的糖基化反应由于其对生理的重大影响也备受关注,无论是在天然或非天然领域都发挥着不可或缺的作用,同时,一些重要的植物激素的糖苷化修饰在生理上也发挥着重要作用。因此解析植物糖苷类物质的生物合成途径的关键酶功能结构,是推动这些化合物应用的基础。
MiCGT进行定向进化来催化黄酮类化合物的糖基化,阐明了底物特异性和区域选择性的起源[66]。此类糖基转移酶的研究,对以改良植株和提高产量为目的定向改造糖基转移酶提供依据,可以结合基因工程和蛋白质工程的技术手段,对糖基转移酶进行基于活性氨基酸位点的挖掘与改造的理性设计,可以实现目标活性成分的定向合成和积累,以实现糖苷类产物的定向精准调控。
随着C-糖基转移酶的实际晶体结构被不断解析,为设计高效、高特异性的生物催化剂和生物活性药物提供科学依据,为进一步开发利用糖苷类化合物创造条件,为合成生物学提供最适元件,为天然产物异源合成奠定基础。就目前植物C-糖基转移酶的研究进展而言,研究最透彻的是黄酮类化合物的相关CGT,大量研究阐明了以黄酮、二氢黄酮为底物的催化过程,对苯丙素类、酚类化合物的研究还有待深入。
植物糖基转移酶在改善天然产物活性方面有很大的应用潜力,以酶促催化合成为基础的新型糖苷类产物的研究与开发为人们所期待,C-糖基转移酶催化底物杂泛性的特点使糖苷类产物更具多样化,能为人工模拟生物合成领域拓展新思路。随着多种新型糖基转移酶的发现和商业化生产使这些多样化逐渐成为可能,更多优质新型糖苷类产物将会被挖掘并研制,对植物优良种质培育及为糖苷类化合物的异源高效合成有重要意义。

