基于CRSIPR/Cas9技术构建凝血因子8基因敲除小鼠模型及表型验证
王海杰 王成稷 郭洋 王云 陈艳娟 梁敏 王珏 龚慧 沈如凌
(上海实验动物研究中心,上海 201203)
血友病A(hemophilia A,HA)又称凝血因子Ⅷ(coagulation factor Ⅷ,Ⅷ)缺乏症,也称抗血友病因子(antihemophilic factor,AHF)缺乏症,是一种X染色体连锁的隐性遗传出血性疾病,其特点是凝血活酶生成障碍,并导致凝血时间延长[1]。HA临床表现主要为反复的自发性关节、肌肉出血,也可以影响内脏器官,严重的可因中枢神经系统出血死亡[2]。血友病A在男性群体中发病率为10-20/10万,女性发病极为罕见,其中血友病A占血友病患者数总体的 80%-85%[3]。
F8基因位于X染色体长臂末端(Xq28),长度约为209.60 kb,由26 个外显子和25 个内含子构成,结构复杂。F8因子主要在肝脏合成,也在肾脏、内皮细胞和淋巴组织中表达,是最大的凝血因子之一。F8基因庞大,从大量的血友病A临床资料来看,导致发病的基因缺陷的形式具有多样性,其中包括突变、内含子倒位、插入、缺失等[4]。
作为凝血因子9的辅助因子,F8基因参与F9包括基因转录、翻译及其后修饰等在内的凝血过程各环节[2]。F8基因突变几乎完全发生在雄性生殖细胞中,使凝血因子9的蛋白质构成、结构发生变化,从而导致凝血激活过程各环节发生异常,继而导致凝血活性、抗原活性发生不同程度改变,从而表现为包括先天性出血障碍在内不同严重程度的临床症状。目前临床HA患者治疗中最常用的是替代疗法,即通过给患者输入血浆来源或者重组的F8蛋白进行控制[5-8]。但由于F8蛋白的半衰期短,药物价格昂贵,同时5%-7%的患者会产生相关抑制效应,限制了替代疗法的有效性。HA单基因突变的特点使基因治疗成为重点治疗方向,并且已成为遗传发病机理、基因诊断、基因治疗的主要研究对象[9-10]。
目前为止,已有多家实验室和公司制备了F8基因敲除小鼠,其中以杰克逊实验室提供的HA小鼠(B6;129S-F8tm1Kaz/J)最为常见,其构建策略是利用小鼠胚胎干细胞基因打靶技术通过同源重组破坏F8基因表达,从而产生血友病A的临床症状;新的基因编辑工具,如CRISPR/Cas9技术出现后国内多家基因编辑公司构建了F8基因敲除品系。由于构建中需要用到不同背景的动物,使得HA模型在遗传背景上比较复杂[11]。本文利用CRISPR/Cas9介导的非同源重组(non-homologous end joining,NHEJ)基因敲除技术,在C57BL/6背景小鼠上成功构建F8基因敲除小鼠模型,将整个F8基因的编码区进行了敲除。该方法省去了ES细胞打靶步骤,比传统基因打靶方法更为便捷,效率更高,敲除策略更为彻底,该模型的制备成功将为血友病的治疗研究提供又一选择工具[12-13]。
1 材料与方法
1.1 材料
1.1.1 主要试剂 感受态细胞、各种限制性内切酶、DNA聚合酶、PCR相关试剂和T4 DNA连接酶购自 TaKaRa公司;Cas9表达载体、pX-T7-sgRNA质粒由上海南方模式生物科技股份有限公司提供;GeneRluer 1kb DNA Ladder、mMESSAGE mMACHINE T7 Ultra Kit 试剂盒购自Thermofisher公司;质粒小量抽提试剂盒和琼脂糖胶回收试剂盒购自OMEGA公司;HiScribe T7 High Yield RNA Synthesis Kit 试剂盒购自NEB公司;Trizol试剂购自北京天根生化科技有限公司;反转录和qPCR荧光预混液由Transgen公司提供 ;Mouse Factor Ⅷ ELISA Kit(Colorimetric)购自Novus公司;纤维蛋白原(Fibrinogen,FIB)测定试剂盒、活化部分凝血酶时间测定试剂盒(APTT试剂盒)购自北京美创公司;人凝血因子Ⅷ(human coagulation factor Ⅷ)试剂盒购自山东泰邦生物制品有限公司。
1.1.2 实验动物 C57BL/6背景F8基因敲除小鼠(F8-/-小鼠)及野生型小鼠(WT小鼠)均由上海南方模式生物科技股份有限公司繁育提供[SCXK(沪)2019-0002]。本实验所涉及小鼠均按照SPF级动物要求,饲养于上海实验动物研究中心SPF级实验动物房[SYXK(沪)2019-0003]。所有实验操作均经上海南方模式生物科技股份有限公司实验动物管理和使用委员会(IACUC)审批通过(IACUC号2017-0003)。
1.2 方法
1.2.1 sgRNAs设计和表达载体构建 小鼠F8基因定位于小鼠X染色体的 X A7.3区段(Chromosome X:74 216 321-74 425 922,ENSMUST00000033539.12),全长约209.60 kb,转录本F8-201,有26 个外显子,表达蛋白全长2 319 aa。根据小鼠F8基因结构基因结构,通过在线sgRNA设计软件(http://crispr.mit.edu /),选择敲除区域为外显子1(exon1)编码区到外显子26(exon26),在exon1非编码区和exon26下游序列中分别选择sgRNA靶位点,sgRNA靶序列信息见表1。根据sgRNA靶位点,寡聚核苷酸序列,合成相应的oligoDNA用于构建sgRNA表达载体,序列信息见表2。

表1 sgRNA序列信息Table 1 sgRNA sequence information
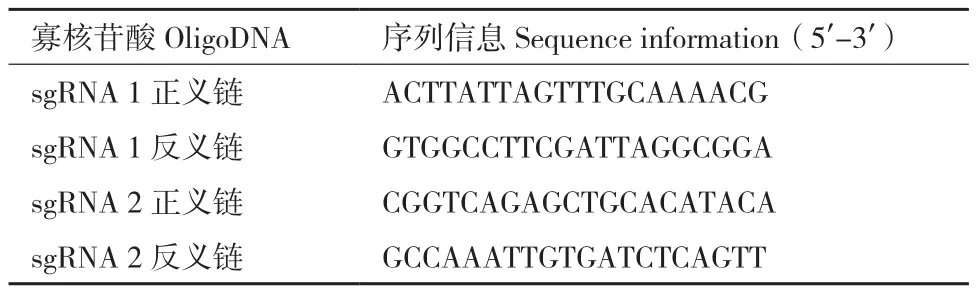
表2 寡核苷酸链序列信息Table 2 Oligonucleotide chain sequence information
将每对寡核苷酸单链以程序降温的方式退火成双链。pX-T7-sgRNA质粒经BbsI 酶切后使其线性化,回收后分别与2对寡核苷酸双链进行连接、转化感受态大肠杆菌;挑选带有抗性的单克隆大肠杆菌感受态菌落提取质粒DNA,进行测序鉴定,保存正确的阳性克隆。
1.2.2 sgRNA和Cas9表达载体的体外转录 sgRNA的表达载体pX-T7-sgRNA 经酶切线性化后,按照HiScribe T7 High Yield RNA Synthesis Kit 试剂盒说明书进行体外转录;Cas9表达载体经XbaI酶切线性化后,按照mMESSAGE mMACHINE T7 Ultra Transcription Kit 试剂盒说明书进行体外转录。
1.2.3 阳性小鼠品系获得及鉴定 将Cas9 mRNA和sgRNA混合物通过显微注射到C57BL/6野生型小鼠(WT小鼠)的受精卵中,并将注射后受精卵移植到假孕雌鼠子宫中,获得F0代小鼠,PCR方法鉴定F0代小鼠的基因型。F8基因敲除F1代杂合子小鼠(F8-/+)由F0代阳性小鼠与C57BL/6小鼠交配获得,鉴定引物对P1/P2序列信息见表3,PCR条件为 :94℃/3 min ;35 个循环的 98℃/15 s,60℃/15 s,68℃/1 min;68℃/5 min。F2代F8基因敲除纯合子小鼠F8-/-由F1代杂合子小鼠自交获得,基因型鉴定策略同F1代小鼠。

表3 引物序列信息Table 3 Primer sequence information
1.2.4 F8-/-小鼠表型检测
1.2.4.1 实验动物处理 随机选择5 只8周龄F8-/-雄鼠及其同窝野生型(WT)雄鼠,异氟烷麻醉后心脏采血,用3.8%柠檬酸钠作为抗凝剂,按9 份血和1 份抗凝剂的比例立即充分混匀,离心取血浆用于后续APTT、FIB及ELISA实验,然后分别取心、肝、脾、肺和肾用于后续实验。
1.2.4.2 逆转录PCR(reverse transcription polymerase chain reaction,RT-PCR)检测 按照Trizol试剂说明书,分离组织心、肝、脾、肺、肾并抽提总RNA,按照2 μg总量进行定量,随后使用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix进行RNA逆转录,以β-Actin作为内参,采用RT-PCR对F8基因在F8-/-小鼠及WT小鼠中各组织的mRNA表达情况进行测定。反应条件为:95℃/5 min;32个循环的 95℃/30 s,60℃/35 s,72℃/30 s;72℃/5 min。引物信息见表4
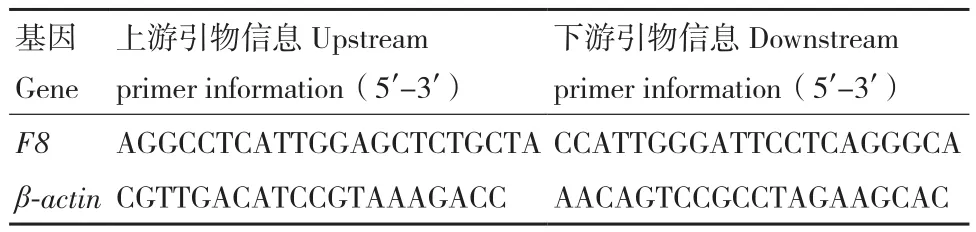
表4 逆转录PCR引物序列Table 4 Reverse transcription PCR primer sequences
1.2.4.3 酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA) 按照 Mouse Factor Ⅷ ELISAKit说明书进行酶联免疫吸附测定,检测小鼠血浆中F8的含量。简述如下:ELISA检测板室温平衡;用样品稀释液梯度稀释标准品及血清样品;随后每个孔依次加入等体积标准品及血清样品,37℃孵育90 min;不清洗,每个孔立即加入生物素标记抗体检测工作液,37℃孵育60 min;洗涤液清洗后每个孔加入辣根过氧化物酶(horseadish peroxidase,HRP)偶联工作液,37℃孵育30 min;洗涤液清洗后每个孔加入底物测试液后至加样孔变为蓝色,加入终止液终止,30 min内于450 nm波长下读取吸光值,记录数据并分析。
1.2.4.4 小鼠凝血功能检测 对F8-/-小鼠与WT小鼠进行眼内静脉窦采血取血浆,24 h后按照人凝血因子Ⅷ说明书所需因子Ⅷ(IU)=0.5×小鼠体重(kg)×60%(所需提升的因子Ⅷ活性水平的百分比,按正常值的%计)计算给药剂量,对小鼠进行静脉注射,30 min后采血取血浆,按照1.2.4.5-1.2.4.7方法进行后续凝血功能检测。
1.2.4.5 活化部分凝血活酶时间检测(activated partial thromboplastin time,APTT) 按照活化部分凝血酶时间测定试剂盒说明书检测小鼠血浆中的APTT。简述如下:APTT试剂和0.025 mol/L氯化钙,分别预温37℃并充分混匀;在37℃预热待测血浆2 min,加入等体积APTT试剂到血浆中,开始计时;37℃预热5 min;加入等体积0.025 mol/L氯化钙,记录凝固形成时间(s)并分析。
1.2.4.6 纤维蛋白原含量检测(fibrinogen,FIB) 按照纤维蛋白原测定试剂盒说明书检测小鼠血浆中的FIB含量。简述如下:梯度标准品稀释后预温2 min,加入室温下的凝血酶试剂到37℃预温的样本中并记录测定的凝固时间,绘制双对数定标标准曲线;用咪唑盐缓冲液(imidazole buffer solution,IBS)按1/10 倍稀释小鼠血浆,加入凝血酶试剂记录凝固时间,从上述标准曲线中找到相应纤维蛋白原的含量。
1.2.4.7 滴血实验 将小鼠尾巴固定,剪下尾巴末端处2 mm,血液滴于滤纸上,记录60 s内形成的血斑大小,采用Image J软件分析血斑灰度值。
1.2.4.8 统计方法 所有数据均以Mean ± SEM表示。数据分析和绘图使用Graphpad8.0软件,数据组间比较采用t值检验,当P<0.05时,认为差异具有统计学意义。
2 结果
2.1 F8 -/-小鼠的制备
图1所示为F8-/-小鼠构建策略。将体外转录的方式获得Cas9 mRNA和sgRNA通过显微注射到C57BL/6小鼠的受精卵中,共注射了150 枚受精卵。将注射后的受精卵移植到5只假孕母鼠中,出生20只小鼠(出生率为13.3%),即为F0代小鼠。F0代小鼠基因型鉴定策略图如图2-a所示。经PCR鉴定及PCR产物测序确认,共获得16只F0代阳性小鼠(阳性率为80%),其中雄鼠6只,雌鼠10只。F0代阳性小鼠与野生型C57BL/6小鼠交配获得F1代敲除杂合子小鼠;F1代敲除杂合子小鼠自交获得F2代敲除小鼠,经PCR鉴定加产物测序确定获得纯合子小鼠(F8-/-小鼠)。经测序确认,获得的F8基因敲除小鼠缺失207 293个碱基对。敲除后的具体序列信息如表5所示。基因型鉴定代表图如图2-b和2-c所示。

表5 WT小鼠和F8-/-敲除小鼠的序列信息Table 5 Sequence information of wild type and F8-/-mice genotype
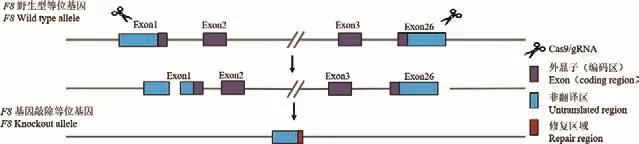
图1 F8 -/-小鼠基因敲除策略Fig.1 Knockout strategy of F8 -/- mice
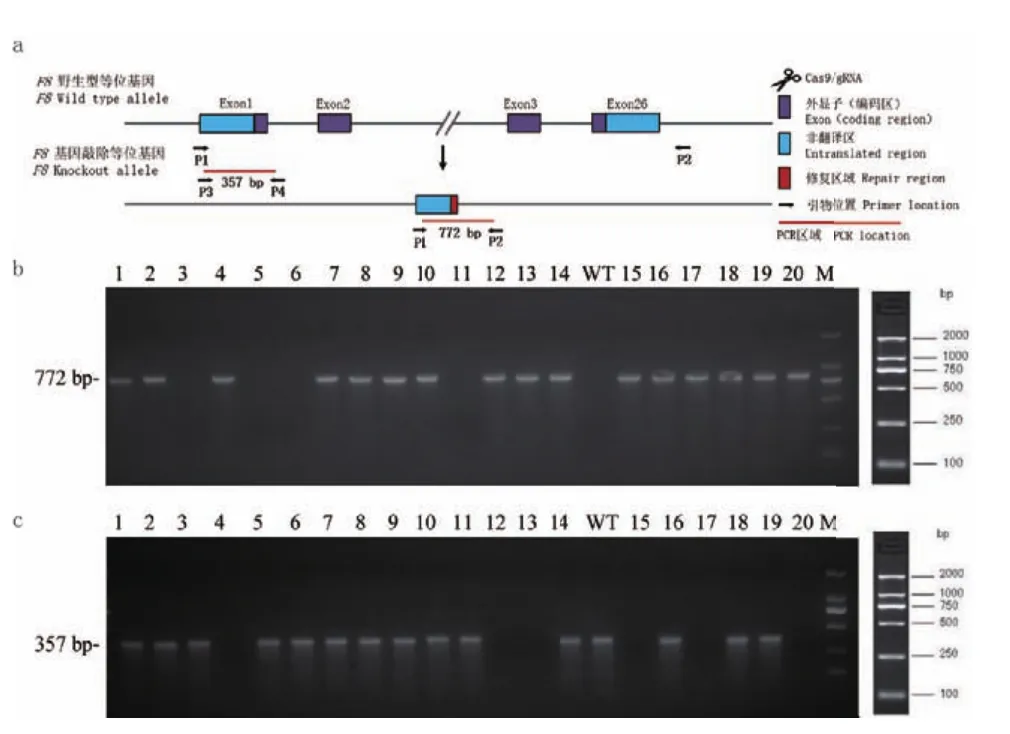
图2 F8-/-基因敲除小鼠基因型鉴定结果Fig.2 Genotype results of F8-/- gene knockout mice
2.2 F8 -/-小鼠mRNA水平验证
RT-PCR实验在RNA水平上检测F8-/-小鼠各个主要组织中F8基因的敲除效果。RT-PCR结果如图3所示:WT小鼠F8在心、肝、脾、肺、肾中均有不同水平表达(图3-a);F8-/-小鼠的心、肝、脾、肺和肾组织中均未能检测到F8 mRNA 的信号,F8基因在F8-/-小鼠中表达水平显著低于WT小鼠(****P<0.000 1)(图3-b);对肝组织RT-PCR结果进核酸电泳鉴定分析,与WT小鼠相比,F8-/-小鼠在核酸电泳中无明显电泳条带(图3-c)。
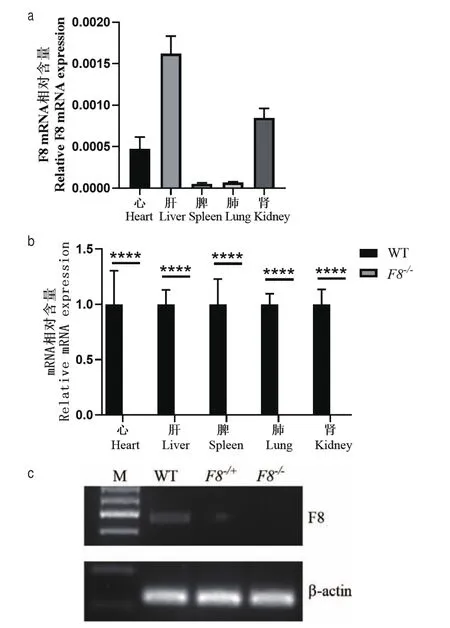
图3 F8 -/-小鼠F8 mRNA 相对表达水平Fig.3 Analysis of relative mRNA expression in F8-/- mice
2.3 F8 -/-小鼠蛋白水平验证
ELISA实验检测小鼠血浆中的F8蛋白表达情况,结果如图4所示:5 只WT小鼠血浆中F8蛋白平均表达量为(3.10±1.62)ng/mL,5 只F8-/-小鼠中有4 只已检测不到F8蛋白表达值,另外1 只F8-/-小鼠F8蛋白表达值为0.072 2 ng/mL,F8-/-小鼠F8蛋白表达均值显著低于WT小鼠(**P<0.01)。

图4 F8-/-小鼠F8蛋白相对表达水平Fig.4 Relative expression of F8 protein in F8-/- mice
2.4 F8 -/-小鼠凝血功能测定
FIB实验测定小鼠血浆中纤维蛋白原的浓度。F8-/-小鼠的FIB结果如图5-B所示:F8-/-小鼠FIB均值为(126±23)mg/dL,WT小鼠FIB均 值为(220±80)mg/dL,F8-/-小鼠的FIB浓度比WT小鼠显著降低(*P <0.05)。
APTT实验测定小鼠血浆的凝固时间。如图5-A所示,按照F8恢复到正常值的60%人凝血因子FⅧ计算给药剂量并对小鼠进行尾静脉注射,30 min后眼内静脉窦采血进行凝血检测。F8-/-小鼠的APTT结果如图5-C所示:尾静脉注射给予人凝血因子Ⅷ治疗前,F8-/-小鼠APTT均值为(63.0±8.5)s,WT小鼠APTT均值为(25.3±2.5)s,F8-/-小鼠血浆凝固时间比WT小鼠显著延长(****P<0.000 1),说明F8-/-小鼠的凝血功能存在严重障碍;给予人凝血因子Ⅷ治疗后,F8-/-小鼠的APTT值恢复到WT小鼠水平。
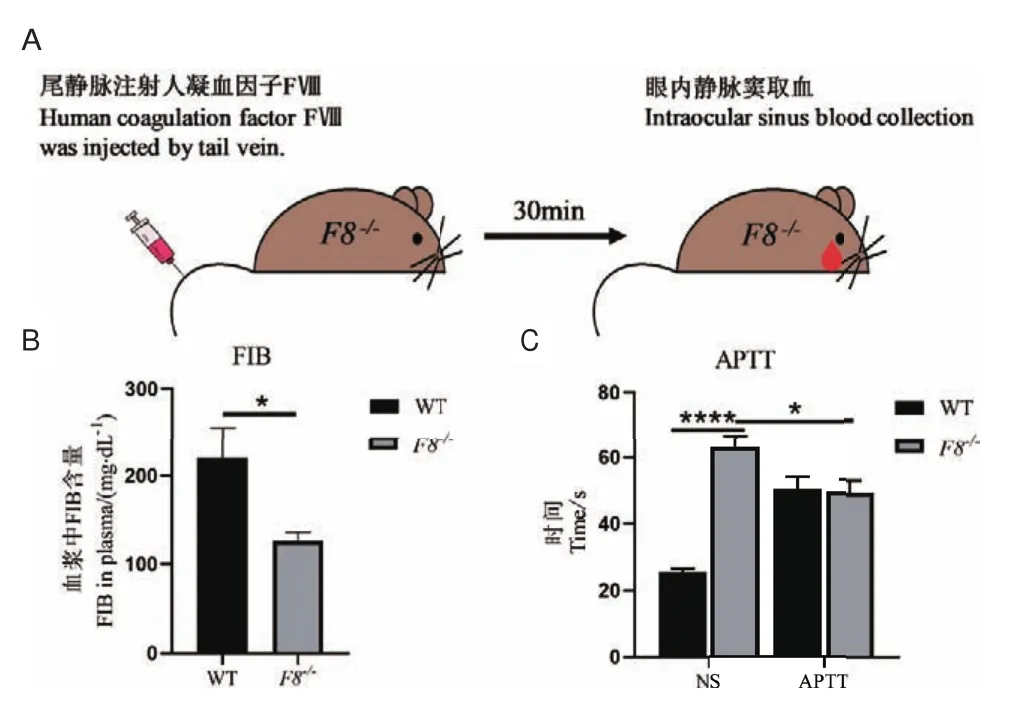
图5 F8 -/-小鼠的APTTFig.5 APTT results of F8-/- mice
滴血实验测定小鼠注射凝血因子Ⅷ后的出血情况。血斑图结果见图6,统计结果如图7所示:F8-/-小鼠注射生理盐水灰度均值为26 309±1 333,注射凝血因子Ⅷ后均值为40 713±9 005,F8-/-小鼠注射凝血因子Ⅷ后出血量显著降低(**P<0.01)。

图6 F8-/-小鼠滴血实验Fig.6 F8 -/- mice blood drop test
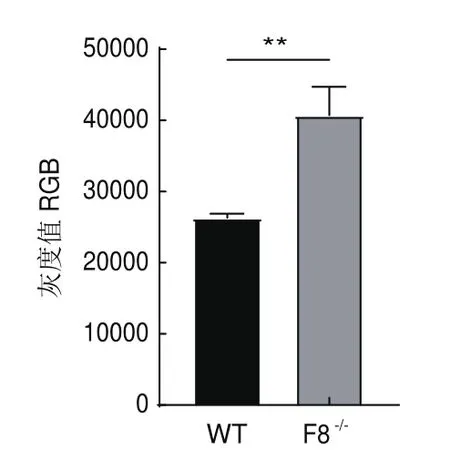
图7 F8 -/-小鼠的血斑灰度值Fig.7 Gray value of blood spot of F8-/- mice
3 讨论
1992年Martin Hooper等[12]通过小鼠胚胎干细胞(embryonic stem cell,ES)基因打靶技术,成功获得了血友病A小鼠模型;1997年研究人员采用基因敲除方法将小鼠F9(coagulation factor Ⅸ,FⅨ)基因敲除,成功建立了血友病B小鼠模型[13]。血友病小鼠模型的成功构建在对于血友病的研究和药物研发发挥了重要作用。
以往构建基因缺陷小鼠模型的方法是在小鼠的受精卵中显微注射F8大片段敲除的质粒,通过同源重组的方式来获得基因敲除小鼠,从而获得血友病模型[14-16]。但该方法耗时周期长,敲除效率不高。本文采用CRISPR/Cas9介导的非同源重组(nonhomologous end joining,NHEJ)基因敲除技术[17-18],其效率比传统同源重组系统高4-6倍以上[19],能够高效的将特异性靶位点的DNA双链打断,通过NHEJ修复方式,在断裂处随机引入碱基的缺失或插入,基因产生移码突变[20]。
我们利用CRISPR/Cas9系统,将F8基因1-26号外显子(exon1-26)区域进行有效敲除,使该编码区域207 293 bp的基因序列缺失,造成F8基因蛋白读码框移码,功能缺失,成功构建了F8基因全身性敲除小鼠模型,并省略了传统基因敲除方法中胚胎干细胞打靶的步骤[15],同时该品系后续繁育保种过程中具有遗传稳定性的特点,证明我们的设计方案是一个高效快速获得 F8基因敲除小鼠的方法。
对小鼠进行F8基因表达水平检测,其结果表明:RT-PCR检测证实F8-/-小鼠心、肝、脾、肺和肾中几乎检测不到F8 mRNA表达,证明F8基因在mRNA 水平实现了敲除;ELISA实验检测证实,F8-/-小鼠血浆中仅能检测到试剂本底水平F8蛋白的表达,证实F8基因在蛋白水平实现敲除;对小鼠F8基因进行表型验证,APTT实验中F8-/-小鼠血浆凝固时间显著高于WT小鼠,给予人凝血因子Ⅷ后,F8-/-小鼠血浆凝固时间可恢复到正常水平,断尾后形成的血斑灰度均值显著低于给药前,同时F8-/-小鼠血浆中FIB的含量显著低于WT小鼠,F8-/-小鼠出现明显凝血功能障碍表型。这些数据表明我们已成功构建F8基因敲除小鼠品系。
综上所述,本研究利用CRISPR/Cas9技术成功建立了F8基因敲除小鼠品系,在mRNA和蛋白水平以及凝血功能表型检测方面对该基因的敲除效果进行了验证,为F8基因功能研究提供了新的研究模型,也为血友病A的治疗提供了新型药物测试疾病动物模型。
4 结论
本研究基于CRISPR/Cas9技术成功建立了F8基因敲除小鼠模型,并进行了初步的表型研究,为血友病A的研究提供了新的小鼠模型。

