TMED10在胶质瘤发生发展中的作用及表达情况
王志浩,刘浩昂,兰 凯,廉 婷,张旭东
(1.西安医学院临床医学院中尼友好拉吉姆医学实验室,陕西 西安 710021;2.西安医学院临床医学院陕西省呼吸病预防与诊治工程中心,陕西 西安 710021)
胶质瘤(glioma)占成人原发恶性脑肿瘤的75%,是人类最常见的原发性中枢神经系统恶性肿瘤[1]。目前认为胶质瘤源自神经胶质干细胞或祖细胞,根据恶性程度不同,国际上将其分为WHOⅠ、Ⅱ、Ⅲ、Ⅳ级[2]。据相关研究统计,高级别的胶质母细胞瘤(GBM,WHOⅣ级)因生长迅速、侵袭性强、发病率、致死致残率高,其患者中位总生存期(OS)仅14.4个月,且5年生存率不足10%[3]。目前临床上胶质瘤的治疗主要为手术大范围切除、放化疗、基因靶向治疗、免疫治疗及电场疗法等,但其治疗效果不佳[4,5]。因此,研究胶质瘤的发生发展机制对胶质瘤患者的早期干预及寻找治疗新方法十分重要。10跨膜P24贩运蛋白10(transmembrane P24 trafficking protein,TMED10)又称TMP21,是一种定位于内质网-高尔基体中间体(ERGIC)上的参与蛋白转运的膜蛋白。近年来我国学者研究发现,TMED10在非经典蛋白分泌(unconventional protein secretion,UPS)过程中发挥重要作用[6-8]。此外,有研究表明,其还与细胞增殖[9]、细胞自噬[10,11]有关。近年来有许多学者研究TMED10与阿尔兹海默症[12-14]、甲状腺癌[15]、原发性肝癌[16]、自身免疫性疾病[17]等疾病的关系及可能存在的作用机制,但TMED10在胶质瘤中的研究还很少。因此,本研究旨在分析TMED10在胶质瘤中的表达情况,为研究TMED10在胶质瘤的发生发展中的作用及寻找治疗胶质瘤的新靶点提供参考。
1 资料与方法
1.1 资料来源 研究数据来源于癌症基因组图谱(The Cancer Genome Atlas,TCGA)在线数据库(GEPIA,http://gepia.cancer-pku.cn/);中国脑胶质瘤基因组图谱数据库(Chinese Glioma Genome Atlas, CGGA, http:/www.cgga.org.cn);String数据库(https://www.string-db.org/)。
1.2 方法 使用 CGGA、GEPIA数据库分析 TMED10在胶质瘤不同临床病理条件下的差异性表达情况,检索方法:①Analyze-mRNA data;性别(Male vs Female),年龄(>42岁 vs<42岁),不同级别状态(WHOⅡvs WHOⅢ vs WHOⅣ),发展状态(原发 vs 复发);②Data type:mRNA;③ Dataset:mRNAseq_325;④Gene:TMED10;⑤临界值设定P-value<0.05。利用CGGA、GEPIA 数据库分析 TMED10 相关基因的表达与胶质瘤患者生存预后的影响,检索方法:①AnalyzemRNA data;②Survival;③Dataset:mRNAseq_325;④Gene:TMED10。通过 String数据库对TMED10表达蛋白相互作用网络进行分析。检索方法:①Proteinname:TMED10;②Organism:Homo sapiens,并利用Kaplan-Meier、Kruskal-Wallis 进行统计学分析。
2 结果
2.1 TMED10在胶质瘤组织和正常对照组织中的表达比较 基于GEPIA数据库过表达基因筛查发现TMED10在胶质瘤中的表达高于正常组织(P=2.66E-98),见图1、图2。
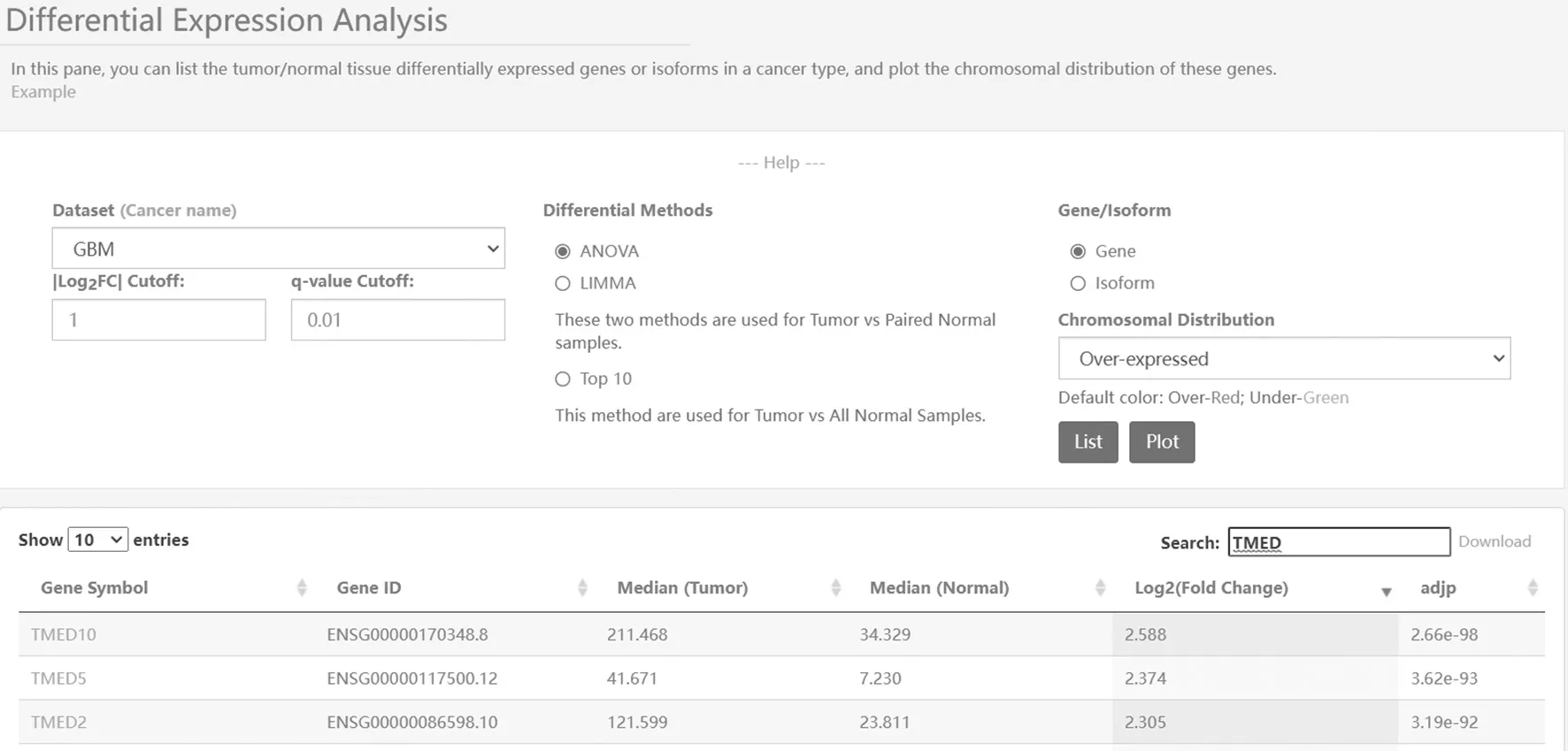
图1 胶质瘤中TMED10的差异性分析
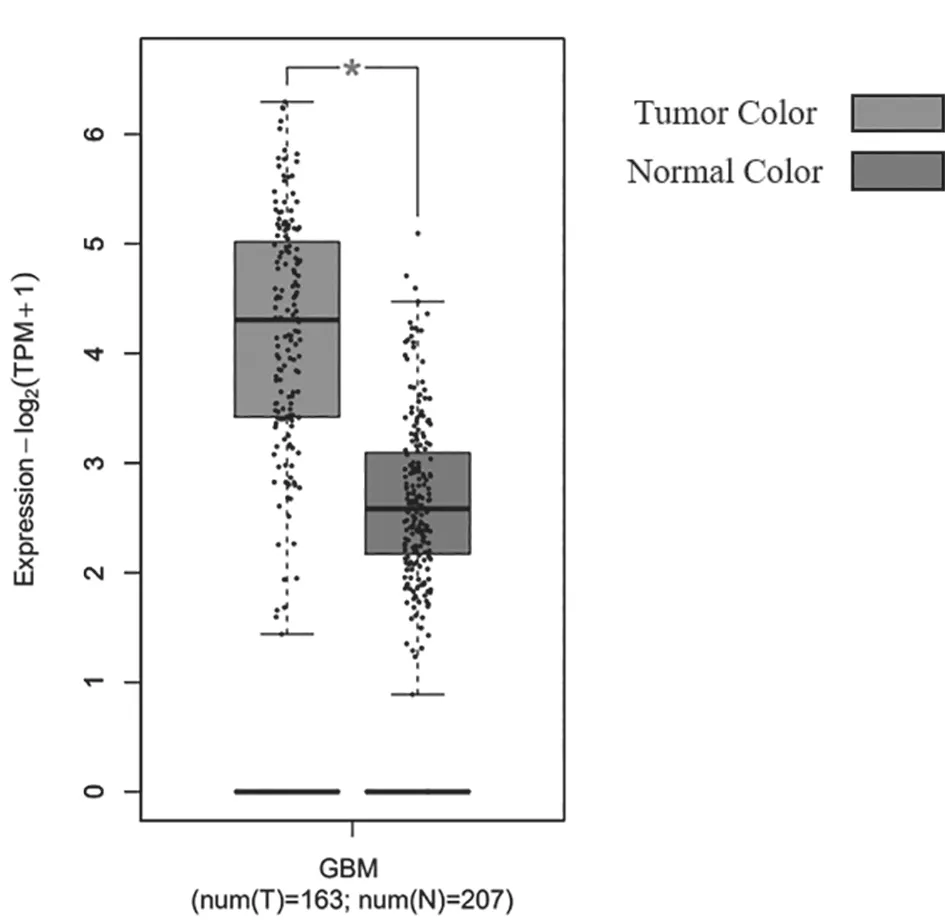
图2 TMED10在胶质瘤组织和正常对照组织中的表达
2.2 TMED10在不同胶质瘤亚型中的表达比较TMED10在高级别的原发性胶质瘤和复发性胶质瘤组织中呈较高表达(P=1.1e-07),见图3。
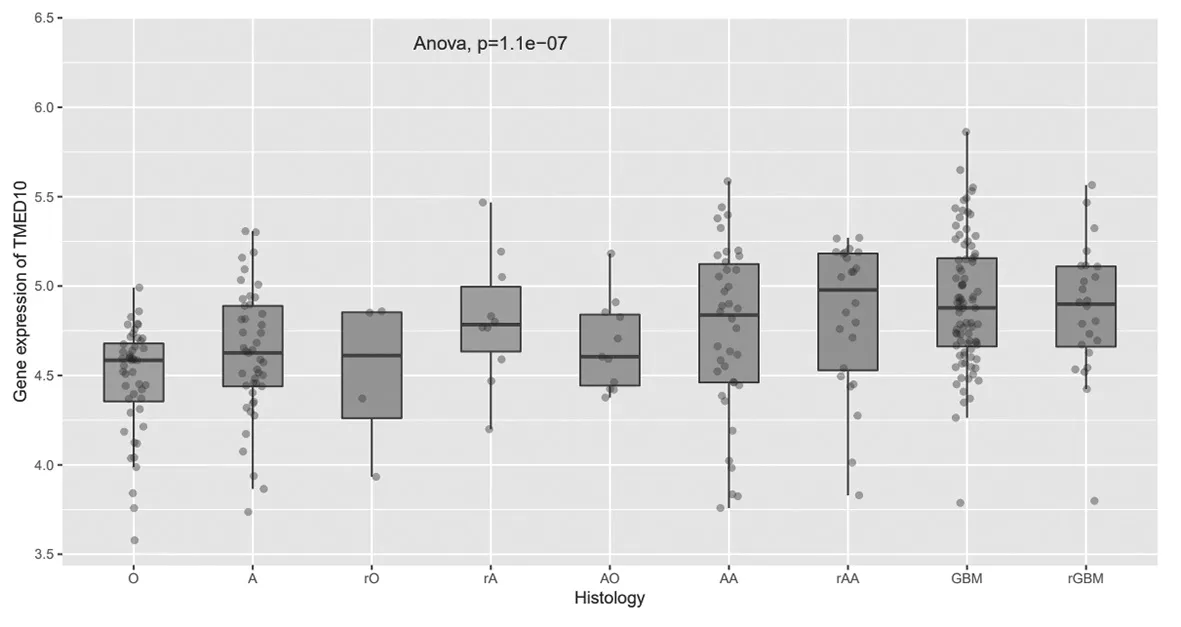
图3 TMED10在不同类型胶质瘤中的表达情况
2.3 TMED10在不同性别胶质瘤组织中的表达比较不同性别胶质瘤患者中TMED10的表达比较,差异无统计学意义(P=0.083),见图4。
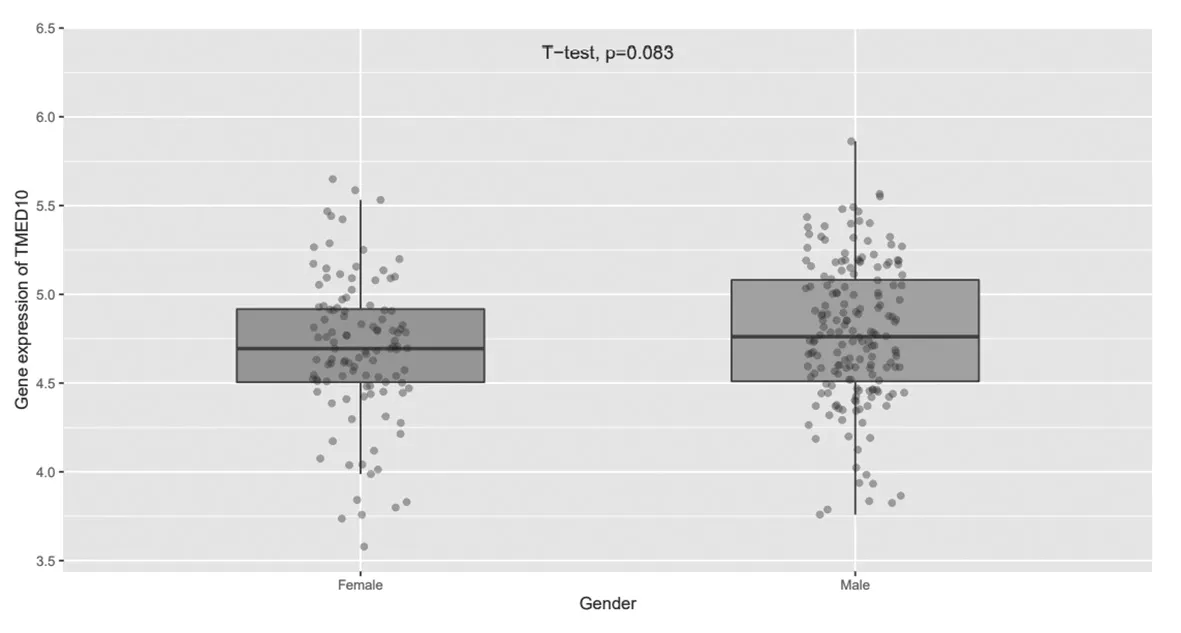
图4 MED10在不同性别胶质瘤组织中的表达
2.4 TMED10在不同年龄胶质瘤组织中的表达比较TMED10在42岁以上与42岁以下胶质瘤患者组织中的表达比较,差异无统计学意义(P=0.2),见图5。
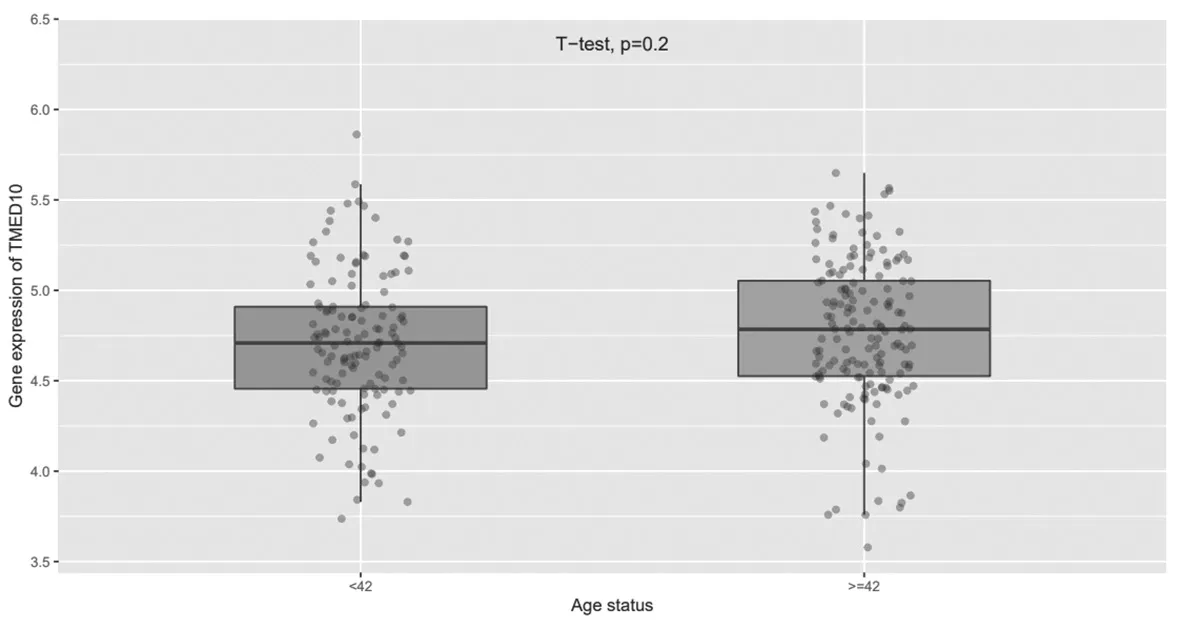
图5 TMED10在不同年龄胶质瘤组织中的表达
2.5 TMED10在不同级别胶质瘤组织中的表达比较TMED10与胶质瘤的发生发展呈正相关;不同级别的胶质瘤TMED10表达比较,差异有统计学意义(P=7e-09),见图6。
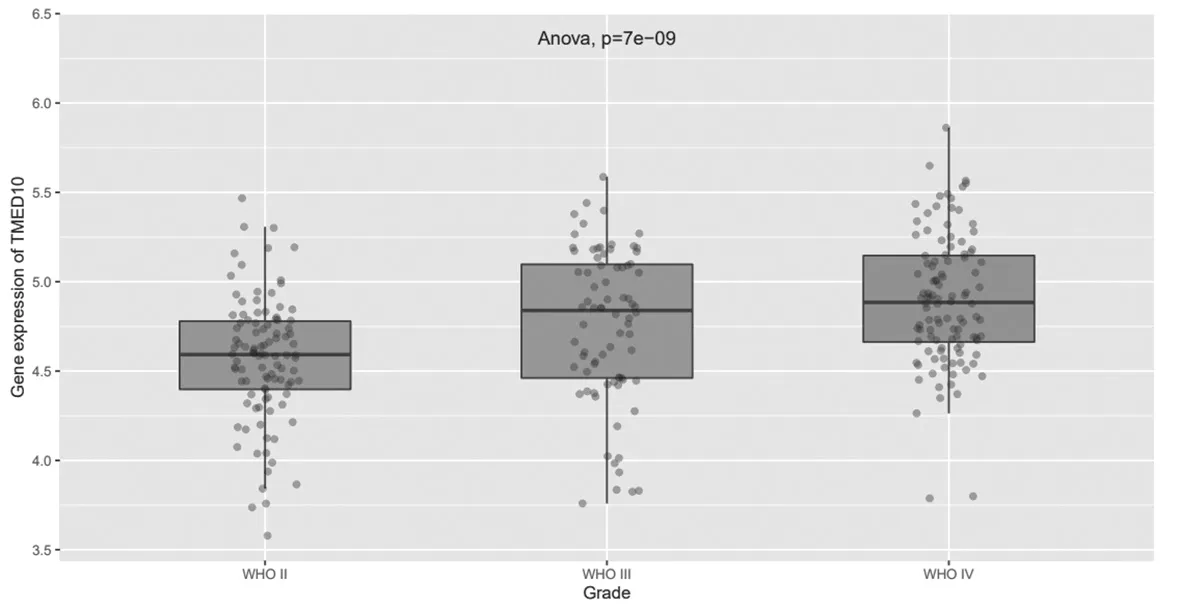
图6 TMED10在不同级别胶质瘤组织中的表达
2.6 TMED10在不同进展状况的胶质瘤组织中的表达比较 TMED10在原发性、复发性胶质瘤组织中的表达比较,差异无统计学意义(P=0.075),见图7。
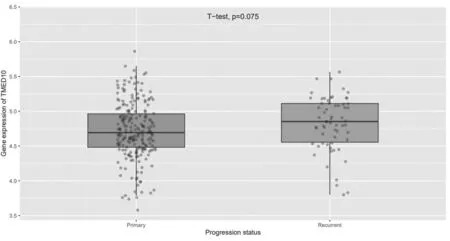
图7 TMED10在不同进展状况的胶质瘤组织中的表达
2.7 TMED10在不同年龄、性别、发病阶段的胶质瘤中的表达比较 TMED10在WHOⅡ、Ⅲ、Ⅳ级胶质瘤中的表达比较,差异无统计学意义(P>0.05);在WHO Ⅳ级男性胶质瘤患者中TMED10的表达高于女性(P=0.027),TMED10在原发型、复发性胶质瘤患者组织中表达比较,差异无统计学意义(P>0.05),见图8~图10。
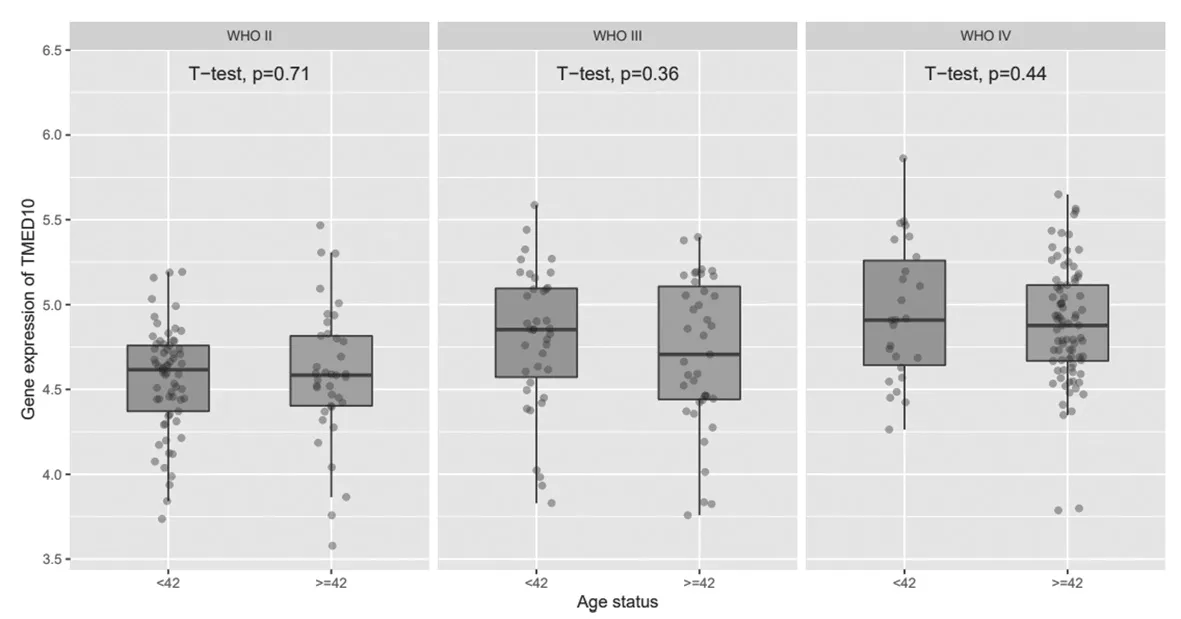
图8 TMED10在不同年龄阶段的胶质瘤中的表达
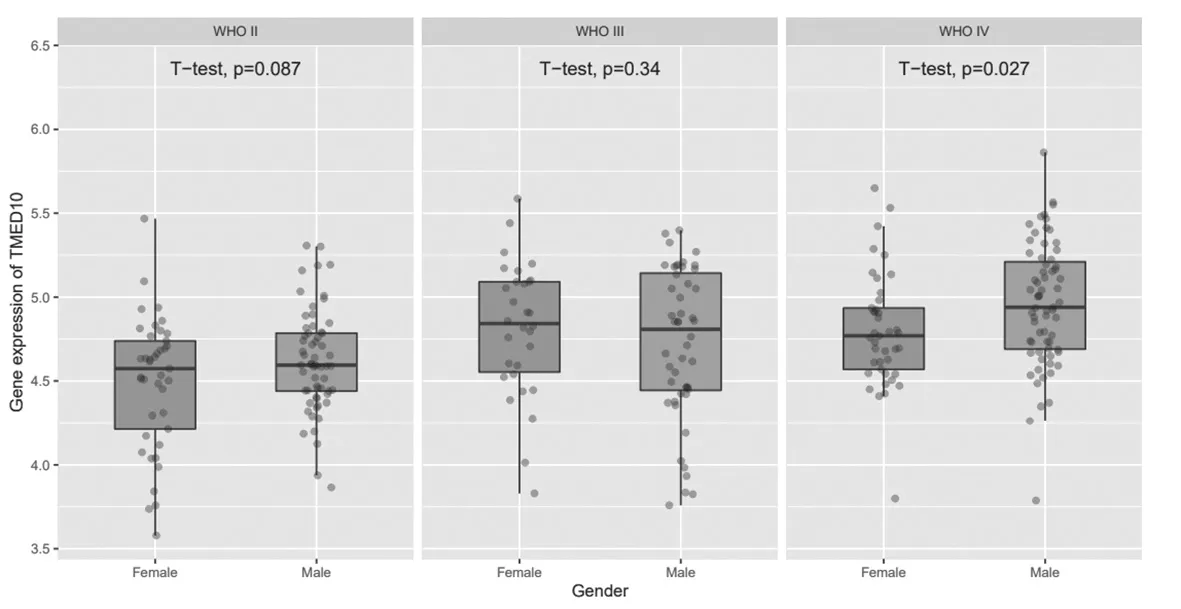
图9 TMED10在不同性别胶质瘤中的表达
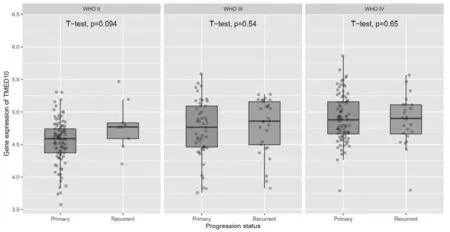
图10 TMED10在不同发病阶段胶质瘤中的表达
2.8 TMED10的表达与患者生存率的相关性 TMED10在原发性、复发性胶质瘤中的表达与患者生存率呈负相关(P<0.0001;P=0.0081),见图11。
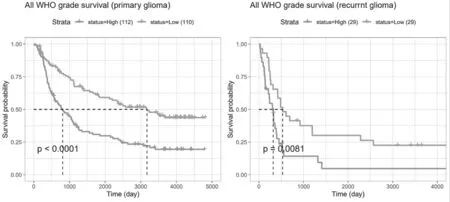
图11 TMED10的表达与患者生存率及生存时间的关系
2.9 TMED10表达蛋白相关作用网络分析 TMED10与TMED2、NCSTN、APH1A等多个蛋白有相互作用,见图12。
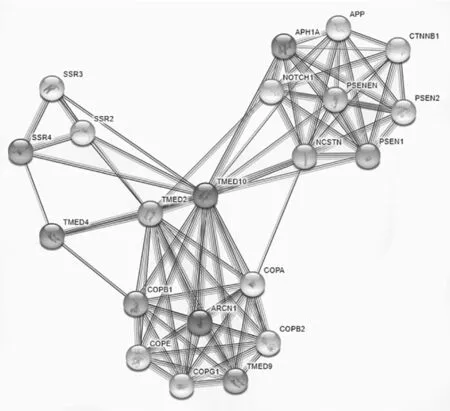
图12 TMED10表达蛋白相关作用网络分析
3 讨论
目前,TMED10作为一种介导UPS的分子备受关注。越来越多的研究证明TMED10调控细胞增殖、自噬,并且与神经退行性疾病、自身免疫性疾病及癌症发生发展有关。研究发现,无信号肽蛋白(leaderless cargo)在胞质中HSP90A蛋白的帮助下去折叠后,必须与TMED10相互作用并使其发生寡聚化形成蛋白通道才能进入ERGIC内并通过囊泡包裹分泌到细胞外[6,7]。同时,还有研究发现TMED10是自噬调节分子,抑制TMED10的表达会严重影响甲状腺癌的生长,可能是通过激活AMPK/mTOR通路诱导自噬来调节癌细胞的生长[15]。研究发现[16],TMED10在原发性肝细胞癌(HCC)中呈现高表达状态,联合使用SiTmed10、SiTMBIM4、SiDtd2(D-tyrosyl-tRNA deacylase 2)可以显著促进肝癌细胞系Huh7、HepG2凋亡,而正常肝细胞系THLE-2几乎不受影响,这一结果表明TMED10的小分子抑制剂可能是肝癌治疗的新靶点。最新的研究发现[17,18],TMED10能阻碍TGF-βⅠ型(ALK5)和 Ⅱ型受体(TβRⅡ)复合物的形成,从而抑制TGF-β信号通路,进而抑制TGF-β介导的生长抑制现象。还有研究报道[19],巨细胞病毒免疫逃逸素m152/gp40可以通过TMED10锚定在宿主细胞的内质网上进而产生免疫逃逸现象。这些发现提示TMED10在胶质瘤发生发展中可能发挥重要的作用,然而TMED10在胶质瘤中的作用目前仍不明确。
本研究基于GEPIA、CGGA数据库分析发现,TMED10在胶质瘤组织中表达高于正常对照组织(P=2.66E-98);在不同级别的胶质瘤中,TMED10的表达量比较,差异有统计学意义(P=7e-09);同时TMED10在原发性、复发性胶质瘤组织中的表达与患者生存期呈负相关(P<0.0001;P=0.0081)。表明TMED10在胶质瘤的发生发展过程中具有促进作用,可能是TMED10通过调控内质网应激过程,促进胶质瘤细胞的恶性增殖。最后通过String数据库分析发现TMED10有TMED2、NCSTN、APH1A等多个相互作用蛋白,可为后续的进一步研究提供相关依据。
综上所述,TMED10在胶质瘤组织中呈高表达状态,且与患者的生存率密切相关;并且TMED10在细胞自噬、增殖、疾病的发生发展等方面的重要作用。因此,TMED10可能成为治疗胶质瘤的潜在靶点。

