依赖于豆粕原材料的纳豆激酶制备和纯化工艺研究
吴丹,杨苗苗,杜小平,祁蒙,杨水云
(1.陕西学前师范学院 生命科学与食品工程学院,西安 710100;2.安康市富硒产品研发中心,陕西 安康 725000;3.西安交通大学 生命科学与技术学院,西安 710049)
纳豆激酶(NK)是纳豆中最具开发价值的成分,该酶为枯草蛋白酶类第一个具有纤溶作用的酶,可以应用于临床的溶栓治疗过程中[1]。纳豆激酶是一种由纳豆芽孢杆菌发酵产生的碱性胞外丝氨酸蛋白酶,具有良好的溶栓作用[2],可有效预防或治疗心脑血管疾病[3-4]。该酶与目前溶栓药物如尿激酶(urokinase,UK)和链激酶(streptokinase,SK)相比,具有pH广[5]、温度耐受性强及溶栓特异性等优点[6—7]。
Chandrasekaran等[8]发酵生产的NK可溶解94%的人工血栓;Janh等[9]研究表明NK在小鼠体内有一定的溶栓效果;Hsia等[10]和Yuko等[11]研究证实口服NK后,NK在体内有良好的溶栓效果。NK的优势在于其对纤维蛋白,尤其是对交联的纤维蛋白特别敏感,可直接作用于血栓中的纤维蛋白,将其溶解为小肽和氨基酸[12—13]。这一特性使得NK更偏好溶解血栓中的纤维蛋白而不易溶解血浆纤维蛋白原,因而不会破坏正常凝血机制而引发出血,且目前临床现用的溶栓剂无此特点,但目前NK产品纯度较低,因此,提高NK纯度意义重大。
工业上生产NK都是从纳豆杆菌的发酵液中提取纯化的。报道的NK纯化方案,常集多种手段联合使用。但在总结前人纯化结果后发现[14—19],使用柱层析法,NK的酶活回收率普遍不高,不仅如此,柱层析法也具有成本高、方法繁琐、步骤较多、耗时且难以规模化生产的缺点[20]。超滤法可以有效地去除料液中相对分子质量较大和较小的组分,避免了盐析方法中高渗作用所造成的酶活性降低,但纯化倍数很低。利用亲和吸附法对NK纯化,例如用大豆颗粒对NK进行特异性吸附,吸附的配体结构不清楚[21],操作较为复杂,不适合工业化生产。
在纳豆杆菌发酵豆类制作的纳豆表面,可以看见很长的拉丝状黏液。在纳豆杆菌发酵黄豆粉产生NK的液体发酵中,也总是伴随着大量黏液的产生,其产量远远大于NK,现已研究清楚,该黏液的主要成分为γ-聚谷氨酸(γ-polyglutamic acid,γ-pGA)[22—25],分子量为100~1 000 kDa,等电点为2.5,属于典型的酸性高聚物,而NK的分子量仅为27.7 kDa,等电点为8.7。在pH 7.0~7.5的发酵液中,NK带正电而γ-pGA带负电,二者通过静电力以“偶联状态”结合,形成以大分子量的γ-pGA为载体的多分子纳豆激酶联合物,从而大大降低了NK的表观活性[26]。目前,基于以上工艺的NK产品无法实现微剂量服用目标,更不能满足注射针剂的要求,因此要获得高纯度的NK,需要将大量γ-pGA从粗产品中去除。
本研究在建立可行的液体发酵法生产NK工艺的基础上,提出了从发酵液纯化NK的下游方案,该方案大幅度提高了NK的纯度。
1 材料与方法
1.1 材料
1.1.1 菌株和供试样品
纳豆芽孢杆菌N5:西安交通大学生命学院基础实验室分离纯化所得;供试样品为市售的脱脂豆粕及黄豆。
1.1.2 试剂及培养基
试剂:纤维蛋白原、凝血酶、尿激酶和γ-聚谷氨酸,购自上海源叶生物科技有限公司;琼脂糖,购自Amresco公司;十六烷基三甲基溴化铵,购自Alfa Aesar公司;BCA蛋白定量试剂盒,购自碧云天生物技术。其余化学试剂均为国产分析纯。
LB培养基:用于菌种的活化及种子液的配制。1%胰蛋白胨,0.5%酵母提取物,1% NaCl。
天然发酵培养基:用于纳豆激酶的发酵。3%脱脂豆粕匀浆搅拌,用1 mol/L NaOH溶液调节培养基pH为7.4左右,121 ℃高压灭菌20 min。
1.1.3 主要仪器设备
THA-3560C立式灭菌锅 Tsao Hsin公司;酶标仪 Molecular Devices公司;BSA124S 电子天平 德国Sartorius公司;PYX-DHS-40X50电热恒温培养箱 广州沪瑞明仪器有限公司;LYZ-Z00B恒温摇床 上海龙跃仪器设备有限公司;Centrifuge 5810R离心机 Eppendorf公司;SW-CJ-1FD洁净工作台 苏净安泰公司;冷冻干燥机 北京博医康实验仪器公司。
1.2 实验方法
1.2.1 纳豆芽孢杆菌N5的培养及发酵方法
将纳豆芽孢杆菌N5接种于LB液体培养基中,在37 ℃条件下,在转速200 r/min的恒温摇床中振荡培养至对数期测定其吸光度,计算接种量。
3%的脱脂豆粕匀浆搅拌,用1 mol/L NaOH溶液调节培养基pH为7.4左右,121 ℃高压蒸汽灭菌20 min。冷却至室温后接种。纳豆芽孢杆菌种子液的接种量为0.05 OD/mL,恒温37 ℃,摇床转速200 r/min,发酵时间36 h。发酵完成后,发酵液于2 000 g条件下离心10 min,上清液为液体发酵的纳豆激酶溶液,利用纤维蛋白原平板法测定NK产量(Fu/g豆粕)。
1.2.2 纳豆激酶活力的测定
纳豆激酶的活力采用纤维蛋白原平板法[27]。根据样品的数量,用直径为2 mm的打孔器进行打孔。
1.2.3γ-聚谷氨酸的定量检测方法
在已有检测方法[28]的基础上进行如下改良:在350 nm的波长条件下,采用CTAB的NaOH溶液(10 g/L)检测γ-pGA。
1.2.4 纳豆激酶发酵培养基的优化
1.2.4.1 单因素条件优化
根据前期预实验结果,在确定发酵培养基中碳源为1%的甘油的基础上,以纳豆激酶的活力为指标,采用单因素实验研究豆粕、谷氨酸钠及无机盐含量对发酵结果的影响。发酵培养基的豆粕含量为1%、3%、5%、7%、9%;谷氨酸钠的质量浓度为0.5%、1%、1.5%、2%、3%;MgSO4·7H2O的质量浓度为0.1%、0.3%、0.5%、0.7%。以天然发酵培养基为对照。按0.05 OD/mL接种纳豆杆菌种子液,在37 ℃、200 r/min的条件下发酵36 h,测定纤溶圈直径,选取适宜的单因素条件。
1.2.4.2 多因素正交优化
在以上描述的各个单因素优化的基础上,根据正交表设计正交实验,优化最优碳氮源质量浓度、谷氨酸钠及硫酸镁含量等。测定并比较培养基优化前后的NK产量(Fu/mL)。
1.2.5 纳豆激酶与γ-聚谷氨酸解离及收集
在培养基中接种0.05 OD/mL的纳豆芽孢杆菌N5,37 ℃下200 r/min发酵36 h。用pH 10、10倍的Gly-NaOH缓冲液调节发酵液的pH至10,使得NK和γ-pGA均带负电,不再紧密结合。充分振荡混匀后,在2 000 g条件下离心10 min,收集上清液,沉淀用pH为10的Gly-NaOH缓冲液洗涤1次,2 000 g条件下再离心10 min,合并上清液待用。
1.2.6 不同pH值下NK产量的测定
发酵完成后,取原始发酵液1 mL,用pH为10的Gly-NaOH缓冲液调节pH至10,稀释至 2 mL,在涡旋仪上激烈振荡后,2 000 g条件下离心10 min后取上清液,采用纤维蛋白原平板法测定上清液的NK产量;以原始发酵液稀释1倍作对照。
1.2.7 十六烷基三甲基溴化铵沉淀γ-聚谷氨酸条件优化
将不同浓度的CTAB水溶液与“1.2.1”中得到的NK溶液等比例混合,用力摇匀后在1 000 g下离心10 min。收集含有NK的上清液,并分别测定上清液中残留的γ-pGA含量和NK的效价,得到去除γ-pGA的方案。
1.2.8 三相法浓缩提取纳豆激酶
采用三相法浓缩含有NK的上清液,具体参考张庆庆等[28-31]的方法进行。
1.2.9 纳豆激酶冻干粉效价测定
磁力搅拌条件下,在pH 8.7、0.05 mol/L的Tris-HCl缓冲液中,对三相法收集的中间NK相进行透析,每隔2 h换液,2~3次后,于4 ℃进行透析过夜。透析液置入培养皿中,厚度在1 cm左右,放入-80 ℃冰箱中预冻,取出后放入冷冻干燥机中干燥24 h,即为高纯NK冻干粉。取NK冻干品5 mg,溶于0.5 mL 0.05 mol/L的Gly-NaOH缓冲液中(pH 10)(NK的最适pH为9~10),充分振荡混匀后,采用纤维蛋白原平板法测定对应产品的效价。
1.2.10 计算公式
NK回收率的计算方法:回收率(%)=(离心后单位体积酶活×离心后酶溶液体积)/(离心前单位体积酶活×离心前酶溶液体积)。
NK比活力的计算方法:比活力(Fu/mg)=总活力/总蛋白。
NK纯化倍数的计算方法:纯化倍数=离心后的比活力/离心前的比活力。
2 结果与分析
2.1 尿激酶标定的纳豆激酶酶活工作曲线
采用已知的不同效价标准尿激酶溶液,测定其在人工血栓平板上形成的纤溶圈直径,纤溶酶可以使乳白色的纤维蛋白原降解为无色透明的片段和小肽,从而形成透明圈。可根据图1中纤维蛋白原平板上透明纤溶圈的大小和图2中标准曲线来表征尿激酶的纤溶活性。由图2可知,在尿激酶酶活为200~1 000 U/mL的区间内R2=0.996 6,酶活和直径的平方值有很强的线性相关性。因此,可以利用此标准曲线标定NK的酶活。
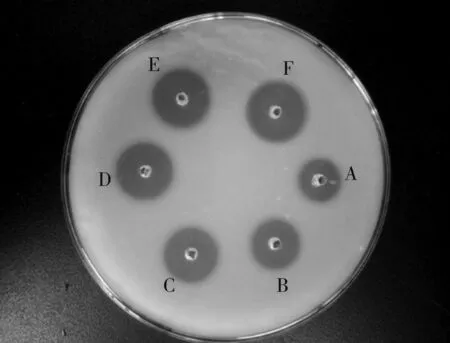
图1 标准尿激酶纤溶圈
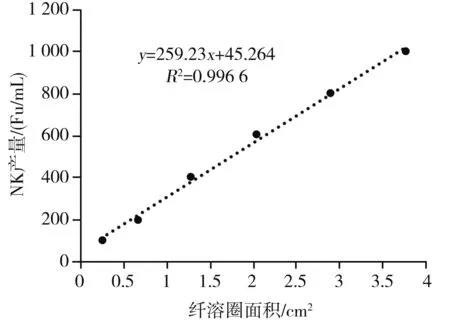
图2 尿激酶标准曲线
2.2 豆粕含量对纳豆激酶活力的影响
在天然培养基中,豆粕的含量决定了纳豆芽孢杆菌生长的营养条件。在5种豆粕粉浓度下,发酵36 h后于2 000 g条件下离心10 min,取上清液,利用纤维蛋白原平板法测定上清液NK产量,结果见图3。

图3 豆粕含量对NK产量的影响Fig.3 Effect of soybean meal content on NK yield
由图3可知,豆粕含量为1%时,NK产量为808 Fu/mL,豆粕含量为3%时,NK产量为1 009 Fu/mL,豆粕含量大于5%时,NK产量缓慢降低。可见当豆粕含量较低时,NK产量也低,原因是可供纳豆芽孢杆菌生长发酵的营养不足;当豆粕含量升高时,营养充足,NK产量缓慢降低,原因可能是豆粕浓度较大,导致溶氧量较低,不利于纳豆杆菌的生长及发酵。后续实验中选择的豆粕含量为3%。
2.3 谷氨酸钠含量对纳豆激酶活力的影响
研究报道发现添加谷氨酸钠可以提高NK的分泌[32],本研究对谷氨酸钠含量进行了优化,结果见图4。
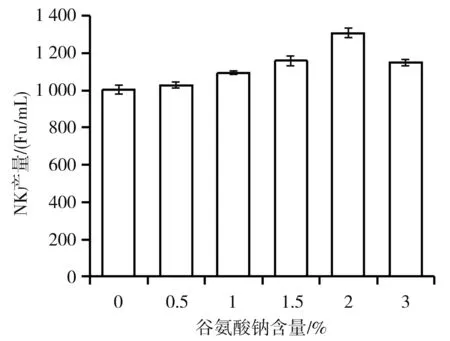
图4 谷氨酸钠含量对NK产量的影响
由图4可知,谷氨酸钠的添加可以提升NK的产量,当发酵培养基中谷氨酸钠从0.5%增加到2%时,NK的产量逐渐上升到1 309 Fu/mL;当谷氨酸钠含量超过2%时,NK的产量会降低,所以选择谷氨酸钠的最佳含量为2%。
在实验中我们还发现,随着谷氨酸钠含量的升高,发酵液会更黏稠,说明谷氨酸钠浓度越高,纳豆杆菌分泌的γ-pGA就越多,这是因为谷氨酸钠是γ-pGA分泌的前体物质[33]。由于γ-pGA和NK等电点的巨大差异,在发酵液中二者会结合在一起。NK一旦被γ-pGA结合,就变成束缚型的NK,使其表观活性下降,不利于其作用于大豆蛋白供给菌体以充足氮源。此时γ-pGA就相当于NK的“代偿陷阱”[34],致使菌体以代偿方式不断合成NK,最终提高了NK的产量。基于以上分析,实验结果表现为NK的产量与γ-pGA的含量呈正相关。所以通过添加谷氨酸钠,可提升NK产量。但当谷氨酸钠添加过量时,溶液过于黏稠,导致发酵液溶氧降低,影响了纳豆杆菌的好氧生长,生长量下降,需要的氮源下降,因而NK产量也随之降低。
2.4 Mg2+含量对NK产量的影响
Mg2+在蛋白质包括NK的合成中起着非常重要的作用,因而实验对发酵体系中Mg2+的浓度进行了优化。Mg2+对NK产量的影响的实验结果见图5。
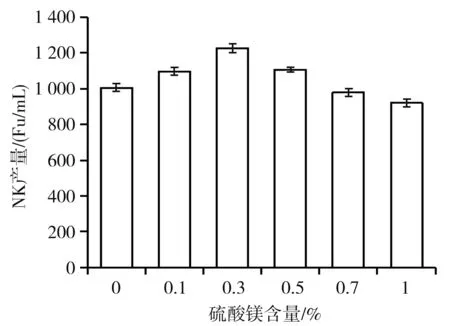
图5 MgSO4·7H2O含量对NK产量的影响
由图5可知,NK产量随着MgSO4·7H2O含量的升高出现先升高后下降的趋势,当MgSO4·7H2O含量为0.3%时,NK产量最高。
2.5 正交法优化天然培养基
根据以上单因素实验结果,研究通过多因素正交实验法优化天然培养基中甘油、谷氨酸钠和硫酸镁的含量,实验结果见表1。
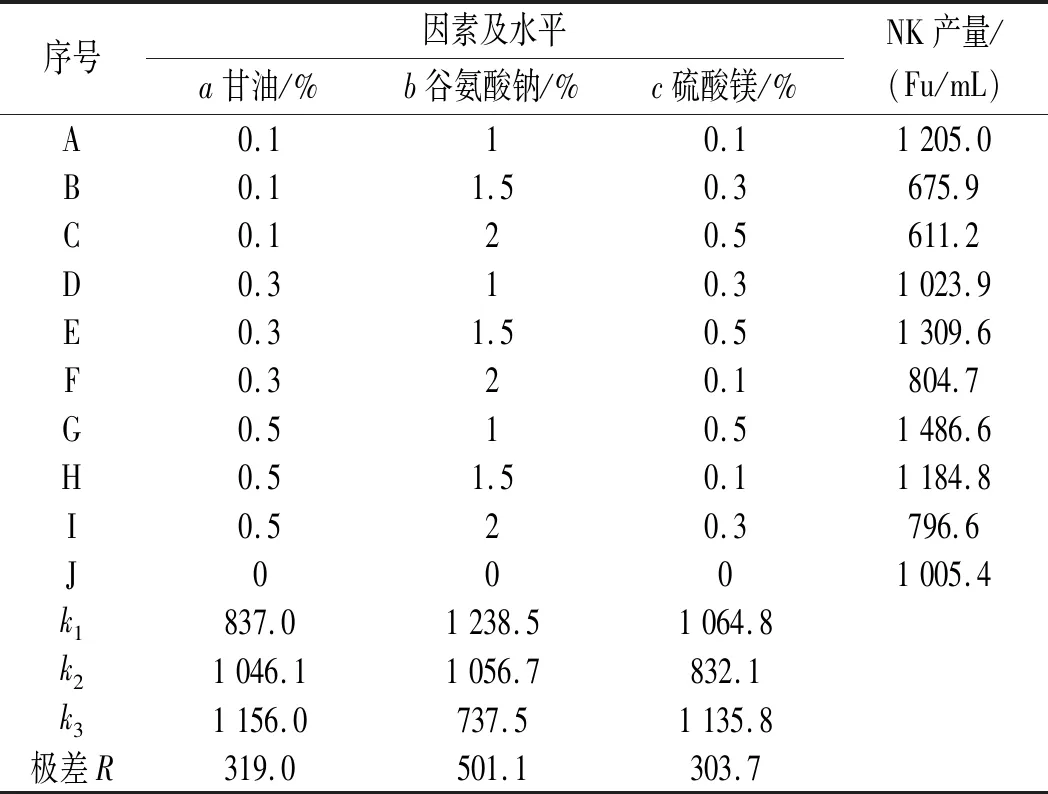
表1 不同添加物正交实验结果及分析Table 1 Results and analysis of orthogonal experiment of different additives
由表1中R值可知,在目前设计的实验条件下,谷氨酸钠对NK产量的影响最大,因此我们需进一步优化谷氨酸钠的浓度。由k值可知,降低谷氨酸钠浓度更合理。
分析各k值可知,在本实验设计条件下,最适培养基添加物为甘油0.5%、谷氨酸钠1%、MgSO4·7H2O 0.5%。在此培养基条件下重复进行NK发酵和产量测定,结果见图6。
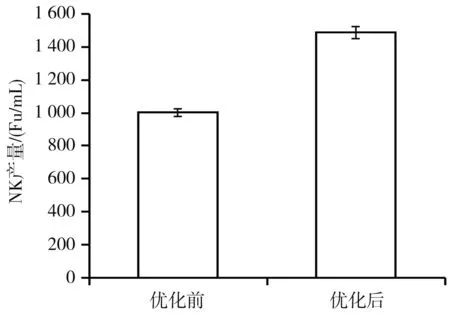
图6 培养基优化前后NK产量对比Fig.6 Comparison of NK yield before and after the optimization of medium
由图6可知,当培养基的组成为豆粕3%、甘油0.5%、谷氨酸钠1%、MgSO4·7H2O 0.5%时,NK产量为1 486.6 Fu/mL,比优化前提高了48%。在此培养基条件下重复进行NK发酵和产量测定,结果稳定,重复性良好。
2.6 不同pH下所获纳豆激酶的产量
原始发酵液(pH为7)和调节pH为10后的发酵液NK的效价测定结果见图7。

图7 pH对NK产量的影响
由图7可知,pH为7的条件下所获粗酶液中NK效价为1 526 Fu/g,调节发酵液pH为10,即大于NK的等电点时,所获NK效价为2 123 Fu/mL,提高了39%。pH为7的条件下获得的NK冻干粉效价为1.88×104Fu/g,调节pH为10后,所获NK冻干粉效价为2.55×104Fu/g,比碱法解离前提高了41%。
2.7 CTAB沉淀γ-聚谷氨酸
十六烷基三甲基溴化胺(CTAB)在水溶液中以聚阴离子形式存在,CTAB的氮原子可与γ-pGA中的羧基氧原子配对形成不溶于水的γ-pGA-CTAB络合物,反应后溶液变浑浊[28],离心沉淀可去除γ-pGA。优化CTAB的浓度,使γ-pGA的沉降量最大,且最大程度地保持NK活性稳定。CTAB浓度对γ-pGA含量的影响见图8,CTAB浓度对NK活性的影响见图9。
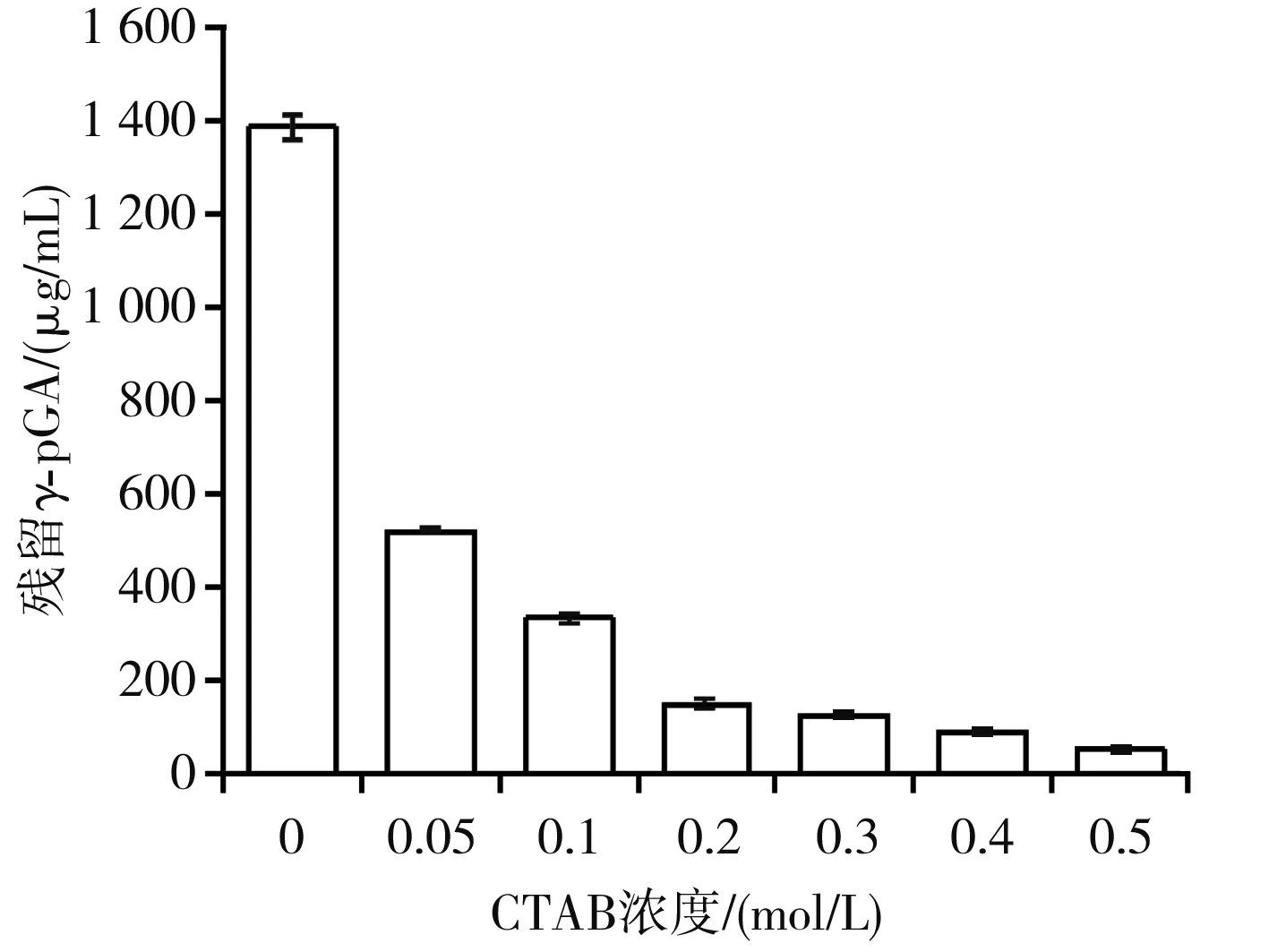
图8 CTAB浓度对残留γ-pGA含量的影响Fig.8 Effect of CTAB concentration on residual γ-pGA content
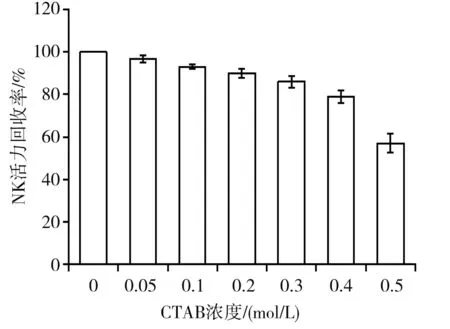
图9 CTAB浓度对NK活力的影响Fig.9 Effect of CTAB concentration on NK activity
对NK活性以及残留γ-pGA含量进行综合分析,逐渐提高CTAB浓度,上清液中γ-pGA的残留量变化不大,但是NK的纤溶活性逐步降低。结合实验结果及成本考虑,选择最佳沉降的CTAB浓度为0.2 mol/L。
2.8 三相法浓缩提取纳豆激酶效果
固定叔丁醇 ∶料液(体积比)为1∶1,且保证叔丁醇的高度大于0.5 cm,通过改变容器直径来改变相界面面积,可发现相面积越大,越有利于传质,因而提取率和回收率随之增大,当硫酸铵终饱和度为50%时,结果见图10。
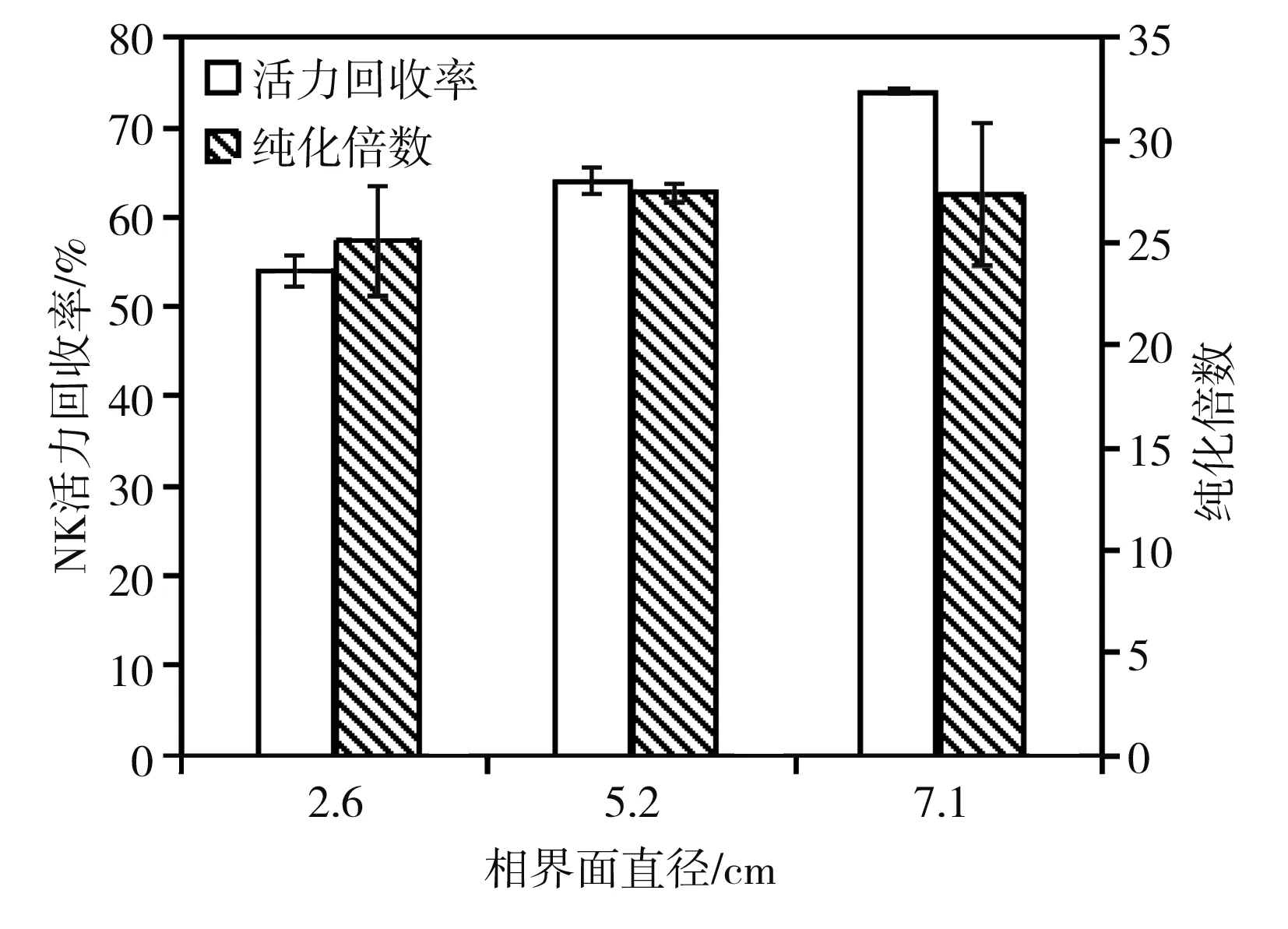
图10 不同大小接触面积下的NK纯化效果Fig.10 Purification effect of NK under different contact areas
实验结果发现,叔丁醇相与水相的相界面越大,NK回收率越高,纯化倍数基本不变。这意味着当相界面面积不足时,夹层中NK分子达到饱和造成分子拥堆,难以将水相中的NK一次性全部提取到夹层。因此在实际应用中,可以通过增加提取次数来减少NK的损失。
三相法中,若只进行一次提取,水相中的蛋白质不能完全分布到中间相,水相中的大部分NK很有可能并不能完全分布到夹层。在首次吸取夹层后,对剩余水相再次进行提取,如此反复使水相中的NK基本全部被萃取完全。在硫酸铵终饱和度为50%、接触面积直径为7.1 cm时,对NK进行多次提取,实验结果见图11。

图11 不同提取次数下的NK纯化效果Fig.11 Purification effect of NK under different extraction times
实验结果发现,随着提取次数的增加,NK的活力回收率和纯化倍数逐渐增加,提取3次时,NK活力回收率为87%,纯化倍数为35.3,提取4次时,NK活力回收率为91%,纯化倍数为35.7,基本不再增加,说明提取4次可基本把水相中的NK提取到中间沉淀相。因此在利用三相法浓缩纯化NK时,选择提取4次。
实验结果表明,蛋白的回收率随着体系中料液与叔丁醇接触面积的增大而升高,在叔丁醇与料液的体积比为1的条件下,若可保证叔丁醇在上相中的高度不小于0.5 cm,则接触面积越大越好。在本实验的体系中,提取4次可基本把水相的NK提取完,若体系不同,还需对提取次数进行优化,理论上提取次数越多,NK提取越完全。
利用沉淀剂CTAB对粗酶液中的γ-pGA进行沉降,对沉降后的上清液采用三相法进行浓缩,回收效果好。NK活力回收率为91%,纯化倍数为35.7。
2.9 高纯纳豆激酶冻干粉的效价
通过沉淀法及三相夹心法获得的NK冻干粉,其效价高达(7.88±0.76)×105Fu/g,获得的高纯NK冻干粉形态见图12。

图12 高纯NK冻干粉形态Fig.12 Morphology of high-purity NK lyophilized powder
由图12中A可知,获得的高纯NK冻干粉蓬松细腻,呈乳白色。由图12中B可知,高纯NK品相好,满足商品要求。若作为口服制剂,可制备成微胶囊(2.5~7.6 mg装量),大大减少消费者的口服剂量,还为注射针剂的进一步研发打下良好基础。
3 结论与讨论
实验结果说明,当pH为10时,NK与γ-pGA均带负电,相互排斥,解离结合,与γ-pGA偶联的NK会游离至上清液中,从而提高了NK效价或产量。高pH有利于NK从γ-pGA上解离,提高NK回收率。考虑到过高pH对NK酶活的影响,后续纯化工艺中采用pH为10的条件。
碱法解离后在2 000 g条件下离心去除大分子的γ-pGA,经冻干,检测初纯NK效价为2.55×104Fu/g,与现有产品相比,其效价属于中等偏上水平,可作为保健品原料,但还是无法满足微剂量服用的要求。若利用CTAB对粗酶液中剩余的γ-pGA进行沉淀,再对沉淀后的上清液采用三相法进行浓缩纯化,可大幅度提高纳豆激酶的效价,获得的高纯NK效价为(7.88±0.76)×105Fu/g,超过了目前所能了解到的所有产品的纯度,使浓缩型微量NK口服制剂的制备成为可能,也为注射针剂的研发打下良好基础。

