新辅助化疗联合靶向治疗治疗HER-2阳性乳腺癌患者获得病理完全缓解的影响因素
林司杭 关家裕 周文斌
1.暨南大学第二临床医学院,广东深圳 518020;2.深圳市人民医院乳腺外科,广东深圳 518020
乳腺癌是全球发病率位居第一位的癌症,也是女性中最常见的肿瘤之一。人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)阳性是乳腺恶性肿瘤高度恶性标志之一,预后较HER-2阴性乳腺癌差,其肿瘤生物学行为特征为恶性程度高、总生存期和无病生存期短及远处转移率和病死率高[1]。HER-2是目前乳腺癌新辅助治疗的重要靶点,新辅助化疗可以缩小乳腺癌原发病灶的大小,实现肿瘤降期,为手术创造有利条件,提高肿瘤切除率和保乳率。新辅助化疗联合曲妥珠单抗及帕妥珠单抗可以进一步使HER-2阳性乳腺恶性肿瘤获得病理完全缓解(pathological complete response,pCR),提高患者的生存率及预后[2]。pCR是临床医生评估乳腺癌患者新辅助治疗效果的可靠预后指标,达到pCR的患者较未达到pCR的患者无病生存时间、总生存时间均显著延长且远期生存率更高[3]。但临床也有相当一部分患者未能达到pCR,故获得pCR的影响因素值得探讨。本研究回顾性分析深圳市人民医院(本院)乳腺外科HER-2阳性乳腺癌患者新辅助化疗联合靶向治疗的相关临床资料,分析影响pCR的因素,为后续临床诊治提供相关依据。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月1日至2023年4月1日于本院乳腺外科接受新辅助化疗的209例HER-2乳腺癌患者的相关临床资料。参考《中国乳腺癌新辅助治疗专家共识(2022年版)》[4],纳入标准:①活检穿刺病理结果确诊为浸润性乳腺癌;②标本免疫组化检测回报为HER-2+++/++,同时荧光原位杂交(fluorescence in situ hybridization,FISH)为阳性;③患者接受≥4个周期的新辅助化疗联合靶向治疗,靶向治疗方案为曲妥珠单抗联合帕妥珠单抗双靶治疗或曲妥珠单抗单靶治疗;④患者同意手术治疗并且有完整的临床资料。排除标准:①患者临床相关资料不完善;②乳腺癌男性或患有双侧乳腺癌;③未接受完整的新辅助治疗;④首诊为Ⅳ期乳腺癌。本研究经本院医学伦理委员会批准(伦理审批号:LL-KY-2023097-01)。
1.2 方法
收集患者相关临床数据包括确诊年龄、乳腺癌的临床分期、组织学分型、新辅助化疗方案、靶向治疗方案、激素受体(hormone receptor,HR)状态、HER-2表达水平和Ki-67百分比及术后病理等。
1.3 实验室结果判定
根据第八版美国癌症分期联合委员会(American Joint Committee on Cancer,AJCC)乳腺癌分期系统来明确乳腺癌原发灶临床分期、区域淋巴结的临床分期及肿瘤总体分期[5]。根据乳腺癌的核分裂数、细胞核多形性及腺管形成程度的总评分将组织学分级分为Ⅰ级、Ⅱ级和Ⅲ级。HR阳性即孕激素受体(progesterone receptor,PR)和/或雌激素受体(estrogen receptor,ER)阳性。
参考2020版美国病理学家协会(College of American Pathologists,CAP)及美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)激素受体实验室检测指南[6],HER-2阳性定义为免疫组化为+++/++,并且FISH检测为阳性,意味着乳腺浸润癌细胞膜着色强、完整和均匀,其比例>10%;++为HER-2不确定,意味着乳腺浸润癌细胞膜着色弱-中等强度,其比例>10%;0/+为HER-2阴性,意味着乳腺浸润癌细胞膜无染色或着色微弱和不完整。HER-2免疫组化结果为不确定时需额外进行FISH实验室检测。FISH阳性即平均HER-2拷贝数≥6.0且HER-2/CEP17<2.0或平均HER-2拷贝数≥4.0且HER-2/CEP17≥2.0;FISH阴性即HER-2平均拷贝数<4.0且HER-2/CEP17比值<2.0。ER和PR检测结果为阴性即乳腺癌肿瘤细胞核染色比例小于1%,弱阳性即肿瘤细胞核染色比例为1%~10%,阳性则为肿瘤细胞核染色≥10%。Ki-67以14%为界,分为≤14%组和>14%组。
pCR的定义为乳腺的原发病灶无浸润性癌并且区域淋巴结为阴性(ypT0/TisN0M0),即Miler-Payne分级系统中的MP5级且淋巴结阴性,或残余肿瘤负荷(residual cancer burden,RCB)评估系统中的RCB 0级[7]。
1.4 统计学处理
使用SPSS 21.0统计学软件进行数据处理,计数和等级资料用[n(%)]表示,采用χ2检验或秩和检验,将差异有统计学意义的变量纳入多因素分析。通过二分类logistic回归模型进行pCR相关的多因素分析。评价指标采用OR和95%CI表示,P< 0.05为差异有统计学意义,从而得到独立相关指标。
2 结果
2.1 患者临床病理特征及pCR率
经纳入及排除标准筛选后,本研究共纳入209例患者,其中205例(98.09%)患者病理类型为浸润性导管癌,其余4例为浸润性小叶癌。患者年龄26~77岁,平均(48.95±9.34)岁。T1期10例(4.78%),T2期154例(73.68%),T3期35例(16.75%),T4期10例(4.78%)。N0期62例(29.67%),N1期114例(54.54%),N2期19例(9.09%),N3期14例(6.70%)。209例患者中获得pCR共93例,总体pCR率为44.50%。
2.2 影响新辅助化疗治疗后获得pCR的单因素分析
结果显示HR阴性组、HER-2 +++组、双靶治疗组、组织学分型Ⅲ级组的pCR率分别高于HR阳性组、HER-2 ++且FISH阳性组、单靶治疗组、组织学分型Ⅰ/Ⅱ组,差异有统计学意义(P< 0.05)。肿瘤的组织学分型、靶向治疗方案、HR状态及HER-2表达水平是影响pCR的关联因素。同时,乳腺癌确诊年龄、绝经状态、乳腺癌原发灶临床分期、区域淋巴结的临床分期、总体临床分期、Ki-67状态及新辅助化疗方案对pCR率无显著影响(P> 0.05)。见表1。
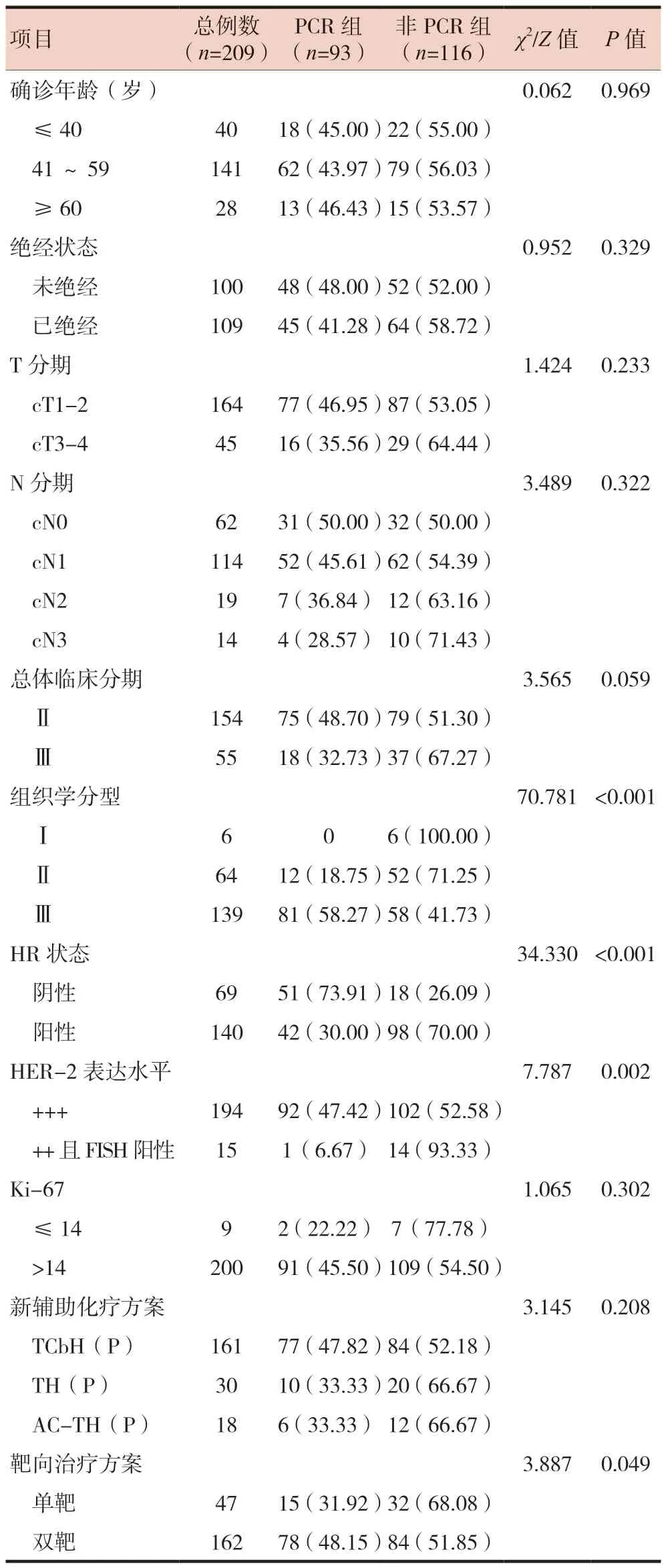
表1 影响HER-2阳性乳腺癌患者新辅助治疗后获得pCR的单因素分析[n(%)]
2.3 影响新辅助化疗治疗后获得pCR的多因素分析
结果显示影响pCR率的独立预测因素有HR状态(OR=3.859,95%CI:1.930~7.717,P< 0.001)、HER-2表达水平(OR=7.964,95%CI:0.918~69.065,P=0.048)及靶向治疗方案(OR=0.432,95%CI:0.186~1.002,P=0.049),其中接受双靶治疗方案、肿瘤HR阴性及HER-2 +++乳腺癌患者更容易获得pCR。见表2~3。

表2 多因素分析变量赋值表

表3 HER-2阳性乳腺癌各因素与pCR的关系多因素logistic回归分析
3 讨论
曲妥珠单抗等靶向药物的广泛应用极大改善了HER-2阳性乳腺癌患者的预后,但目前对于新辅助化疗联合靶向治疗的HER-2阳性乳腺癌患者达到pCR的预测因素尚不明确。因此,本研究探讨靶向联合化疗对HER-2阳性乳腺癌获得pCR的影响因素,以期为临床医生预测患者是否可获得术后pCR提供参考。
HER-2阳性乳腺癌临床及生物学存在异质性,故不同类型患者治疗获益程度也存在差异。HR状态是影响新辅助化疗获益的一项重要因素。本研究结果显示HER-2阳性乳腺癌HR阴性较HR阳性患者更容易在新辅助化疗后达到pCR(P< 0.001),与国外临床试验结果一致[8]。研究表明,HER-2阳性患者对新辅助化疗的敏感性因HR状态而异[9]。HR阳性乳腺癌患者低pCR率可能与HER-2受体与HR受体之间相互干扰有关,导致对HER-2治疗药物有耐药性。其次HER-2与HR之间的交叉通路逃逸机制也可能是低pCR率的重要原因[10]。
本研究结果表明,HER-2 +++组的pCR率高于HER-2 ++且FISH阳性组,差异有统计学意义(P=0.002),表明HER-2呈高表达水平是HER-2阳性乳腺癌患者在新辅助化疗联合靶向治疗中获得pCR的独立预测因子。这意味着HER-2表达程度越高越容易从新辅助化疗联合靶向治疗中获益,可能与靶向药物如曲妥珠单抗介导的细胞毒作用刺激人体免疫杀伤细胞杀灭癌细胞相关[11]。虽然HER-2 ++且FISH阳性组将HER-2结果判定为阳性,但其pCR率却远不如HER-2 +++组,故临床行免疫组化及FISH检测对患者预后显得格外重要。
本研究中,双靶治疗方案组pCR率高于单靶治疗方案组,差异有统计学意义(P=0.049),与国外临床试验结果一致。曲妥珠单抗联合帕妥珠单抗双靶治疗能提高患者pCR率16.8%~17.5%,4年中位无病生存期提高1.7%[12]。两组pCR率存在差异,可能与曲妥珠单抗和帕妥珠单抗双靶治疗之间的叠加效应有关[13]。二者可介导抗体依赖的细胞毒效应,还可以与HER-2阳性肿瘤细胞外的不同区域结合来遏制HER-2的同源和异源的二聚体化,从而阻断相关信号通路[14-15]。
综上所述,HER-2阳性乳腺癌新辅助化疗后获得pCR与接受双靶治疗方案、肿瘤HR阴性及HER-2呈高表达水平因素相关。此外,HER-2阳性乳腺癌患者新辅助化疗获得pCR的独立预测因子为接受双靶治疗方案、肿瘤激素受体阴性及HER-2呈高表达水平。这意味着接受双靶治疗方案、肿瘤激素受体阴性及HER-2 +++的HER-2阳性乳腺癌患者更容易在新辅助化疗中获得pCR。由于本研究为单中心回顾性病例对照研究,研究资料具有局限性且样本量相对不足,仍需要大样本多中心前瞻性研究进一步验证指标的有效性。另外,本研究在病例搜集时难免会存在选择偏倚,这一点无法与设计良好的前瞻性研究相比较。

