基于网络药理学和分子对接研究太子参治疗骨关节炎的作用机制
艾山江·阿帕尔 麦尔哈巴·苏力坦 李守刚 海如拉·卡斯木阿吉
1.新疆维吾尔自治区喀什地区第一人民医院药学部,新疆喀什 844000;2.新疆维吾尔自治区喀什地区第一人民医院新生儿科,新疆喀什 844000;3.新疆维吾尔自治区喀什地区第一人民医院小儿骨科,新疆喀什 844000
骨关节炎(osteoarthritis,OA)是常见的关节疾病,其标志性特征是关节疼痛和重要功能障碍。影响全球5亿多人(约占全球人口的7%),在高龄(>65岁)人群中发病率较高[1]。OA最终会导致身体残疾,从而影响生活质量[2]。权威指南中最常推荐的药物包括非甾体抗炎药、阿片类药物等,但这些药物有潜在的不良反应风险,尤其是在老年人群[3]。
中医学在治疗各种类型的OA方面具有明显的优势。OA主要是肝肾亏虚,气血不足,导致脉搏丧失,致筋脉不通等引起[4]。研究表明,太子参含有多糖、皂苷、环肽和挥发油等化学成分,具有改善疾病免疫功能、抗氧化等药理作用[5]。
网络药理学作为一门新兴的基础学科,它采用多种方法分析药物基因疾病的多类型和网络中医反馈机制系统,大大降低了科研难度和经费消耗,促进中医药的推广[6]。
本研究基于网络药理学,预测太子参治疗OA的关键活性成分、核心靶点和主要途径,分析太子参潜在的作用机制,以期为未来实验研究及与其他临床治疗手段联合使用提供参考。
1 方法
1.1 筛选药物活性成分
使用中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)检索出太子参的活性成分,筛选活性成分设定为口服生物采用度(oral bioavailability,OB)≥30%,类药性(drug likeness,DL)≥0.18。
1.2 OA对应靶点的筛选
通过Gene Cards、Drug Ban、Pharm Gkb、OMIM数据库使用“osteoarthritis”为关键词来获取疾病相关基因。通过R软件中采用VennDiagram包绘制疾病靶基因和药物靶点韦恩图,得到的太子参和OA疾病共有靶点。
1.3 建立“药物-活性成分-靶点”网络
使用STRING数据库获得疾病的共同靶点,进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)分析,并将结果输入Cytoscape 3.8.2软件进行分析,然后采用Cytoscape 3.8.2软件构建“药物-活性成分-靶点”网络图,获得药物-疾病交叉靶点中的核心关键蛋白。
1.4 基因本体(gene ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析
利用R语言(BiocManager包)对OA疾病与太子参药物的交集进行GO功能分析和KEGG通路分析,得到GO及KEGG富集分析结果。
1.5 分子对接分析
通过PubChem数据库下载PPI网络核心靶标对应的小分子配体结构的SDF文件,利用“1-CLICK DOCKING”在线工具进行分子对接,下载pdb结果文件,然后使用Discovery Studio软件绘制残基-配体交互情况。
2 结果
2.1 太子参活性成分的筛选
通过TCMSP数据库,共查找得到太子参25个活性成分,以ADME参数(OB≥30%和DL≥0.18)为标准筛选得到了8种活性成分,见表1。进一步消除无相应蛋白质靶点的其他活性成分,共有5种重要活性成分。
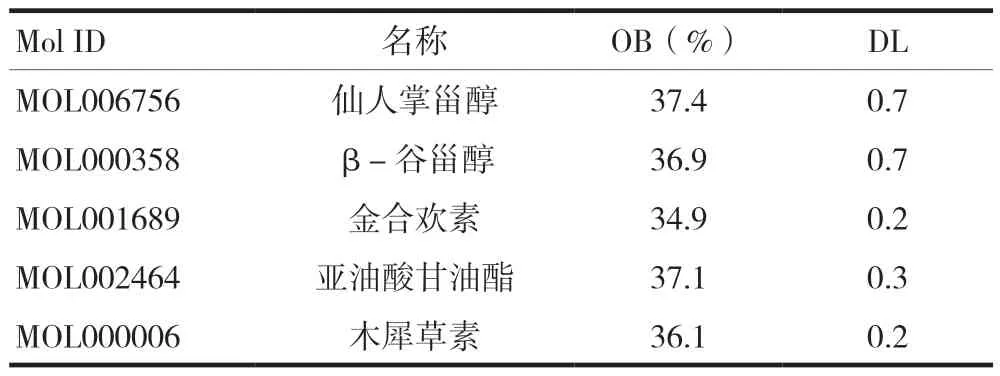
表1 太子参活性成分
2.2 太子参和OA的潜在靶点
通过检索数据库,共发现3380个OA相关的靶点。映射后,获得57个共同基因靶点,韦恩图见图1。

图1 太子参活性成分与OA靶点韦恩图
2.3 太子参治疗OA“药物-活性成分-靶点”网络构建
构建“太子参-活性成分-作用靶点”网络,见图2。该网络包括62个节点(5个活性成分节点和57个靶点节点)和108个边缘,每个边缘表示单个药物的活性成分和靶点之间的关系。线越密集活性成分对OA相关靶点的作用越明显。按节度排序,最重要的活性成分包括木犀草素、金合欢素、β-谷甾醇、仙人掌甾醇、亚油酸甘油单酯等。经过两次筛选得到核心靶点8个,分别为MAPK1、CCND1、JUN、TP53、CASP3、BCL2L1、AKT1、EGFR,见图3。
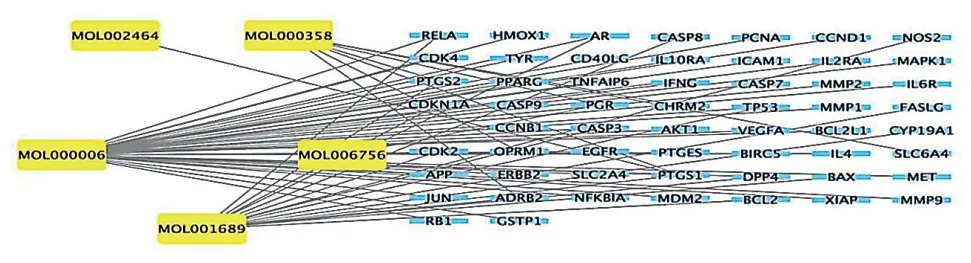
图2 太子参-活性成分-作用靶点网络

图3 PPI网络核心靶点筛选
2.4 核心靶基因GO分析和KEGG通路富集分析
GO分析可以获得生物学过程、分子生物学功能、细胞组分,见图4。结果显示,生物学过程与对氧化应激的反应等有关;细胞成分包括丝氨酸/苏氨酸蛋白激酶复合物等;分子功能的相关条目主要包括磷酸酶结合、蛋白磷酸酶结合等。
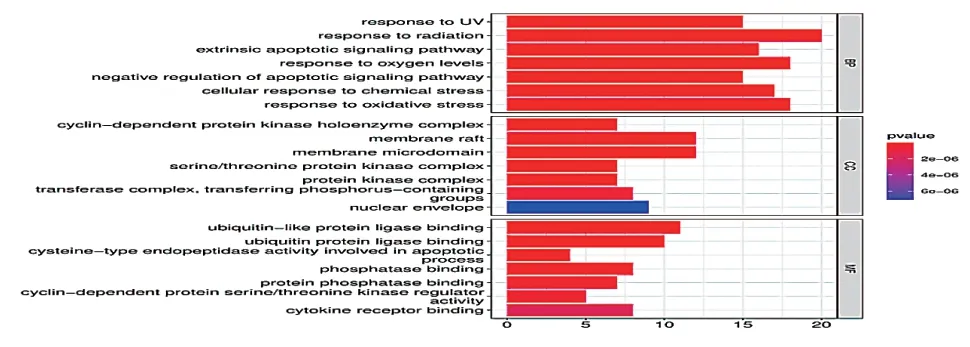
图4 交集靶点GO富集分析柱状图
KEGG富集分析显示,共筛选出太子参治疗OA的潜在通路,见图5。主要作用于PI3K-AKT、p53、AGE-RAGE、白细胞介素-17(interleukin-17,IL-17)信号通路等。

图5 交集靶点KEGG富集分析柱状图
2.5 分子对接分析
分子对接结果显示,太子参活性成分(木犀草素)与筛选出的靶点都能较好地对接,与网络药理学得到结果相吻合,间接验证了太子参能够调节OA的核心靶点。选择结合能最高的木犀草素和EGFR、CASP3、AKT1、TP53进行分子对接作为示例,见图6。
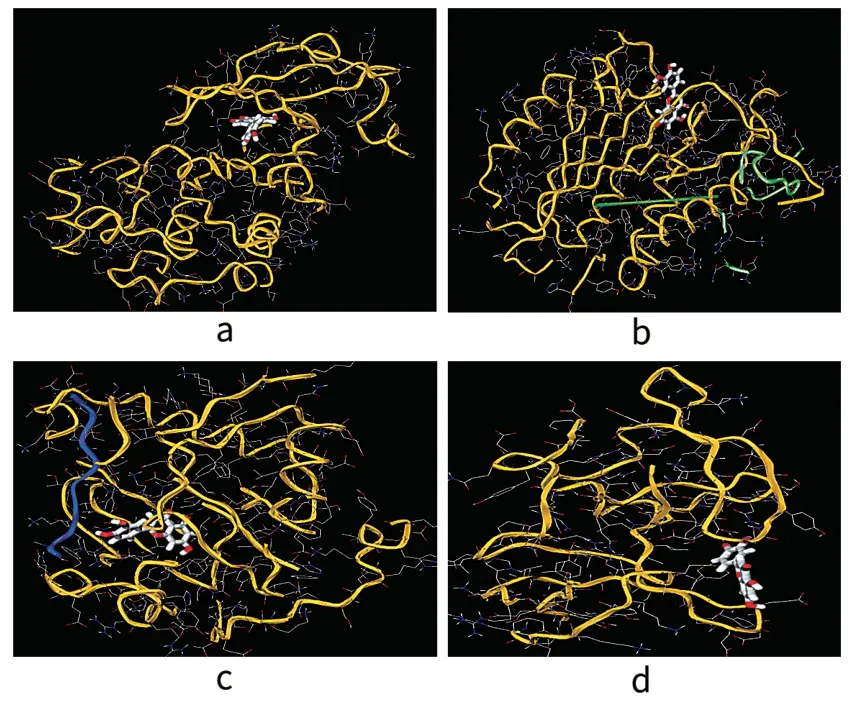
图6 木犀草素和EGFR(a),CASP3(b),AKT1(c),TP53(d)的分子对接图
3 讨论
OA是最常见的关节疾病之一,其典型特征是慢性关节疼痛和残疾[7]。基于网络药理学研究发现太子参中药内含有多种有效成分,可作用于多靶点、多通路,共同调节生物功能影响OA。本研究经过筛选统计发现与OA最相关的活性成分是木犀草素。通过PPI网络筛选并得到8个有潜力治疗OA的核心靶点,通过分子对接选择结合能最高的木犀草素和EGFR、CASP3、AKT1、TP53基因。
OA的发病机制与炎症、软骨代谢、氧化应激和细胞凋亡密切相关[8]。TP53可以阻断细胞周期,导致细胞凋亡,加速软骨降解[9]。一项动物研究表明,MMP活性与CASP3表达增加,伴有关节软骨变性和蛋白多糖丢失,应用CASP3对埃及驴进行OA分级,有望用于预后[10]。相关研究分析表明,AKT1的表达增加促进软骨细胞的修复[11]。一项研究表明,EGFR对于维持表面软组织细胞的数量和特征,促进软骨产生蛋白的表达以及刺激软骨表面润滑的其他功能至关重要。确定了EGFR作为表层关节软骨发育和起始关节炎的重要调节因子[12]。
KEGG分析结果显示,PI3K-Akt、IL-17信号通路是治疗OA的潜在关键机制。在关节炎的小鼠模型研究中,IL-17通过调节几种炎症介质加速软骨的破坏,表明IL-17在OA的发生和发展中起着关键作用[13]。PI3K-AKT信号通路的刺激可以抑制软骨细胞的增殖并促进软骨细胞的增生,从而延缓OA软骨退化的过程[14-15]。
本研究利用网络药理学研究技术,初步预测了太子参在OA治疗中的潜在活性成分,即重要的靶点和作用途径,为进一步探索其作用机制奠定基础。提示太子参的木犀草素等活性成分可能通过影响TP53、CASP3、AKT1、EGFR等相关蛋白靶点的表达,调控PI3K-Akt、IL-17信号通路对软骨细胞的修复、凋亡及细胞炎症反应的影响,减缓软骨细胞的凋亡,促进软骨细胞的增殖和修复,减少炎症反应。但本研究只是理论基础上的预测,为太子参治疗OA的临床应用提供参考依据,后续还需通过进一步实验验证药物的作用机制。

