肿瘤坏死因子-α对滋养细胞增殖及功能的影响
张新宇,王 觅,尹 兵
(1.大连医科大学 附属第一医院 妇产科,辽宁 大连 116011;2.青岛市妇女儿童保健中心 山东 青岛 266000;3.大连医科大学护理系,辽宁 大连 116044 )
随着临床分子生物学的发展,关于肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)对滋养细胞影响的研究日益受到关注。本文采用自建的人早期妊娠滋养细胞体外培养体系,研究不同浓度TNF-α对滋养细胞增殖活性及人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)分泌的影响,从而分析TNF-α 的浓度与滋养细胞之间的量效关系,为研究反复流产的发病机制、预测再次发生自然流产的风险以及评价治疗效果提供依据。
1 材料和方法
1.1 材 料
标本来源:取2008年3月~8月在大连医科大学附属第一医院行人工流产手术的绒毛标本,术前B超证实妊娠囊直径30 mm左右。将标本置于无菌弯盘中,用高压灭菌的Hanks液反复冲洗,挑出完整绒毛组织,加入无血清培养液的离心管,置于无菌冰壶保存备用。
1.2 实验方法
1.2.1 滋养细胞的分离与鉴定:制备滋养细胞悬液,光镜下判定活细胞并计算其浓度,用免疫组织化学方法对分离出的滋养细胞进行纯度鉴定。
1.2.2 原代滋养细胞培养及传代:培养绒毛膜滋养层细胞生长至满瓶壁的85%以上时按1次/3 d传代。
1.2.3 滋养细胞活性测定:将生长良好的滋养细胞制成细胞悬液移入96孔板,分别加入100 ng/mL,10 ng/mL,1 ng/mL和0.1 ng/mL 4种不同浓度的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),50 μL/孔,同时设未加细胞因子的细胞悬液孔作为对照组。
1.2.4 膜磷脂分布的检测:采用Annexin-FITC/PI双染流式细胞仪检测细胞膜磷脂分布,每个样本均获取10000个细胞。
1.2.5 滋养细胞的DNA含量检测:采用PI单染流式细胞仪检测滋养细胞的DNA含量。
1.2.6 HCG检测:采用电化学发光免疫法进行HCG检测。
1.3 统计学方法

2 结 果
经过人绒毛滋养细胞培养、形态学观察,滋养细胞鉴定、细胞纯度鉴定,认为培养的细胞纯度超过95%,符合实验要求,证明细胞培养成功。
2.1 滋养细胞增殖活性检测结果
通过MTT A570 nm值反映滋养细胞的增殖活性,低浓度TNF-α (0.1 ng/mL)作用24 h后,细胞A570 nm值明显高于对照组 (P<0.05);高浓度TNF-α (1~100 ng/mL) 作用后明显低于对照组 (P<0.05),见图1。

图1 TNF-α对滋养细胞MTT A570 nm值的影响*与对照组相比,P<0.05Fig 1 The effection of TNF-α to trophoblasts cell MTT A570 nm
2.2 膜磷脂分布的检测结果
经流式细胞仪AnnexinV-FITC/PI染色法检测滋养细胞膜膜磷脂分布结果(图2)。TNF-α 作用24 h后,与对照组比较在TNF-α低浓度(0.1~1 ng/mL)范围内,差异无显著性意义(P>0.05);在TNF-α高浓度(10~100 ng/mL)范围内,滋养细胞早期凋亡率随TNF-α 浓度升高而增加(P<0.05)。

图2 Annexin-V/PI染色法细胞膜磷脂分布检测Fig 2 Annexin-V/PI dyeability to cytomembrane phospholipids test
2.3 各组滋养细胞DNA含量检测结果
对滋养细胞培养24 h后,对照组细胞周期的G1期是86.2%,G2期是5.4%;加入TNF-α实验组细胞周期的变化如图3。结果提示:在不同浓度的TNF-α作用下,滋养细胞G1期、G2期差异无显著性意义(P>0.05);对照组与实验组分别比较,滋养细胞G2期的比例增加(P<0.05),G1期细胞的比例降低(P<0.05),细胞周期由G1期细胞向G2期移行。
在TNF-α 作用24 h后,对照组和0.1~10 ng/mL浓度的TNF-α G1峰左侧未出现凋亡峰;在10 ng/mL、100 ng/mL浓度的TNF-α 峰左侧出现凋亡峰(图3),晚期凋亡指数分别为2.1%和3.6%,其滋养细胞的晚期凋亡指数与正常对照组比较差异有显著性意义(P<0.05),晚期凋亡指数随TNF-α 浓度增加而增加(P<0.05)。
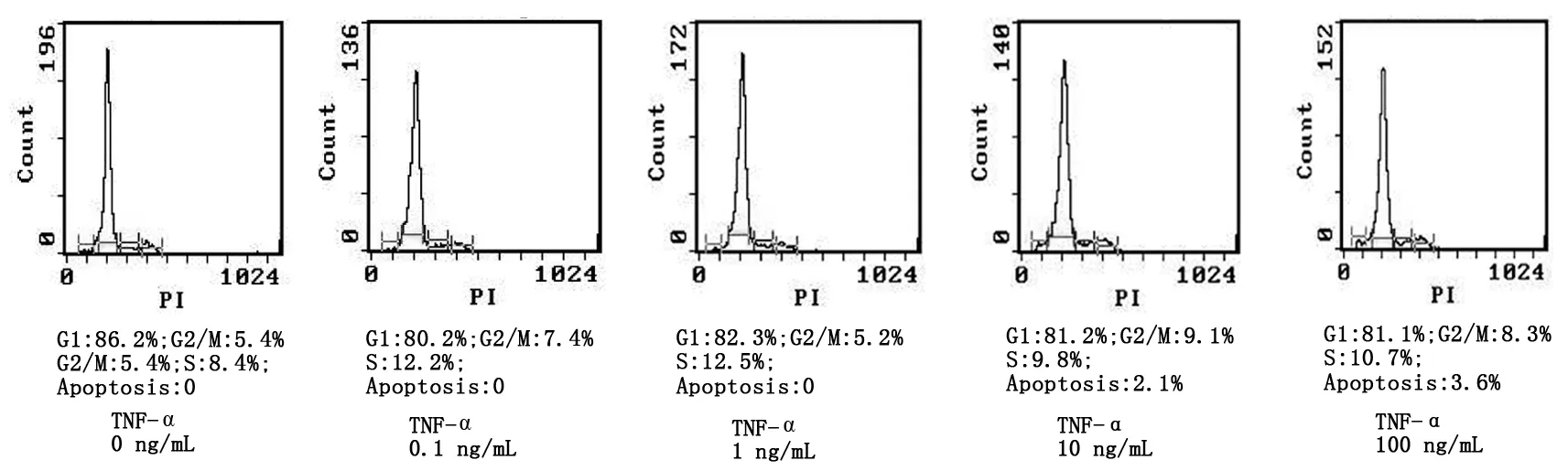
图3 流式细胞仪检测DNA含量Fig 3 DNA content by flow cytometry assay
2.4 滋养细胞HCG的分泌情况
用TNF-α 作用24 h后,与对照组相比,在0~100 ng /mL浓度范围内,随TNF-α浓度的增加,滋养细胞分泌HCG水平逐渐升高,差异有统计学意义(P<0.05),见图4。

图4 TNF-α 对滋养细胞HCG分泌的影响*与对照组相比P<0.05
Fig 4 The effection TNF-α to HCG secretion of human trophoblasts
3 讨 论
3.1 滋养细胞的特性
胎盘主要由滋养细胞构成,其功能依赖于结构的完整性。在妊娠过程中,滋养细胞增殖和凋亡,共同调节胎盘的发育、成熟和老化,以满足妊娠的需要。但当胎盘发育障碍时,则可引起多种妊娠相关疾病的发生,如不明原因的RSA、异位妊娠、妊娠高血压、胎儿宫内发育迟缓[1,2]等。在妊娠早期,滋养细胞需两次生理性侵入子宫壁,随后分化为绒毛滋养细胞(villi chorionic trophocytes,VCTs)和绒毛外滋养细胞(extra villi trophocytes,EVTs)[3]。其中EVTs是具有浸润能力的滋养细胞,分为浸润型和非浸润型[4]。浸润在时间上限于妊娠早期,空间上限于种植部位的子宫内膜、子宫肌层的浅1/3以及相关的螺旋动脉。早孕滋养细胞对子宫壁的有限侵入是人类妊娠得以正常进行的关键。该侵入过程的调节失控将导致一系列的妊娠相关性疾病。其中滋养层细胞的过度侵入与绒毛膜癌密切相关,滋养细胞增殖和凋亡之间平衡失调,引起滋养细胞侵入不足则会造成不明原因的RSA,滋养细胞增殖与凋亡平衡失调影响其浸润过程。胎盘滋养细胞的凋亡在调节细胞的增殖,胎盘组织结构和功能完整性上发挥重要的作用。同时,滋养细胞的凋亡也受到多种因子的调控,如Bcl-2家族蛋白、Fas-FasL系统及多种细胞因子等[5-8],TNF-α是其中一种重要的调控滋养细胞生长及功能的细胞因子。
3.2 TNF-α 与滋养细胞增殖及凋亡的关系
既往研究已发现啮齿类动物的子宫内膜细胞的凋亡在着床和胎盘化中过程发挥重要作用。研究证明,早期自然流产过程中能分泌TNF-α 的细胞聚集于母胎界面,TNF-α 可能在母胎界面局部影响滋养细胞的功能导致流产,同时TNF-α 的存在,也可使蜕膜细胞分泌的其他细胞因子水平发生改变,在一定程度上影响蜕膜细胞的凋亡及胎盘血管重铸,致妊娠失败[9]。本研究结果显示:低浓度(0.1 ng/mL)的TNF-α 可适度的促进滋养细胞增殖,使滋养细胞正常生长,通过胚泡与子宫内膜之间相互作用,促进胚泡在子宫内膜的植入。但在早期妊娠,随着TNF-α浓度的大量增加(本实验TNF-α浓度1~100 ng/mL),抑制了滋养细胞活性,导致滋养细胞增殖减少,凋亡增加(P<0.05)。这种增殖与凋亡失衡,使胎盘发育障碍,引起功能异常,不利于胚胎的生长,表现为自然流产。可见TNF-α影响滋养细胞的增殖及凋亡细胞之间的平衡、在维持胎盘组织结构和功能完整性上发挥重要的作用。TNF-α 对细胞凋亡有明显诱导作用,提示在细胞周期时相分布上,对G2期细胞向G1期移行有一定的阻断作用。由此推测:正是由于自然流产患者体内可能存在了TNF-α异常浓度增高,它抑制滋养细胞增殖,诱导滋养细胞凋亡,才使得胚胎或胎儿不能正常生长而致流产。此研究从基因水平上揭示了自然流产的又一个发生机理,从而为今后在分子水平上进一步研究不明原因的RSA的发病机制提供了一定的理论基础。对于先兆流产的患者,通过检测TNF-α水平,可作为临床上评价先兆流产结局的指标之一;也可以对有RSA的孕妇再次发生自然流产的风险进行预测。
3.3 不同染色方法检测滋养细胞凋亡效果之间的差异
目前,应用FCM进行凋亡细胞检测的常见方法有:PI单染法、Annexin V-FITC/PI双染色法、caspase-3活性试验和DNA断裂点标记。细胞凋亡早期, Annexin V-FITC/PI双染法可通过细胞膜膜磷脂分布检测细胞凋亡[10]。细胞凋亡晚期, PI单染法通过染料PI可穿透细胞膜与DNA结合,检测DNA含量,表现为G0/G1期前出现一个亚二倍体的凋亡峰[11],根据凋亡峰的大小可定量检测出凋亡的细胞百分数。
本实验采用了PI单染法和Annexin V-FITC/PI双染色法,结果提示:在细胞凋亡早期,使用Annexin V-FITC/PI双染法检测早期细胞凋亡,较PI法敏感性高;此方法快速,定量,可以检测早期细胞凋亡的改变,具有区分凋亡细胞和坏死细胞的能力。使用结合荧光素FITC的Annexin V和PI染色,能区别活细胞、凋亡细胞、坏死细胞。PI单染法检测相对晚期细胞凋亡,但由于细胞凋亡的早期尚未出现DNA片段大量丢失时,细胞的DNA不会出现在凋亡峰中,在细胞凋亡晚期,存在明显的DNA丢失,另外忽略S期和G2/M期细胞的凋亡,结果的准确性受到质疑,具有一定的局限性,且该方法不能区分坏死细胞。因此,随着对细胞凋亡研究深入的展开,检测凋亡的方法和技术也将会更敏感,更特异。
3.4 TNF-α与滋养细胞分泌HCG之间的关系
HCG是妊娠期滋养细胞分泌的一种糖蛋白激素,对维持正常妊娠有重要作用。目前,正常妊娠过程中HCG合成与释放的机制尚不完全清楚,可能与以下三个因素有关:滋养细胞(主要是合体滋养细胞)数量;滋养细胞的氧合度;细胞因子如IL-1、IL-6的刺激作用[12,13]。同时也有研究表明,妊娠中、晚期HCG水平的异常改变与先兆子痫、早产、宫内发育迟缓等不良妊娠有关[14]。
本实验结果显示, TNF-α(0~100 ng/mL)有促进滋养细胞分泌HCG的功能,结合TNF-α影响细胞增殖及细胞凋亡的结果,TNF-α促进分泌HCG的功能,可能受滋养细胞生长与凋亡之间平衡影响,使滋养细胞分泌HCG的功能代偿性增加[15],推测TNF-α并不直接对滋养细胞HCG的合成与释放产生调节作用,但其确切的调节机制尚有待于进一步探讨。
[1] Ishihara N,Matsuo H,Murakoshi H,et al.Increased apoptosis in the syncytiotrophoblast in human term placentas complicated by either preeclampsia or intrauterine growth retardation[J].Am J Obstet Gynecol,2002,186:158-166.
[2] Heiskanen J,Romppanen EI,Hiltunen M,etal.Polymorphism in the tumor necrosis factor-Agene in women with preeclampsia[J].J Assist Reprod Genet,2002,19:220-231.
[3] Shih IeM,Hsu MY,Oldr RJ,et al.The role of E-cadherin in the motility and invasion of implantation site intermediate rophoblast[J].Plancenta,2002,23:706-715.
[4] Aplin JD.Implantation,trophoblast differentiation and haemochor placentation:mechanistic evidence in vivo and vitro[J].J cell Sc,1991,99:681-692.
[5] De Falco M,De Luca L,Acanfora F,et a1.Alteration of the Bcl-2:Bax ratio in the placenta as pregnancy proceeds[J].Histochem J, 2001,33:421-425.
[6] Smith S,Francis R,Guilbert L,et al.Growth factor rescue of cytokine mediated trophoblast apoptosis[J].Placent,2002,23:322-300.
[7] Zhe Liu,Quan-Hong Sun,Ying Yang,et al.Effect of IFN-γ on caspase-3,Bcl-2 and Bax expression,and apoptosis in rabbit placenta[J].Cytokine,2003,24:201-209.
[8] Crocker I,Kaur M,Hosking DJ,et a1.Rescue of trophoblast apoptosis by parathyroid hormone-related protein[J].BJOG,2002,109:218-220.
[9] Wang Y.Therole and regalation of urolein asety peplas minogen activ atorre 2 ceptor gene expression incancer irwasion and metas tasis[J].Med Res Rev,2001,21(2):146-701.
[10] Elstein KH,Thomas DJ,Zucker RM.Fctors affecting flow cytometric detection of apoptotic nuclei by DNA analysis E[J].Cytometry,1995,21(2):170-176.
[11] Esterman AL,Finlay TH,Daneis J.The effect of hypoxia on term trophoblast:hormone synthesis and release[J].Placenta,1996,17(4):217-222.
[12] Liu DF,Dickerman LH,Redline RW.Pathologic findings in pregnancies with unexplained increases in midtrimester maternal serum human chorionic gonadotropin levels[J].Am J Clin Pathol,1999,111(2):209-215.
[13] D Li, X Wen,L Ghali,et a1.hCGb expression by cervical squamous carcinoma-in vivo histological association with tumour invasion and apoptosis[J].Histopathology,2008,53,147-155.
[14] Luckas M,Hawe J,Meekins J,et.al.Second trim-ester serumbeta human chorionic gonadotrophin levels as a predictor of preeclampsia[J].Acta Obstet Gynecol Scand,1998,77(4):381-384.
[15] Hiroyuki Seki,Kikumi Matuoka,Hiroki Inooku,et.al.TNF-α from monocyte of patients with pre-eclampsiainduced apoptosis in human trophoblast cell line and Satoru Takeda[J].J Obstet Gynaecol Res,2007,33(4): 408-416.

