SVF-PLGA联合脂肪移植体内构建组织工程化软组织充填材料的初步研究
麦凯欣 朱 辉 崔永言
SVF-PLGA联合脂肪移植体内构建组织工程化软组织充填材料的初步研究
麦凯欣 朱 辉 崔永言
目的采用组织工程方法,探讨生物可降解材料、自体脂肪作为细胞外基质,脂肪组织基质血管成分(SVF)作为种子细胞构建复合移植物,即刻回植,体内培养并用于软组织充填的可行性及安全性。方法取雄性新西兰大白兔40只,随机分为4组:实验组A、B(各10只)以两种混合方式构建SVF-脂肪-PLGA复合移植物,实验组A将SVF先与脂肪混合再种植于支架上,实验组B将SVF与支架充分混合,再用脂肪组织包埋;对照组A(n=10)的移植物为预处理后的空白支架;对照组B(n=10)的移植物为SVF-PLGA复合物。各组均将植入物移植至实验兔背部皮下与肌肉浅筋膜之间,于术后2个月、4个月取材,进行大体观察、组织切片、HE染色和油红染色,了解支架降解情况和组织工程化软组织充填材料构建情况,观察期间记录术后所出现的各种并发症和不良反应。结果术后4个月时,各组均未发生切口感染、硬结形成、移植物移位和排斥等并发症。实验组B中有1例切口裂开、2例脂肪液化。大体观察和HE染色、油红染色可见形成的组织工程化软组织填充材料主要成分为血管化脂肪组织,未发现肿瘤样细胞,外周形成纤维膜。4个月后PLGA支架完全降解,实验组B的脂肪存活率较实验组A和对照组B高。结论构建SVF-脂肪-PLGA复合物软组织充填材料是可行的,具有安全、可操作性强、耗时少、脂肪存活率高、塑形性好等优点。
移植软组织充填材料组织工程支架脂肪
软组织充填已广泛应用于整形外科,可改善身体各部位,特别是面部脂肪缺损、塌陷及双侧不对称等,寻找组织相容性好、易塑形、来源丰富的软组织充填材料具有重要意义。自体充填材料存在取材有限、增加创伤等不足;异体及异种组织因移植后存在免疫排斥反应,应用较少。目前,虽已有不少人工合成材料,却因组织相容性等问题而无法广泛应用,需要进一步研制、开发新产品以适应临床需求[1]。本课题拟采用组织工程技术,探讨生物可降解材料、自体脂肪复合细胞外基质与SVF复合物即刻回植,体内培养并进行软组织充填的可行性、安全性。
1 材料和方法
1.1 主要试剂和仪器
Ⅰ型胶原蛋白酶(美国Sigma公司),高糖DMEM培养液(美国GIBCO公司),5%小牛血清(美国GIBCO公司),PLGA支架(韩国REGEN生物技术公司),苏木素伊红(HE)染色试剂盒(上海碧云天生物技术有限公司),MPS 30倒置荧光显微镜(德国Leica公司),CM 1900低温恒冷冰冻切片机(德国Leica公司)。
1.2 动物与分组
选用新西兰雄兔(2~3月龄,南方医科大学实验动物中心提供)40只,体重2~2.5 kg,标准化饲养。随机分为实验组A、B(各10只)以两种混合方式构建SVF-脂肪-PLGA复合移植物,实验组A将SVF先与脂肪混合再种植于支架上,实验组B将SVF与支架充分混合,再用脂肪组织包埋;对照组A(n=10)的移植物为预处理后的空白支架;对照组B(n=10)的移植物为SVF-PLGA复合物。每只实验兔回植2个相同移植物。
1.3 复合物构建
1.3.1 SVF的提取
20%氨基甲酸乙酯溶液静脉麻醉(5 mL/kg),于实验兔双侧腹股沟区取皮下脂肪,共约20 mL(每侧约10 mL)。将脂肪组织剪成直径约5 mm的碎块,700 g离心3 min,0.1%胶原蛋白酶消化30 min,800 g离心10 min,取出成熟脂肪及纤维组织上悬液和上清液后加入缓冲液轻柔震荡,移去上清液,加入小牛血清2 mL,吹打重悬,细胞计数。
1.3.2 PLGA支架的预处理
无菌操作下从产品原容器中取出支架,用无菌剪刀将其修剪成若干小块(1.5 cm×2 cm×0.3 cm),50%乙醇浸泡,负压抽吸至排尽空气,低温保存过夜后,无菌水浸泡清洗3次,抽吸至排尽空气,PBS冲洗支架2次,低温保存备用。
1.3.3 移植物的构建
SVF-脂肪-PLGA支架复合物:每10 mL脂肪组织中的5 mL用于提取SVF,另5 mL与PLGA和SVF混合构建移植复合物。实验组A将SVF先与脂肪混合再种植于支架上;实验组B将SVF种植于支架上,再用脂肪组织包埋。
SVF-PLGA支架复合物:10 mL脂肪全部用于提取SVF,并将SVF均匀种植于支架上。
1.4 手术方法
20%氨基甲酸乙酯溶液静脉麻醉(5 mL/kg),实验兔俯卧位,兔背部备皮,消毒、铺巾。取背部垂直脊柱的长约1.5 cm的切口,钝性分离皮下组织与肌肉浅筋膜间的潜在间隙(约3 cm×2 cm×0.3 cm),将已制备好的复合物置入,3-0丝线全层缝合切口,留置切口标记线。
1.5 观察指标
复合物植入前的SVF细胞计数,术后2个月、4个月分别对每只实验兔取1个移植物标本,行大体观察、体积测量,并计算复合物存活率,快速冰冻切片后HE染色和油红染色,镜下观察。
1.6 统计学处理
应用SPSS 1.0统计软件进行数据分析,数据以均数±标准差表示;实验分组间的移植物体积比较采用单因素方差分析,P<0.05为差异有显著性。
2 结果
2.1 充填移植物植入前的SVF细胞计数及移植物在术前、术后2个月和术后4个月的体积
因部分移植物形状不规则,全部均以排液量(磷酸盐缓冲液)作为体积计量记录。实验组A、B和对照组B的移植物植入前SVF细胞计数无显著性差异(P>0.05)。实验组A、B的移植物在术前的体积无显著性差异(P>0.05),术后2个月、4个月实验组B的移植物体积均比实验组A大,有显著性差异(P<0.05),其体积变化的标准差也比实验组A小。实验组A、B的移植物存活率平均值较对照组B高(表1)
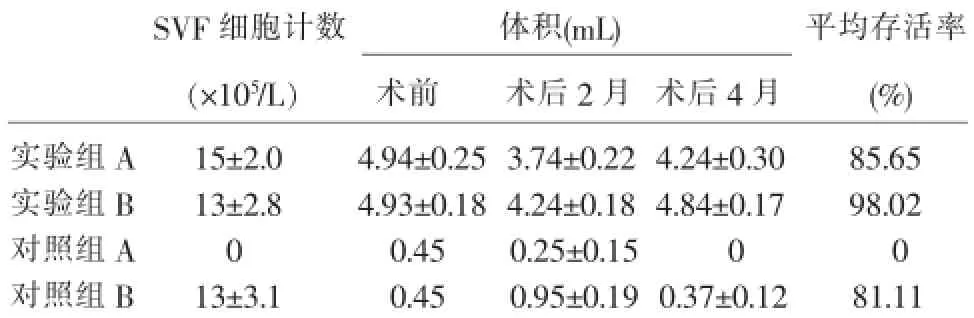
表1 SVF细胞计数、移植物手术前后体积变化和存活率比较
2.2 大体观察
术后2个月:实验组可见乳白色半透明脂肪组织内有残留PLGA支架,质地柔软,20个取出标本的平均体积较植入前小;A、B两组外观基本相同,只存在体积差异。对照组A的残留PLGA支架较实验组的残留PLGA支架稍大,外周包绕完整纤维膜,质硬如软骨。对照组B可见鲜红色类圆形团块状物,外周有较致密纤维膜包裹,质韧,切开见残留PLGA支架。
术后4个月:实验组可见乳白色不透明脂肪组织,质地柔软,切开未见残留PLGA支架。A、B两组外观基本相同,20个取出标本的平均总体积与植入前基本一致,B组的平均体积稍大,但2个标本发生完全或部分脂肪液化。对照组A的PLGA支架已完全降解,剖开移植物未见支架成分残留,原植入区可见少许纤维样组织,与皮下组织紧密粘连。对照组B可见类矩形片状脂肪组织,外周有纤维组织膜状增生,质较柔软(图1)。

图1 术后4个月,各组大体观察
对照组A、B和实验组A均未发生术后切口裂开、感染和硬结形成、移植物移位等并发症。实验组B中有1例发生移植区伤口裂开,再次予以缝合;1例发生移植区完全脂肪液化;1例发生移植物部分脂肪液化。

图2 术后2个月,实验组组织学观察(100×)

图3 术后2个月,对照组B组织学观察(100×)
2.3 组织学观察
术后2个月:实验组快速冰冻切片HE染色可见PLGA支架残留量较大,外周有薄层纤维膜状增生,脂肪细胞主要分布于残留支架外周,脂肪细胞内含大脂滴,脂滴外周为薄层胞质,核被推挤到一侧,多聚成群;脂肪组织内可见少许毛细血管长入。油红染色可见支架外脂肪细胞橙红染色。实验组A、B的镜下观察未见差异(图2)。对照组A可见降解中的不规则网状支架,其内可见少许毛细血管长入,外周有薄层纤维膜状增生,未见脂肪细胞,油红染色未见橙红色细胞层。对照组B亦可见中央的不规则网状支架,脂肪组织在支架空隙生长,以支架外1/2较明显,油红染色呈多个橙红色脂肪细胞层(图3)。
术后4个月:实验组快速冰冻切片HE染色可见致密的脂肪细胞层,脂滴较术后2个月的大,内未见PLGA支架残留,脂肪组织间可见不规则纤维隔,外周未见明显纤维膜状增生;脂肪组织内可见毛细血管长入,管壁细胞层较前增多。油红染色可见脂肪细胞橙红染色。实验组A、B的镜下观察未见差异(图4)。对照组A可见致密纤维组织,内有淋巴细胞浸润,少许毛细血管长入,油红染色未见橙红色细胞层(图5)。对照组B原有的网状支架基本消失并被脂肪组织取代,油红染色呈多个橙红色脂肪细胞层。

图4 术后4个月,实验组组织学观察(100×)

图5 术后4个月,对照组A组织学观察(100×)
讨论
软组织充填的材料分注射性和非注射性两类,前者是指注射到皮肤或皮下组织内,达到矫正缺陷的目的,因其操作简便,来源丰富,所以占有软组织充填材料的绝大部分,但有时会出现全身及局部损害,如注射物移位、水肿、肉芽肿样反应、细胞毒性、遗传毒性等[2]。因此,非注射性材料,如无细胞真皮基质(Alloderm)、人发制备软组织充填材料、生物可降解支架等[3-5]被尝试用于临床。
在注射性软组织充填材料中,脂肪移植一直备受关注,尤其是抽脂术在临床广泛应用后,自体脂肪颗粒移植被越来越多的医生和患者所接受,并在获取、纯化、注射脂肪和提高其生存率等方面不断得到提高。SVF是含有大量多向分化潜能的间充质干细胞,取材方便,增殖能力强[6],其富含的脂肪组织来源干细胞(ASCs),具有以下几个特点[7]:①具备分化为脂肪细胞的潜能,并且促进细胞更新换代;②可分泌SDF-1、HGF等血管生长因子,并使自身分化为血管内皮细胞,促进受区组织在损伤、缺氧的刺激下血管化;③ASCs在分化的同时,数目基本不变,增殖分化功能得以维持。此外,提取SVF能省却提取ASCs的体外扩增步骤,简化了实验过程,并节省了实验时间,所以选取SVF作为种子细胞是可行的,并具有耗时少的优势。
选择合适的细胞载体作为细胞外基质是使SVF中的ASCs得以增殖、分化的重要条件[8]。脂肪组织本身含有较丰富的胶原、纤维粘连蛋白、蛋白聚糖等,可提供良好的细胞外基质。近年提出的细胞辅助脂肪转移(Cell-Assisted Lipotransfer,CAL)技术[9],同时解决了移植脂肪中ASCs含量低和移植SVF缺乏细胞外基质两个问题,并简化了SVF提取的体外培养、多次离心重悬等步骤,但CAL技术提高移植脂肪存活率的具体数据并没有准确报道,且塑形性较差,充填效果仅在临床体现,未有组织学证据。本实验选用的支架为PLGA,具备生物可降解性,其降解产物为H2O和CO2,组织相容性好,网格状结构使干细胞分布均匀,有利其生长,可作为良好的细胞外基质。Choi等[10]以裸鼠为实验对象,提出了ASCs复合PLGA用于软组织充填的可能性,但是该方法需要7~10 d体外扩增时间才能取得足够量的ASCs,使临床应用受到限制。
根据本实验中的对照组B的结果,我们发现,直接以SVF作为种子细胞,简化了ASCs的提取步骤,但单纯使用SVF、支架复合培养在手术后初期存在充填局部僵硬,手感差,且脂肪存活率低等缺点。若将脂肪组织和可降解材料两者结合,作为含有生物组织和组织工程材料的复合细胞外基质,构建SVF-脂肪-PLGA充填移植物,不仅能保证有效的ASCs浓度,亦能为其提供胶原蛋白含量丰富、有利于ASCs爬行生长和组织相容性好的细胞外基质,有望互补不足,从而优化软组织充填效果。单纯脂肪移植、CAL的平均存活率大约为40%~80%[7],实验组A、B的存活率均在90%以上,大大提高了移植脂肪的存活率。
实验组A与实验组B的移植物存活率和并发症发生情况存在差异,提示SVF与支架充分混合后再用脂肪组织包埋的移植物存活率较高,即以PLGA支架作为主要的细胞载体,脂肪作为SVF提供营养的生物物质,对ACSs的存活、增殖和分化是有利的。我们认为,用脂肪组织来包埋SVF-PLGA复合物,能为种子细胞SVF创造一个相对封闭的、营养充分的生存内环境,从而减少了移植区局部环境对移植物的影响;存在于SVF的ASCs本身具有分泌血管生长因子的作用,脂肪组织亦为血管化提供良好的条件,提高了ASCs的生命力和脂肪的存活率。要进一步优化生长内环境,可考虑添加合适的细胞因子或其他营养物质等,有待于进一步探索。另外,脂肪液化的发生,可能是因为手术时分离腔隙狭窄、脂肪组织与切口接触紧密等因素。
实验中,4组均有充填移植物的外周纤维膜形成。可能是因为移植物含支架外来成分,机体产生异物反应;实验兔手术应激性反应较大,导致发生无菌性炎症;存活后的移植脂肪组织的旁分泌作用诱导成纤维细胞趋化,促进了纤维膜形成[11]。
软组织充填除了用于面部充填外,也应用于阴茎增粗[12-13]。阴茎增粗主要依赖于软组织充填的各种手段来实现,多种软组织充填材料包括自体组织移植和皮瓣转移、各种人工合成假体已应用于阴茎增粗。但由于阴茎的特殊结构、形态及因勃起而出现的体积变化等,使其对充填材料的要求更高,安全有效的阴茎增粗充填材料仍在研究中[14-22]。组织工程技术用于重建阴茎结构与功能是近年来重建外科学研究的热点之一[23]。Perovic等[22]利用成纤维细胞体外扩增后复合可降解支架体内回植,使阴茎增粗获得成功,这是首次利用PLGA为支架的细胞自体移植用于软组织充填的临床应用,但体外扩增需要时间较长,手术时机难以把握。吴意光等[24]从病理学角度证明了自体成纤维细胞种植PLGA支架的安全性,认为是安全有效的组织工程细胞支架复合物。本实验尝试利用SVF提取简便的优势,省却了体外扩增的步骤,能缩短治疗时间;同时构建SVF-脂肪-PLGA复合充填材料,有效提高了移植脂肪的存活率,改善了单纯SVF-PLGA移植在手术后初期充填局部僵硬、手感差、远期存活率低等缺点,为临床应用提供了理论和实践依据。
[1]虞瑞尧.软组织充填剂在美容皮肤科的应用[J].中国美容医学, 2003,12(5):473-475.
[2]张华辉,程健.注射性软组织填充剂的分类和评价[J].国外医学皮肤性病学分册,2005,31(1):12-14.
[3]王莹,张明利,邢新,等.无细胞真皮基质与软组织充填[J].实用美容整形外科杂志,2002,13(2):109-111.
[4]汤丁洁,张娇,李德保,等.人发制备软组织充填材料微观结构及皮内充填效果观察[J].中国美容整形外科杂志,2008,19(2):144-146.
[5]李涛,吕志前.生物可降解支架研究进展[J].解剖科学进展,2008, 14(4):436-440.
[6]李春明,刘毅.脂肪干细胞及其在脂肪组织工程中的应用[J].中国美容医学,2006,15(4):466-468.
[7]Yoshimura K,Suga H,Eto H.Adipose-derived stem/progenitor cells:roles in adipose tissue remodeling and potential use for soft tissue augmentation[J].Regen Med,2009,4(2):265-273.
[8]原博,陆树良.细胞外基质对前脂肪细胞分化转归的影响[J].创伤外科杂志,2007,9(6):569-571.
[9]Matsumoto D,Sato K,Takaki Y,et al.Cell-assissted lipotransfer: supportive use of human adipose-derived cells for soft tissue augmentation with lipotransfer[J].Issure Eng,2006,12(12):3375-3382.
[10]Choi YS,Cha SM,Lee YY,et al.Adipogenic differenation of adipose tissue derived adult stem cells in nude mouse[J].Biochem Biophys Res Commun,2006,345(2):631-637.
[11]Tang YL,Zhao Q,Qin X,et a1.Paracrine action enhances theefects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J].Ann Thorac Surg,2005,80(1):229-236.
[12]麦凯欣,朱辉.阴茎增粗术的研究进展[J].中国美容整形外科杂志,2009,20(9):558-561.
[13]Vardi Y.Is penile enlargement an ethical procedure for patients with a normal-sized penis[J]?Eur Urol,2006,49(4):729-733.
[14]Alter GJ,Jordan GH.Penile elongation and girth enhancement[J]. AUA Update Series,2007,26:229-237.
[15]Spyropoulos E,Christoforidis C,Borousas D,et al.Augmentation phalloplasty surgery for penile dysmorphophobia in young adults: considerations regarding patient selection,outcome evaluation and techniques applied[J].Eur Urol,2005,48:121-128.
[16]Sawhney CP,Banerjee TN,Chakravarti RN.Behaviour ofdermal fat transplants[J].Br J Plast Surg,1969,22:169-176.
[17]Shaeer O,Shaeer K.Penile girth augmentation using flaps.Shaeer's augmentation phalloplasty:a case report[J].J Sex Med,2006,3: 164-169.
[18]王松山,龙道畴,郭琴,等.带蒂阴股沟真皮脂肪瓣转移阴茎加粗术[J].中国美容整形外科杂志,2008,19(3):186-188.
[19]谢军,刘继红,樊龙昌,等.阴茎体白膜两侧睾丸鞘膜移植阴茎增粗术实验研究[J].中华男科学杂志,2006,12(12):1091-1094.
[20]Austoni E,Guarneri A,Cazzaniga A.A new technique for augmentation phalloplasty:albugineal surgery with bilateral saphenous grafts three years of experience[J].Eur Urol,2002,42:245-253.
[21]杨斌,张金明,陈小萱,等.阴茎海绵体增粗并延长同期整复术[J].中华医学美学美容杂志,2003,9(2):84-86.
[22]Perovic SV,Byun JS,Scheplev P,et al.New perspectives of penile enhancement surgery:tissue engineering with biodegradable scaffolds [J].Eur Urol,2006,49:139-147.
[23]李慧,朱辉.阴茎海绵体组织工程的研究进展[J].国际生物医学工程杂志,2008,31(2):102-106.
[24]吴意光,金哲,巩艳青,等.PLGA生物细胞支架种植自体成纤维细胞对阴茎增粗的安全性有效性研究[J].中国男科学杂志,2008, 22(9):5-9.
Preliminary Study of Co-Transplantation of SVF-PLGA with Fat Complex on the Construction of Tissue Engineering Implant
MAI Kaixin,ZHU Hui,CUI Yongyan.Department of Plastic Surgery,Peking University Shenzhen Hospital,Shenzhen 518036,China.Corresponding author:ZHU Hui.
ObjectiveTo evaluate the feasibility and safety of co-transplantation of SVF-PLGA with fat complex on the construction of tissue engineered implant.MethodsForty adult New Zealand male rabbits were randomly divided into four groups.In the experimental group A(n=10),implant was constructed by use of SVF-PLGA with fat complex and in the group B (n=10).SVF-PLGA complex buried by adipose tissue was used.In the control group C(n=10)only PLGA and group D(n=10), SVF-PLGA complex was used.All the complex were translated between skin and superficial fascia.Tissue samples obtained were analyzed with gross observation,HE stain and red oil stain at 4 months postoperatively.ResultsThe tissue engineered implant was mainly vascularized adipose tissue without tumor cell.PLGA scaffolds were degraded completely 4 months later. The survival rate of fat in experimental group B was higher than in the group A and in the control group B.Conclusion SVF-PLGA with fat complex on soft tissue with the advantage of high survival rate of fat.
Transplantation;Soft tissue;Implant;Tissue engineer;Scaffold;Fat
Q813.1+2
A
1673-0364(2010)01-0009-05
2009年11月22日;
2010年1月24日)
10.3969/j.issn.1673-0364.2010.01.003
518036广东省深圳市北京大学深圳医院整形美容外科(麦凯欣,朱辉,崔永言);515031广东省汕头市汕头大学医学院(麦凯欣)。
朱辉。

