富含半胱氨酸的酸性分泌糖蛋白在病理性瘢痕中的表达及其意义
刘超华 李小静 宁金龙 王 春
富含半胱氨酸的酸性分泌糖蛋白在病理性瘢痕中的表达及其意义
刘超华 李小静 宁金龙 王 春
目的观察富含半胱氨酸的酸性分泌糖蛋白(Secreted protein,acidic and rich in cysteine,SPARC)在瘢痕疙瘩和增生性瘢痕中的表达规律及其意义。方法瘢痕患者的瘢痕疙瘩和3~12个月增生性瘢痕组织各26例;另取手术剩余的正常成人皮肤组织5例;所有标本用40 g/L甲醛固定,行连续切片,厚4 μm,应用链菌素生物素-过氧化物酶标记物免疫组织染色法染色。同时设正常对照(正常皮肤)、阳性对照(胃癌癌变组织)、阴性对照(磷酸盐缓冲液代替一抗)。鼠抗人SPARC单克隆一抗浓度为1∶200。结果正常成人皮肤中SPARC表达稀少,局限在真皮-表皮交界的乳头真皮,部分靠近基底膜血管和皮肤附件。SPARC在增生性瘢痕的真皮瘢痕组织、皮肤附件中低表达,且早期增生性瘢痕中表达无明显强于晚期增生性瘢痕(P>0.05)。在真皮中SPARC呈弥散性散在分布(同增生性瘢痕),阳性信号表达较低。增生性瘢痕及瘢痕疙瘩的SPARC较正常皮肤表达无差异(P>0.05)。结论SPARC在3~12个月增生性瘢痕中呈低表达,在瘢痕疙瘩中低表达。
瘢痕疙瘩富含半胱氨酸的酸性分泌糖蛋白增生性瘢痕表达
病理性瘢痕包括增生性瘢痕(Hypertrophic scar,HS)和瘢痕疙瘩(Keloid),是人体创伤、炎症、烧伤或自发的一种过度的皮肤纤维增生性疾病。其组织学特点为大量成纤维细胞增生,细胞外基质中胶原、蛋白多糖、糖蛋白等过度沉积,胶原纤维排列紊乱。富含半胱氨酸的酸性分泌糖蛋白(Secreted protein,acidic and rich in cysteine,SPARC),是一种与基质相联系的糖蛋白,属于细胞母蛋白家族[1]。现有研究证明,其在多种纤维化疾病(如肺纤维化[2]、肝纤维化[3]、肾纤维化[4]及心肌纤维化[5])过程中起重要作用,并参与系统性硬化症的发生[6]及创伤愈合的过程[7]。此外,SPARC在几种恶性肿瘤中亦有过度表达[10],如乳癌、食管癌、胃癌、结直肠癌、黑色素瘤等,并且其表达增高的程度与浸润能力成正比。因其在创伤愈合、纤维化疾病、瘢痕和肿瘤形成中起重要作用,SPARC正逐渐引起人们的广泛关注。
我们以免疫组化技术对SPARC在病理性瘢痕和正常皮肤组织中的表达进行观察,旨在研究发现其中的差异,以揭示SPARC在瘢痕形成机制中的可能作用,以期更好地认识病理性瘢痕的发生机制,为预防和治疗病理性瘢痕提供理论依据。
1 材料和方法
1.1 材料
本实验所用标本取自我院患者。其中增生性瘢痕26例(按损伤后3个月、6个月、9个月、12个月不同时间分组编号),其中男16例、女10例,年龄4~66岁,标本分别取自面部、颈部、胸部、肩部及四肢;瘢痕疙瘩26例,其中男11例、女15例,年龄12~55岁,标本分别取白面部、颈部、胸部、肩部及四肢;正常皮肤5例,其中男4例、女l例,年龄3~65岁,标本分别取自面部、颈部、胸部、肩部及四肢。各组年龄、性别差异均无统计学意义(P>0.05)。瘢痕组织取材前,患者均未经任何药物治疗,且取材部位无破溃、感染、肿瘤等其他疾病[8]。
1.2 试剂及仪器
一抗(Santa cruz公司,美国);二抗及SP试剂盒(武汉博士德生物工程有限公司);PBS缓冲液(北京中山金桥技术有限公司);枸橼酸盐缓冲液(武汉博士德生物工程有限公司);多聚赖氨酸(北京中山金桥技术有限公司);倒置相差显微镜(奥林巴斯映像销售有限公司);数显电恒温水槽(上海精宏实验设备公司);恒温培养箱(上海精宏实验设备公司);分析天平(上海精科天平厂);移液器(Eppendorf公司,德国);切片机(上海一恒科技公司);低温冰箱(三洋制冷设备公司,日本);纯水机(Labconco公司,美国);恒温干燥箱(上海一恒科技公司)。
1.3 实验方法
1.3.1 免疫组织化学染色法
主要步骤包括:①多聚赖氨酸抗脱片处理。②切片用二甲苯脱脂,梯度乙醇和蒸馏水水化。③体积分数为0.03的过氧化氢室温5~10 min,封闭内源性过氧化物酶,蒸馏水洗3次。④滴加正常血清封闭液,室温20 min,甩去多余液体,不洗。⑤滴加适当稀释的鼠抗人SPARC一抗(1∶200)50 mL,37℃1 h孵育,0.01 mol/L磷酸盐缓冲液洗2 min,3次。⑥滴加生物素羊抗鼠IgG,37℃,20 min,0.01 mol/L磷酸盐缓冲液洗2 min,3次。⑦滴加试剂链菌素生物素一过氧化物酶标记物37℃,20 min,0.01 mol/L磷酸盐缓冲液洗5 min,4次。⑧室温控制下二氨基联苯胺显色,显色时间8 min,蒸馏水洗涤。⑨苏木精轻度复染,脱水、透明、封固,镜下观察。
1.3.2 综合染色强度和阳性细胞数分级
SP法染色后镜下观察。取表达最强的部位,按着色程度评分:基本未着色、染色与背景相似者为0分;着色浅、略高于背景者为1分;中度着色、明显高于背景者为2分;深度着色者为3分。按阳性细胞数评分:阳性细胞数少于25%为0分;阳性细胞数达25%~49%为1分;50%~75%为2分;超过75%为3分。两项相加后,0~1分为(-),2分为(+),3~4分为(++),5分以上为(+++)。
1.4 统计学处理
应用SPSS 10.0统计软件。用X2检验和方差分析处理数据。
2 结果
SPARC在正常皮肤表皮中呈阴性表达;在真皮内分布于真皮-表皮交界的乳头真皮处,呈少量、不连续、斑点样表达(图1)。
在增生性瘢痕表皮中SPARC表达均呈阴性;在增生性瘢痕真皮组织中SPARC呈散在分布,主要见于成纤维细胞、胶原纤维、平滑肌细胞、皮肤附件、浸润的炎性细胞和微血管内皮细胞(图2)。增生性瘢痕真皮中,SPARC的表达与正常皮肤组无明显差异(P>0.05)(表1)。增生性瘢痕组中,损伤后3~6个月与9~12个月的标本无明显差异(表2)。
SPARC在瘢痕疙瘩表皮中呈阴性表达;在真皮中,SPARC同在增生性瘢痕一样呈弥散性散在分布,阳性信号表达较低(图3),其表达强度略高于正常皮肤组,但无统计学意义(P>0.05)。增生性瘢痕与瘢痕疙瘩的差别亦无统计学意义(P>0.05)(表1)。

图1 SPARC在正常皮肤中的表达(400×)
图2 SPARC在增生性瘢痕中的表达(400×)

图3 SPARC在增生性瘢痕疙瘩中的表达(400×)

表1 SPARC在不同组织真皮中的表达情况
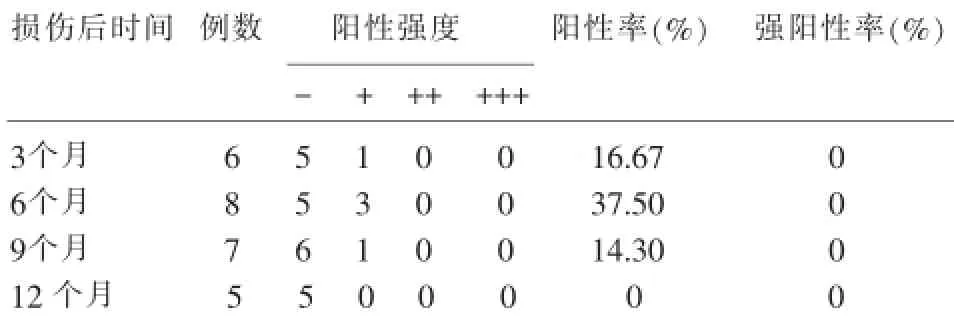
表2 SPARC在增生性瘢痕不同时期的表达情况
3 讨论
SPARC广泛存在于人体组织中,最初是作为非胶原成分被描述和纯化的[9]。随后的研究表明,SPARC在人体中分布广泛,尤其是在发育和重建中的组织。体内、外实验表明,它能影响多种细胞的活动,SPARC及其相关的肽与细胞外基质结合,影响细胞外基质的表达,改变细胞形态变化,降低细胞的黏附性,影响细胞的迁移,调节生长因子诱导的细胞增殖及血管发生[1,10]。这些功能同器官纤维化、创伤愈合、肿瘤以及皮肤纤维化的发生发展密切相关[10-11]。
在实验中我们发现,SPARC能在浸润的炎性细胞和微血管内皮细胞中表达,我们推测外伤、炎症刺激可促进内皮细胞表达SPARC,表达于血管内皮细胞上的SPARC参与淋巴细胞与血管内皮细胞间的相互作用,增强白细胞与血管内皮细胞间的黏附,从而促进炎症的发生与发展。SPARC在病理性瘢痕组织中的低表达,提示血管内皮细胞处于激活状态,病理性瘢痕组织中有持续的炎症反应存在,这种持续的炎症反应可能和组织的过度修复、瘢痕增生有关。
SPARC能影响细胞外基质的表达,Thomas等[12]使用博莱霉素诱导的肺纤维化小鼠动物模型来阐述SPARC同胶原蛋白之间的关系及SPARC调控肺纤维化的发展,结果表明无SPARC的小鼠Ⅰ型胶原蛋白含量明显低于野生型小鼠,并进一步指出肺损伤后SPARC和Ⅰ型胶原蛋白同时增加。SPARC在创伤愈合胶原纤维产生中起重要作用,能通过调控Ⅰ型前胶原以调节SPARC与细胞外基质的关系,进而改变创伤的愈合[13-15]。我们推测,在增生性瘢痕和瘢痕疙瘩纤维化进程中,SPARC进行高水平转录,进而翻译成蛋白质,后者刺激组织中成纤维细胞的增殖和以胶原为主的细胞外基质的沉积,增殖的成纤维细胞又会产生更多的SPARC,如此反复循环,最终形成大量的纤维化组织,导致瘢痕增生;SPARC也可能通过各种细胞因子及蛋白酶相互作用来促进胶原蛋白的生成如转化生长因子(TGF)、结缔组织生长因子(CTGF)及热休克蛋白47等[16]。本实验提示,在增生性瘢痕真皮组织中SPARC呈弥散分布,阳性信号表达较低;在瘢痕疙瘩真皮中SPARC呈弥散性散在分布,阳性信号表达较低。这与瘢痕组织真皮层成纤维细胞过度增殖和细胞外基质过度沉积的主要病理改变不相吻合。因此,SPARC在病理性瘢痕的发病机制中起的作用及作用过程,需要通过对病理性瘢痕、正常皮肤来源的成纤维细胞进行离体培养,检测其SPARC分子水平表达的差异情况,来进一步进行深入研究。
[1]Phan E,Ahluwalia A,Tranawski AS.Role of SPARC-matricellular protein in pathophysiology and tissue injury healing.implications for gastritis and gastric ulcers[J].Med Sci Monit,2007,13(2):25-30.
[2]Thomas HB,Gretchen B,Marina C,et al.SPARC regulates extracellular matrix organization through Its modulation of integrinlinked kinase activity[J].J Biological Chemistry,2005,280(43): 36483-36493.
[3]Kazuki N,Shuichi S,Norifumi K,et al.Expression of SPARC byactivated hepatic stellate cells and its correlation with the stages of fibrogenesis in human chronic hepatitis[J].Virchows Arch, 2002,441(5):466-474.
[4]Taneda S,Pippin JW,Sage EH,et al.Amelioration of diabetic nephropathy in SPARC-null mice[J].J Am Soc Nephrol,2003,14 (4):968-980.
[5]Amy DB,Catalin FB,Tyler JR,et al.Role of SPARC in postsynthetic collagen processing in the aging myocardium[J].J Cardiac Failure,2007,13(1):114-123.
[6]Zhou X,Tan FK,Guo XJ,et al.Attenuation of collagen production with small interfering RNA of SPARC in cultured fibroblasts from the skin of patients with scleroderma[J].Arthritis&Rheumatism, 2006,54(8):2626-2631.
[7]Amy DB,May JR,Helene S.SPARC-null mice exhibit accelerated cutaneous wound closure[J].J Histochem&Cytochem,2002,50(1): 1-10.
[8]Berman B,Flores F.The treatment of hypertrophic scars and keloids [J].Eur J Dermatol,1998,8(4):591-595.
[9]Lane TF,Sage EH,1994.The biology of SPARC,a protein that modulates cell-matrix interactions[J].FASEB J,1994,8(2):163-173.
[10]Podhajcer OL,Benedetti LG,Girotti MR,et al.The role of the matricellular protein SPARC in the dynamic interaction between the tumor and the host[J].Cancer Metastasis Rev,2008,27(3): 523-537.
[11]Tai IT,Tang MJ.SPARC in cancer biology:its role in cancer progression and potential for therapy[J].Drug Resist Updat,2008, 11(6):231-246.
12Thomas PS,David KM,Daniel JW,et al.Collagen accumulation is decreased in SPARC-null mice with bleomycin-induced pulmonary fibrosis[J].Am J Physiol,1999,277(3):628-635.
[13]Wang H,Fertala A,Ratner BD,et al.Identifying the SPARC binding sites on collagen I and procollagen I by atomic force microscopy [J].Anal Chem,2005,77(21):6765-6771.
[14]Tyler JR,Felicitta P,Paul B,et al.SPARC regulates processing of procollagen I and collagen fibrillogenesis in dermal fibroblasts [J].J Biological Chemistry,2007,282(30):22062-22071.
[15]Giudici C,Raynal N,Wiedemann H,et al.Mapping of SPARC/ BM-40/osteonectin-binding sites on fibrillar collagens[J].J Biol Chem,2008,283(28):19551-19560.
[16]Martinek N,Shahab J,Sodek J,et al.Is SPARC an evolutionarily conserved collagen chaperone[J]?J Dent Res,2007,86(4):296-305.
The Expression and Significance of Secreted Protein,Acidic and Rich in Cysteine in Hypertrophic Scar and Keloid Tissue
LIU Chaohua,LI Xiaojing,NING Jinlong,WANG Chun.Department of Plastic Surgery,First Affiliated Hospital of Anhui Medical University,Hefei 230022,China.Corresponding author:LI Xiaojing.
ObjectiveTo investigate the expression and significance of Secreted protein,acidic and rich in cysteine (SPARC)in keloid and hypertrophic scar(HS).MethodsTissue samples were harvested from 26 patients with keloid and 26 with HS(3-12 months)and 5 from the skin of healthy adults.All specimens were fixed in 40 g/L formalin.Then the specimens were continuously sliced into 4 μm thick sections.These sections were stained by streptoavidin-biotion method of immunohisto-chemistry.The other groups were normal control(normal skin),positive control(gastric cancerous tissue)and negative control(phosphate buffer)instead of The first antibody.The concentration of Rat anti-human SPARC monoclonal antibody were 1∶200.ResultsThere was scarce expression of SPARC in the skin tissue of healthy adults,and it was only present in the dermal papillae at the dermis epider-mis conjunctions and partly in the blood vessels and skin appendages adjacent to the basement membrane.There was low expression of SPARC in the dermal scar tissue and skin appendages in HS.Also,early expression of hypertrophic scar sputum.There was no significantly difference in the expression between late hypertrophic scar(P>0.05).SPARC showed scattered diffuse distribution as the same in the hypertrophic scar,and the lower expression of positive signals in the keloid.Compared with that in normal skin,there was no significant difference in the SPARC expression between HS and keloid(P>0.05).ConclusionThere was lower SPARC expression in HS(3-12 months), and lower expression in keloid.
Keloid;Secreted protein,acidic and rich in cysteine(SPARC);Hyperplastic scar(HS);Expression
Q786
A
1673-0364(2010)01-0017-04
2010年1月8日;
2010年2月5日)
10.3969/j.issn.1673-0364.2010.01.005
安徽省自然科学基金(070413102)。
230022安徽省合肥市安徽医科大学第一附属医院整形外科。
李小静。

