书 本 实 验
——学生创新思维的平台
高海峰 邱苏霞
(江苏省盱眙中学 江苏 盱眙 211700)
培养学生的创新意识和创新能力是新教材、新课改的基本要求。书本实验,是培养学生创新思维和实践能力的主阵地,所以利用好书本实验尤为重要,努力使之成为学生能力培养的平台。
一、Na与水反应实验
书本实验 钠和水反应,实验现象:浮(钠浮在水面上);游(钠小球在水面上游动);熔(钠融化成亮的小球);嘶(钠与水反应产生嘶嘶声音);红(滴入酚酞试液变红)。为了加深对钠与水反应的理解,笔者和同学们一起探究创新了几个实验:
创新实验一:钠与CuSO4溶液反应
将一块钠放入CuSO4溶液中,结果出人意料,同学们得到实验现象各不相同,总结一下大致可以分为三类。一类:反应相对温和,只产生蓝色沉淀(只列出与水反应不同的实验现象,下同);二类:反应相对剧烈,钠块燃烧,除蓝色沉淀外还有黑色物质生成;三类:剧烈反应,轻微爆炸,除蓝色沉淀,黑色物质外还有红色物质生成。仔细分析,通过实验比较得出结论:钠与CuSO4溶液反应现象不同主要是由钠块的大小引起的。
理论基础 钠与CuSO4溶液反应,可以理解成钠先与水反应,产物与CuSO4,所以产生蓝色沉淀就不难理解了,由于钠块的大小不同反应的剧烈程度不同,钠块燃烧,使Cu(OH)2受热分解生成了黑色的CuO。发生轻微爆炸时,生成的CuO在H2的氛围中被还原成红色的Cu。
原本进行到此已基本结束,但聪明的同学们提出一个问题:CuSO4溶液的浓度不同对反应有没有影响?
对呀,用大小基本相同的块与不同浓度的CuSO4溶液反应现象是否相同呢?于是鼓励同学自己动手加以验证。结果是显而易见的,硫酸铜浓度越大反应越剧烈。
创新实验二:钠与饱和澄清石灰水反应
将一块钠放入饱和石灰水中,同学们很快找出了钠与饱和石灰水反应和钠与水反应现象的不同之处:钠与饱和石灰水反应有白色沉淀生成,但还有很多同学没有观察到这一现象。仔细分析其原因,我们加大了钠的量结果实验现象很明显,通过实验发现钠块控制在黄豆粒大小时实验现象比较明显而且相对比较安全。

二、银镜反应
笔者在做乙醛的银镜反应时同时在五支洁净的试管中做了五组(怕实验不成功)银镜反应实验,结果都不太令人满意,便查阅了大量的资料,对实验做了微妙的改进,现比较如下:
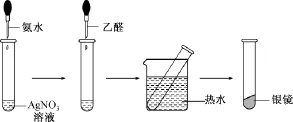
书本实验 在洁净的试管里加入1mL 2%的AgNO3溶液,然后一边振荡试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(这时得到的溶液叫做银氨溶液),再滴入3滴乙醛,振荡后把试管放在热水中温热。实验如图:
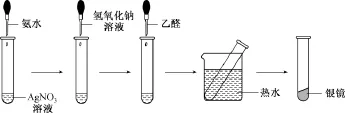
创新实验 在洁净的试管里加入1mL 2%的AgNO3溶液,然后一边振荡试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(这时得到的溶液叫做银氨溶液),再滴2滴5%的NaOH溶液,最后滴3滴乙醛,振荡后把试管放在热水中温热。实验如图:
笔者发现用新做法做成功率非常高,现象很明显。
GMDSS终极现代化阶段将是与现代化通信技术完全吻合的阶段,充分融合数字技术、宽带技术、可移动终端等现代化通信技术。达到准现代化的目标之后并不代表GMDSS停滞不前,通信技术在发展,GMDSS也应该一直向前跟进。GMDSS停滞的30 a已造成自身极大的损失,随着GMDSS准现代化的发展,GMDSS应保持对最先进通信技术的接纳状态,也就是达到与现代通信技术相吻合,并可持续发展时才是GMDSS现代化的终极目标。
理论基础 银镜反应的原理:
CH3CHO +2Ag(NH3)2OH →CH3COONH4+2Ag ↓ +3NH3+H2O
离子反应方程式:CH3CHO+2[Ag(NH3)2]+ +2OH-→CH3COO-+ NH4++2Ag↓+3NH3+H2O
研究银镜反应的原理得出结论如下:
1.乙醛在碱性条件下还原性增强,Ag(NH3)2OH 是强碱。
2.按教材中的做法能制得 Ag(NH3)2OH 吗?我们分析一下银氨溶液中离子的主要成分:
[Ag(NH3)2]+、OH-、NO3-、NH4+,所以银氨溶液配制的方程式应写成:
AgNO3+NH3·H2O=AgOH↓+ NH4NO32NH3·H2O+AgOH=Ag(NH3)2OH+2H2O
Ag(NH3)2OH+NH4NO3=Ag(NH3)2NO3+NH3·H2O
所以溶液的主要成份应为:Ag(NH3)2NO3、NH3·H2O,从而导致溶液的碱性不够,导致实验的频频失败。所以再加2滴5%的NaOH溶液 (不能加氨水,氨水不能过量,过量会生成易爆物质)提高溶液的碱性,更有利于实验成功,即使加入氢氧化钠溶液后溶液不再保持澄清也没有关系,现象同样很好。
三、乙醇催化氧化
书本实验 把卷成螺旋状的铜丝放在酒精灯上加热,待铜丝表面被氧化成黑色的CuO时,保持铜丝红热,迅速插入乙醇中,黑色的CuO立刻又恢复成红色的铜。围绕黑色的CuO变成红色的铜,我带领学生共同拓宽、深究设计了以下几个探究性的创新实验:
创新实验一:把红热的铜丝插入氨气中,CuO会不会被还原成Cu呢?
通过实验,黑色的CuO立刻恢复成紫红色的铜,但有一部分同学没有成功,我们分析了原因,他们增加了铜丝的螺旋密度,结果也出现了紫红色的铜,其原理为:2NH3+3CuO=3Cu+N2+3H2O。
创新实验二:把红热的铜丝插入疏松的NH4Cl固体中,CuO会不会被还原成Cu呢?
我们将红热的铜丝插入到疏松的NH4Cl固体中去,结果现象不明显,后来我们仔细地分析可能的原因,加大了NH4Cl固体的量,把铜丝较深地插入到疏松的NH4Cl固体中,约2min,黑色的CuO被部分地还原成紫红色的铜。
理论基础 NH3在加热的条件下能还原CuO,其原理为:2NH3+3CuO=3Cu+N2+3H2O
NH4Cl受热分解产生 NH3和 HCl,NH3和黑色的CuO发生上述反应。
拓展实验 把红热的铜丝插入疏松的NH4Cl固体中,CuO除了和NH3反应有没有和HCl反应?
把做完实验的铜丝放入盛有少量蒸馏水的烧杯中,发现溶液变成了浅蓝色,这说明在CuO与NH4Cl反应的过程中,CuO不但与NH3,CuO还与HCl反应了。
利用好书本实验这个平台,在培养学生创新意识、创新思维、发散思维等方面有着重要作用,本人只做了一些简单的尝试,和各位同仁一起探讨。

