聚芳酰胺-多壁碳纳米管混合物固定漆酶电极的电化学行为
曾 涵 廖铃文 李明芳 陶 骞 康 婧 陈艳霞
(中国科学技术大学化学物理系,合肥微尺度物质科学国家实验室(筹),合肥 230026)
聚芳酰胺-多壁碳纳米管混合物固定漆酶电极的电化学行为
曾 涵 廖铃文 李明芳 陶 骞 康 婧 陈艳霞*
(中国科学技术大学化学物理系,合肥微尺度物质科学国家实验室(筹),合肥 230026)
以聚芳酰胺-多壁碳纳米管混合物为载体,利用漆酶表面氨基与聚芳酰胺主链端羧基的共价偶联以及碳纳米管与漆酶间的疏水作用,构筑了具有较高稳定性和电催化活性的漆酶修饰电极.并对该固酶修饰电极的固酶量、酶活力、电化学行为及其电催化氧还原的性能进行了表征.对漆酶分子具有亲和力的聚芳酰胺芳环结构及聚芳酰胺端羧基与漆酶表面氨基的共价偶联避免了漆酶的脱落和变性.而碳纳米管与聚芳酰胺的混合使得该三维修饰电极具有良好的电子导电性,并成功地实现了漆酶的氧化还原活性位与电极之间的直接电荷转移,这一点可由在0.73和0.38 V附近观察到漆酶的T1和T2(漆酶的T1,T2铜活性位的形式电位分别为0.78和0.39 V(vs NHE))铜活性位的两对氧化还原峰确认.漆酶的担载量为56.0 mg·g-1,具有电化学活性的漆酶占总担载漆酶量的68%.在pH=4.4磷酸盐缓冲溶液中,该修饰电极上氧气还原的起始电位为0.55 V,其对氧气的米氏常数KM为55.8 μmol·L-1,对氧气的检测限为0.57 μmol·L-1.在4℃下保存两个月后能实现直接电荷转移的漆酶量仅下降了14%左右而氧还原超电势提高了约50 mV.结果表明该修饰电极有望用作酶基生物燃料电池的阴极和电流型氧气传感器.
漆酶;直接电子迁移;氧还原;生物电催化;生物传感器
漆酶(Lac)是一类含铜的多酚氧化酶,能催化氧化许多芳香化合物,同时使氧气还原成水[1].漆酶的活性中心由四个铜离子组成,按照谱学特征分为三组[2]:T1(含有一个接近酶分子疏水表面的铜离子,一般认为这个活性位点是主要的电子受体),T2(含有一个铜离子)和T3位(包含两个铜离子,一般认为氧分子在T2和T3形成的三核铜簇上结合时,通过接受来自T1位的电子并形成水分子).由于漆酶能在较高电位(接近其T1位的形式电位0.78 V vs RHE)下催化氧还原反应,而且氧还原反应速率快,选择性好,因此漆酶被认为是微型生物燃料电池较有潜力的阴极氧还原反应的催化剂[3-6].但是与其它酶催化剂类似,漆酶的活性中心被酶蛋白质骨架包裹,使该活性中心与导电基底间的直接电子迁移不易实现,而且酶修饰电极易受环境因素影响而失去活性,因此构筑能进行电极-酶活性中心间直接电荷迁移,并具有高稳定性以及高漆酶担载量和利用率的漆酶修饰电极是成功实现上述应用的关键,也是近期研究的热点之一[79].
文献报道构筑漆酶修饰电极所采用的方法可大致分为以下几类:i)利用分子导线直接连接电极与漆酶的活性中心[10-11];ii)向电极体系中引入可自由扩散的电荷转移媒介体或将电荷转移媒介以物理吸附或化学偶联作用固定在固酶载体的三维结构中[12-17];iii)以由兼具亲漆酶结构的聚合物以及导电性物质组成的混合物为载体担载漆酶,如将漆酶固定在热敏性水凝胶[18],纳米多孔导电材料中[19]或是将漆酶固定在具有生物亲和力的亲水/亲油分子修饰的导电载体(如碳纳米管或碳微晶体)的三维体相结构中[2021].
其中第一种方法利用分子导线直接将漆酶的活性中心与电极表面导通,其效率在理论上应该最高,但目前对漆酶活性位点的结构及活性位点周围的化学环境的认识并不充分,也很难将漆酶的活性中心如同文献报道[22]的葡萄糖氧化酶那样进行去辅基处理,以达到在电极上进行重构以实现电极与活性中心的直接导通的目的.最近,Armstrong研究小组[10-11]发现以具有强疏水多芳环的稠环芳烃重氮盐修饰的电极可以较稳定地吸附漆酶并促进电子在电极基底和漆酶T1位的氧化还原中心间的迁移,并能在0.9 V(vs RHE)左右实现氧气的电催化还原.但使用的蒽和其它稠环芳烃对环境有较强的污染,其作为电极修饰剂进行推广应用存在一定限制,而且利用该方法只能实现担载在电极表面第一单层的漆酶分子与电极基底之间的有效导通,因此要提高单位面积的电流密度还有待于发展三维的固酶电极.
第二种方法所采用的扩散型媒介体:一方面反应的输出电压受电子媒介体的氧化还原电位所制约,因此选择合适的媒介体非常关键;另一方面,即使在其它条件完全优化后,媒介体的传质步骤很可能成为整个反应的决速步骤,从而限制电极性能的进一步提升.最近报道的采用与高分子骨架以配位键相联的具有可逆氧化还原行为的金属离子络合物作为电子媒介体的漆酶修饰电极其氧还原的起始电位可高达0.78 V,在氧气饱和的溶液中其极限扩散电流密度达到325 mA·cm-2[17].但是该方法存在成本高、使用了有毒的贵金属,制备纯化工艺复杂等缺陷.
第三种方法通过采用多孔导电载体制备三维电极从而大大提高单位面积的固酶量,如果能有效控制漆酶在此三维结构中取向和构型,使之利于漆酶活性中心和导电载体之间的电子迁移,并维持其活性位构象及其疏松多孔性,从而利于反应物如氧气的传输与在活性位的转化,那将最有可能开发出具有高反应活性和稳定性的可实用酶修饰电极.但目前文献报道采用该策略制备的漆酶修饰电极普遍存在不能可控地调控三维多孔载体结构中漆酶的取向以保持其利于电子隧穿以及反应物、产物传质的构型,因此所制备的酶修饰电极还存在氧还原的超电势高,酶电极的长期稳定性不太好等缺点[3,9,20].
多壁碳纳米管(MWCNTs)具有高比表面,较好的导电能力且表面有一定疏水性和生物兼容性,被认为可能是实现酶活性中心和电极之间的直接电子传递的理想导线.但是,对碳纳米管固酶修饰电极的研究表明多壁碳纳米管易于在水溶液中团聚,不但降低载体与漆酶的有效接触表面积,而且增加底物向漆酶活性位传输的位阻,使固定漆酶与底物亲和力下降从而大大降低了其对氧气和其它有机物的催化能力[3,2324],此外,研究表明漆酶与纳米管直接作用时可能导致漆酶的构象变化,使其不利于酶活性中心与电极间的直接电子迁移[3].
本文试图结合第一类和第三类方法的特点,使用具有良好导电性的碳纳米管和对漆酶分子有较好亲和力的聚芳酰胺(PAA)的混合物作为固酶载体(PAA经过脯氨酸处理后在端基接枝了羧基),利用共价偶联、疏水作用来固定云芝漆酶,并将固酶混合物修饰到玻碳电极(GCE)上制成漆酶修饰电极(用Lac/PAA-MWCNTs/GC表示).PAA以对苯二甲酰氯和己二胺为原料缩聚得到,PAA与MWCNTs共混得到PAA-MWCNTs混合物再经脯氨酸处理后,就能得到主链两端都含有羧基的嵌段聚合物.一方面,该混合物中含对漆酶具有亲和力的芳环结构,有助于维持漆酶在电极上利于电子隧穿的构象;另一方面经脯氨酸处理的PAA的两个端基也可与漆酶外表面赖氨酸残基[25]中氨基(至少有四个)形成酰胺键,从而可牢固地固定漆酶;碳纳米管的疏水侧壁和中空管也可物理吸附漆酶分子,因此混合物不但具有更高的固酶载量,而且通过纳米管的中空结构扩大了固定漆酶与底物接触面积,因此固定漆酶与底物的亲和力也会得到相应的改善.多壁碳纳米管的引入,又克服了该嵌段共聚物的电子导电性差的缺点,有可能在不加任何电子媒介体的情况下实现酶活性中心和电极之间的直接电子迁移.以循环伏安法研究了该修饰电极在除氧的磷酸盐缓冲液中的直接电化学特征,考察了此固酶修饰电极氧还原催化能力及其长期稳定性,同时还测定了固定漆酶对底物氧气的亲和力及氧气检测限.研究表明, Lac/PAA-MWCNTs/GC具有良好的稳定性和氧还原催化性能,有望用作酶基生物燃料电池阴极和电流型氧气传感器.
1 实验部分
1.1 化学试剂
对苯二甲酰氯、己二胺、CCl4、NaOH、HCl、脯氨酸、甲醇等试剂均为分析纯,购自国药集团化学试剂有限公司;N-乙基-N'-(3-二甲基氨丙基)碳二亚胺(EDC),N-羟基丁二酰亚胺(NHS)均为分析纯,购自阿拉丁试剂公司(中国);纯化的云芝漆酶(相对分子质量为68000)及相应底物2,6-二甲氧基苯酚(DMP) (分析纯)购自美国Sigma化学试剂有限公司.实验过程中使用的缓冲溶液为0.2 mol·L-1的磷酸二氢钾缓冲液(PBS,pH=4.4),所有溶液均用Milli-Q超纯水配制.多壁碳纳米管(MWCNTs)(直径20-40 nm,长度5-15 μm)购自深圳纳米港有限公司.其他试剂未加说明均为分析纯.
1.2 聚芳酰胺(PAA)的制备
称取1.35 g对苯二甲酰氯,振摇以尽量使对苯二甲酰氯溶解于CCl4中;另称取己二胺0.77 g和NaOH 0.53 g,共用100 mL水将其分别溶解后混合均匀,配成水相,将有机相与水相混合,将反应混合物于磁力搅拌下室温反应4 h,再将生成的聚芳酰胺放入盛有200 mL 1%的HCl水溶液中浸泡后,用水充分洗涤至中性,再用蒸馏水洗后压干,粉碎,80℃真空干燥24 h.
1.3 Lac/PAA-MWCNTs/GC的制备
芳酰胺-多壁碳纳米管固定漆酶复合物的制备过程参见Scheme 1.首先,MWCNTs按文献方法[26]以浓硝酸处理后使用,然后将5 mg经纯化处理过的MWCNTs与5 mg PAA缩聚物,1.5 mL无水甲醇的水溶液(甲醇和水的体积比为1:3),75 mmol·L-1EDC-15 mmol·L-1NHS混合液400 μL在磁力搅拌下共混6 h,得到一黑色粘稠悬浊液.在20℃,7000 r·min-1的转速下离心分离(德国Sigma 2K15型高速离心机)将上层清液倒去,以磷酸盐缓冲液冲洗黑色粘稠物以除去表面上吸附的EDC-NHS分子,重复前述步骤3次,最后得到为PAA与MWCNTs的混合物PAA-MWCNTs.接着向体系中加入1.5 g·L-1脯氨酸溶液,并对该混合物溶液磁力搅拌20 min后于室温静置6 h,将上清液除去并再次向体系中加入75 mmol·L-1EDC-15 mmol·L-1NHS混合液400 μL以活化PAA上主链两端接枝的脯氨酸残基上的羧基,室温下静置6 h后倒去上清液,用PBS清洗黑色粘稠的复合物3次,以除去体系中剩余的EDC和NHS,得到端羧基活化的PAA主链两端接枝脯氨酸(proline)的修饰PAA,用pro-g-PAA-MWCNTs表示.抽取400 μL 1.1 g·L-1漆酶(溶解于PBS)与400 μL上述pro-g-PAA-MWCNTs共混,磁力搅拌30 min后放在4℃冰箱中过夜保存.将混合液中上层清液倾去,以PBS清洗悬浊液3次以除去在固酶基元上吸附不牢的漆酶分子.所制备的黑色粘稠液平时储存于4℃冰箱中.吸取15 μL上述黑色粘稠液体滴涂在玻碳电极表面,4℃下干燥后得到固定漆酶修饰电极,即Lac/PAA-MWCNTs/GC.
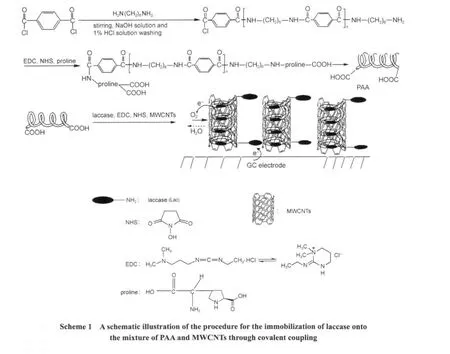
1.4 漆酶复合物中漆酶担载量以及固酶比活力的测定
聚芳酰胺-多壁碳纳米管复合物固定漆酶量按照文献方法[27]测定,以石墨炉原子吸收法(Analyst 800型原子吸收光谱仪,美国Perkin-Elmer公司,主机:双光束火焰/石墨炉原子吸收分光光度计,光谱范围:190-870 nm)测定复合物固定漆酶载量,由于每个漆酶分子含有四个铜离子,故可以通过下述公式计算漆酶固定百分率:
漆酶固定百分率=[(加入漆酶的含铜量-未固定漆酶的含铜量)/加入漆酶的含铜量]×100%
固定漆酶担载量=[(漆酶母液浓度×母液体积×漆酶固定百分率)/固酶复合物载体质量]×100%
复合物固定漆酶的比活力测定参照文献方法[19,25]进行,将制备的固酶复合物与3 mL pH为4.4的PBS缓冲液和100 μL的10 mmol·L-1DMP混合液共混1 min后,迅速移取上清液到比色皿中并测定溶液中DMP氧化产物2,6-二甲氧基苯醌在470 nm处的吸光度(U-2810型紫外可见分光光度计,日本岛津公司,比色皿厚度1 cm),记录吸光度对时间的关系曲线.2,6-二甲氧基苯醌的摩尔吸光系数为49600 L·mol-1·cm-1[19],定义酶活力单位为1 min内氧化1 μmol DMP所需要漆酶的量.
1.5 Lac/PAA-MWCNTs/GC修饰电极的电化学行为表征及氧还原能力测试
采用常规三电极电解池进行电化学实验.Lac/ PAA-MWCNTs/GC(GC,直径6 mm,购自天津艾达恒晟工贸有限公司)作为工作电极.玻碳电极使用前先用3500#砂纸打磨,然后依次用1.0、0.5 mm粒径的氧化铝粉浆抛光,然后再用丙酮和超纯水超声清洗各两次,每次2-3 min.对电极为铂片电极,参比电极为Ag/AgCl电极,电化学测量在CHI-1140A型电化学分析仪(CHI Inc,上海辰华)上进行.实验中磷酸盐缓冲液不断通入超纯N2(南京特气)除氧.本文中的所有电势都是相对于标准氢参比电极,所有的循环伏安曲线(CV)均经过 IR补偿.在 Lac/ PAA-MWCNTs/GC的氧还原催化实验中,不断向PBS溶液中通O2(南京特气)15 min以使PBS为氧气饱和.测试温度:(25.0±0.4)℃,在此温度下PBS中氧气的饱和浓度为1.1 mmol·L-1[6],而空气饱和的PBS中氧气浓度为260 μmol·L-1[17].计时电流法测定氧气浓度的实验在含有不同浓度氧气的PBS溶液中进行,这一系列不同氧气浓度的PBS缓冲液由通氮除氧的PBS缓冲液中加入不同体积的空气饱和的PBS缓冲液制得.氧还原反应的电压恒定在0.35 V.
2 结果与讨论
2.1 漆酶在PAA-MWCNTs上的担载量和固定漆酶的比活力
实验测得聚芳酰胺-多壁碳纳米管复合物固定漆酶的百分率为63.6%,漆酶担载量为56.0 mg·g-1,固定漆酶的比活力为1.18 U·mg-1.较文献报道[25]的(共价偶联法固定漆酶)纳米多孔金的固酶量(16.0 mg· g-1)和漆酶比活力(0.83 U·mg-1)高很多.除了前述的聚芳酰胺基元主链两侧的羧基可以与漆酶分子表面赖氨酸基团中的氨基发生化学偶联[25]之外,聚芳酰胺主链的疏水芳环[10-11],碳纳米管的疏水侧壁与漆酶分子间的良好相容性[3,10]也可能是复合物基元具有高固定漆酶量和高固酶比活力的原因之一.
2.2 Lac/PAA-MWCNTs/GC修饰电极的直接电化学行为
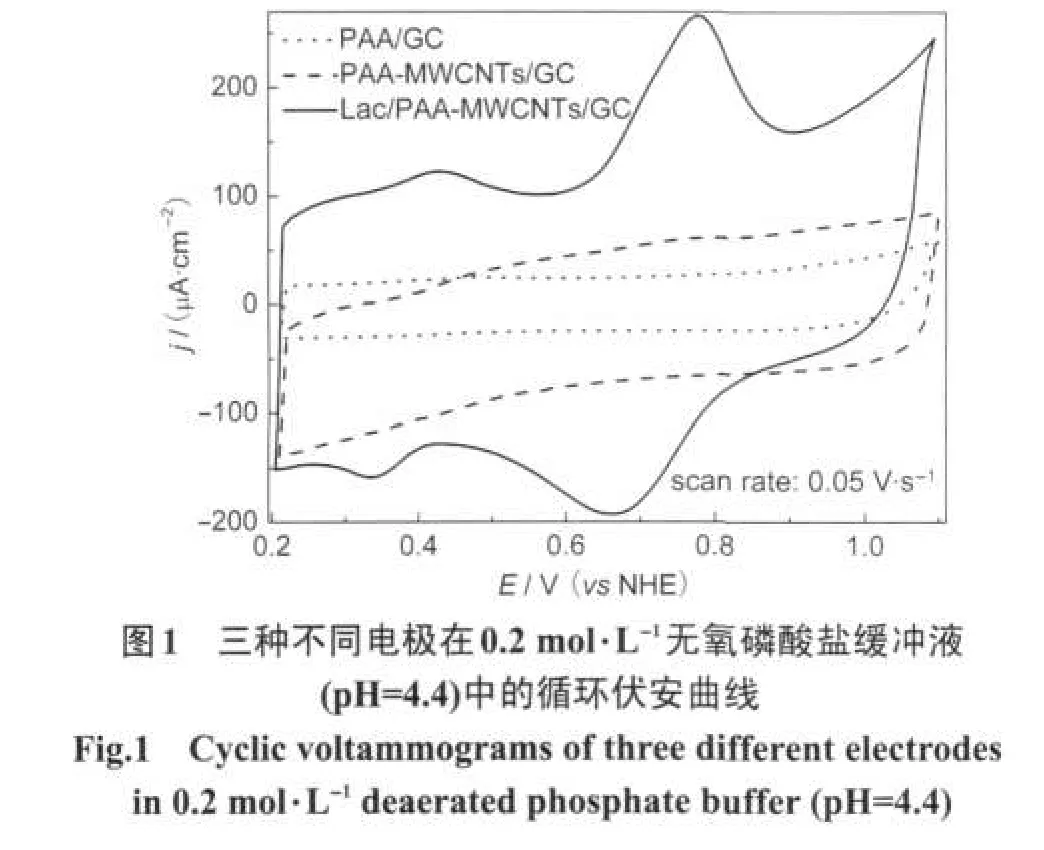
图1中的实线为Lac/PAA-MWCNTs/GC修饰电极在无氧PBS中的循环伏安曲线.从图1中可以看出:在正向扫描过程中分别在0.78和0.43 V出现两个氧化峰;而在逆向扫描过程中所对应的还原峰分别在0.68和0.33 V出现.对照实验表明,在除氧PBS缓冲液中,纯聚芳酰胺修饰的GCE电极(PAA/GC)在给定的扫描电位区间内没有出现任何氧化还原峰(图1点线);在以聚芳酰胺与碳纳米管混合物修饰的GC电极(PAA-MWCNTs/GC)上也未观察到任何氧化还原峰(图1虚线),而偶联漆酶的聚芳酰胺修饰玻碳电极由于缺乏导电粒子以致于几乎观察不到任何氧化还原峰(图不再给出).另外,文献报道[3]碳纳米管直接吸附漆酶后修饰GC电极也没有观察到任何氧化还原信号.这两对氧化还原峰的平均值分别为0.73和0.38 V,与文献[5]报道的漆酶T1和T2活性中心的形式电位(分别是0.78和0.39 VvsNHE)接近,根据上述事实我们推断这两对氧化还原峰可能分别来自漆酶活性中心T1和T2位铜离子的氧化还原.说明在固定漆酶的PAA与多壁碳纳米管混合物修饰的玻碳电极上实现了云芝漆酶与电极表面之间的直接电子转移,无需加入任何电子中介体.
从图1中Lac/PAA-MWCNTs/GC电极在PBS缓冲液中CV曲线,依据其氧化还原峰的积分面积以及下述公式可以求算出该修饰电极上具有电化学活性的漆酶的担载量Γ*(mol·cm-2):
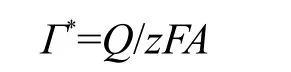
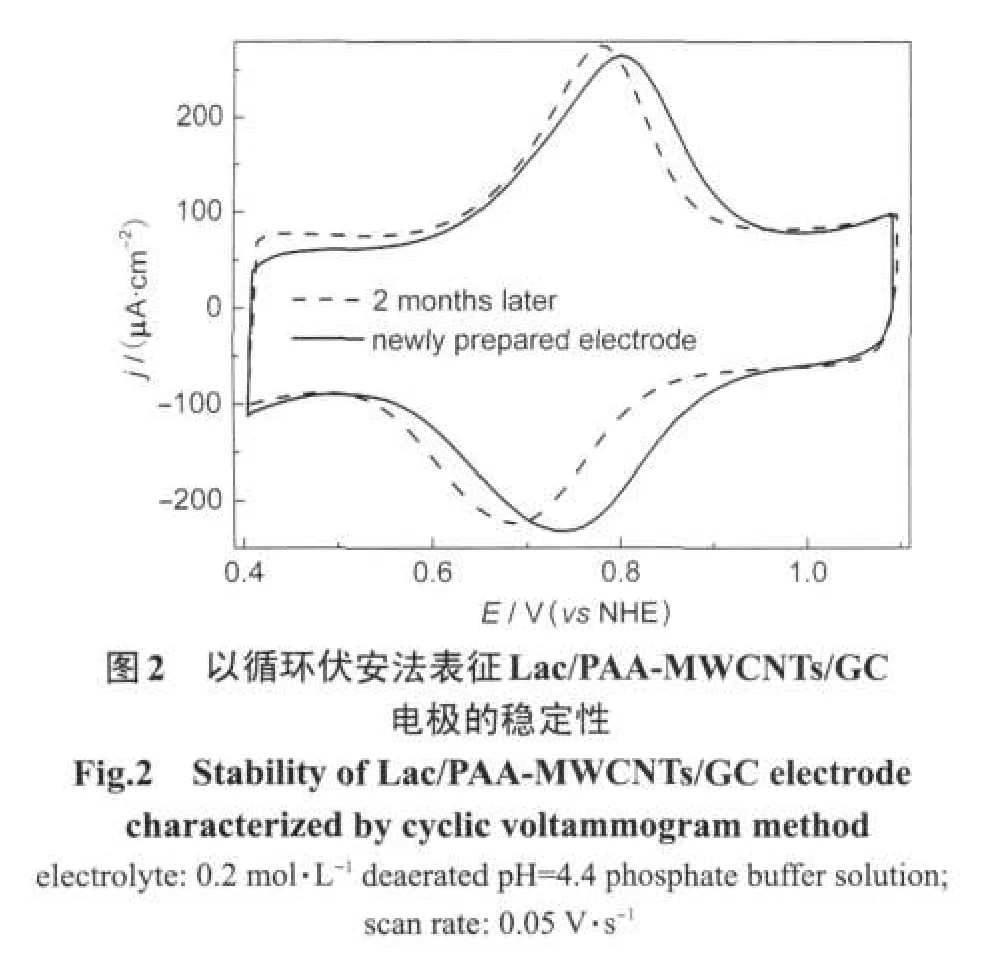
其中Q为位于0.73 V的氧化还原峰的电量(扣除双层充电电量),z按文献报道[5,19]的漆酶活性结构及催化机制可设定传递电子数为1,F为法拉弟常数,A为电极的几何表面积,为0.283 cm2.由此计算得出的Lac/PAA-MWCNTs/GC上漆酶的平均覆盖度为6.3×10-9mol·cm-2.这个数值比理论上漆酶在电极表面单分子层吸附的量(约4.64×10-12mol·cm-2,以漆酶的最大横截面积为35.8 nm2估算)[25]要高得多,大约相当于1350单层漆酶紧密堆积在电极表面,较文献报道[19]的纳米多孔金固定漆酶的覆盖率(2.1× 10-11mol·cm-2)高了两个数量级.这也与前述以石墨炉原子吸收法测定复合物固定漆酶载量较高的结论相一致.此外根据漆酶在载体上的担载量,固酶载体质量(3.2 mg)及Lac/PAA-MWCNTs/GC上漆酶的平均覆盖度,电极的几何面积(0.283 cm2)和漆酶的相对分子质量为68000[25,28],可以计算出具有电活性的漆酶分子占固定漆酶分子总数的百分数为67.6%.图2为Lac/PAA-MWCNTs/GC组装后和于4℃下存放两个月后于无氧磷酸盐缓冲液中测试得到的循环伏安曲线.从图2中可以看出Lac/PAAMWCNTs/GC在组装后立即在无氧磷酸盐缓冲液测得的CV(图2实线)和4℃下存放两个月后再于无氧磷酸盐缓冲液中测得的CV(图2虚线)形状相似,峰电流大体不变,只是峰电位负向移动了大约50 mV.这表明:Lac/PAA-MWCNTs/GC修饰电极的低温下长期保存仍然具有相当程度的稳定性(由峰面积求算得到的具有电活性的漆酶分子是电极新制备时的86%).
2.3 Lac/PAA-MWCNTs/GC修饰电极的氧还原催化性能及催化稳定性表征
在Lac/PAA-MWCNTs/GC上有效地实现电子在电极与复合物固定漆酶的活性中心间直接迁移的基础上,我们进一步研究了该固酶修饰电极对氧气的电催化还原的性能.图3是Lac/PAA-MWCNTs/ GC在除氧(点线),空气饱和(虚线)和氧气饱和(实线)的磷酸盐缓冲液中的循环伏安曲线.从图3中可以看出在磷酸盐缓冲液中,无论溶液为空气饱和还是被氧气饱和,Lac/PAA-MWCNTs/GC的氧还原都始于0.55 V,氧还原电流密度都随着电极电势的负移和氧浓度的增加而增加,并在0.35 V附近达到极限扩散电流.比文献报道的纳米多孔金固定漆酶电极的氧还原起始电位正移了约0.1 V[19].与文献报道[18]的聚异丙基丙烯酰胺水凝胶固定漆酶修饰ITO电极相比(在峰出现位置相近的情况下),氧化还原峰更明显,峰形更好.但与近来Armstrong等[10-11]利用稠环芳烃重氮盐固定漆酶修饰热解石墨电极的氧还原起始电位0.9 V相比低了约0.35 V,与最近文献报道的含锇基配体的氧化还原聚合物固定漆酶的氧还原起始电位[17]相比低了约0.3 V.
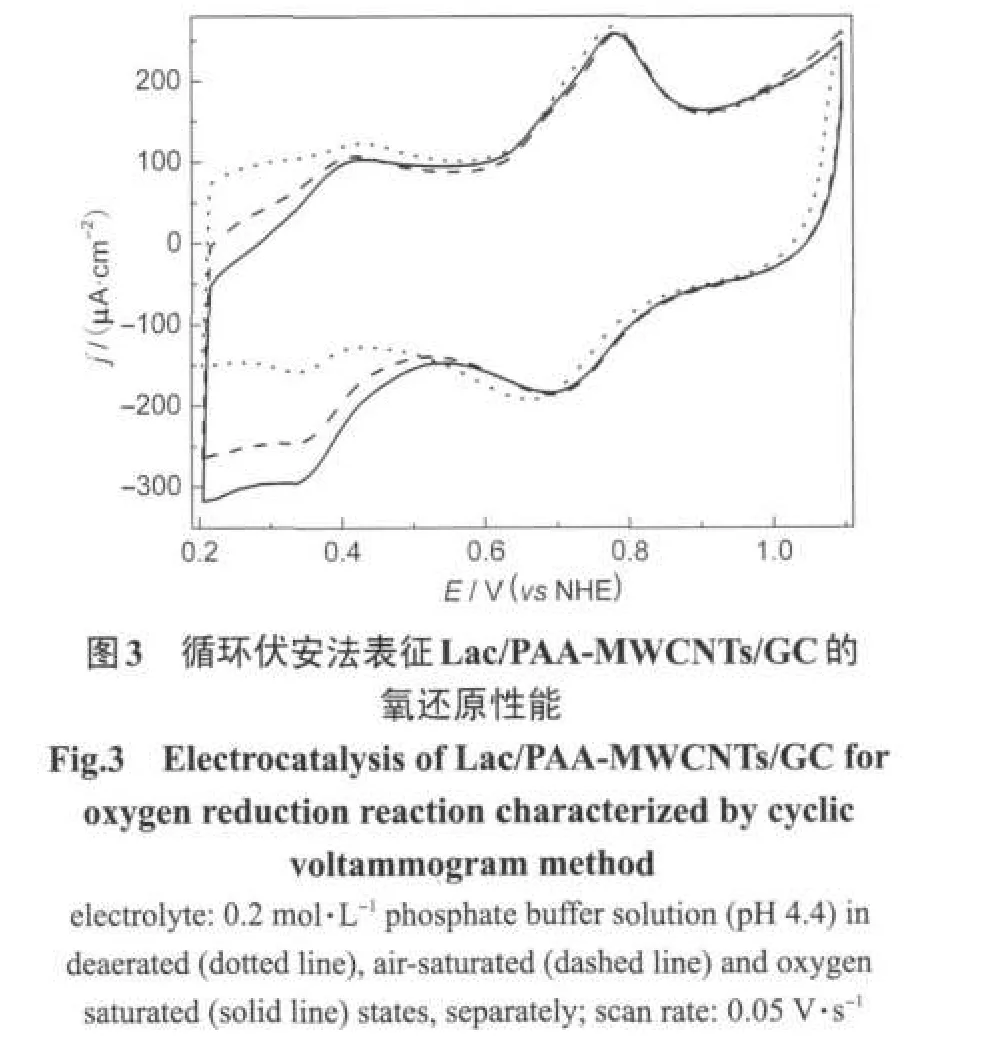
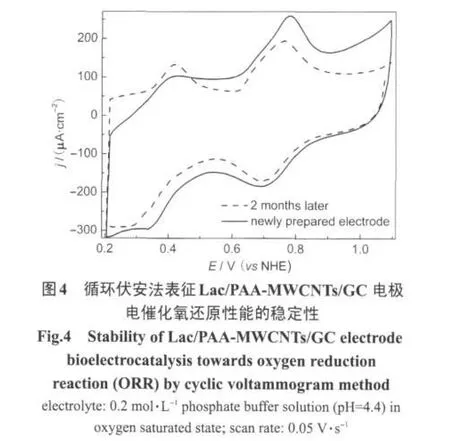
图4是Lac/PAA-MWCNTs/GC电极催化氧气还原的稳定性测试,从图中可以看出该电极的氧还原催化的稳定性较好,在4℃下保存2个月后催化氧还原的超电势仅负移了大约50 mV.
从氧还原的起始电位和不同氧浓度下催化还原电流的响应来看,尽管制备Lac/PAA-MWCNTs/ GC修饰电极中酶的担载量高,而且所担载的酶中其活性中心能与电极间直接发生电荷转移的酶的比例高达70%,但是该电极还存在着氧还原电流随O2的浓度增加不太明显的缺陷.从空气饱和的溶液到氧气饱和的溶液,氧气的浓度提高了约5倍,氧还原的极限电流却仅提高了1.5倍.这可能是由于覆盖在电极上的固酶复合物基元过厚,对氧气传质形成一定的障碍.本文还对Lac/PAA-MWCNTs/GC的重复使用性进行了研究,实验结果表明:此固酶修饰电极在氧气饱和的0.2 mol·L-1磷酸盐缓冲液(pH=4.4)中重复使用8次后氧还原的峰电位没有发生变化,氧还原极限电流仍然可以达到初次使用时的85%左右(图不再给出),优于文献[25]报道的纳米多孔金固定漆酶在类似体系中的重复使用性(固定漆酶的活力在重复使用8次后仅为初始活力的大约65%).
尽管本文制备的此种固酶修饰电极的氧还原的超电势较高,氧气的传质阻力大,但利用本方法制备酶修饰电极不需使用复杂的制备和纯化工序、对环境有害的稠环芳烃或重金属络合物以及昂贵的电子中介体,因此该修饰电极与前述性能较高的酶修饰电极而言仍然具有一定的优势.因此,下一步我们将尝试通过采用改善聚合物结构(例如改变聚合物形貌,增大比表面积以及进一步对聚合物结构改性增加侧链上可键合漆酶分子的官能团数目),减小氧气和其它底物在固酶基元修饰层中传质阻力,改善固酶基元与底物亲和力的方法来提高其电催化性能.
2.4 Lac/PAA-MWCNTs/GC修饰电极作为氧传感器测定氧气的浓度
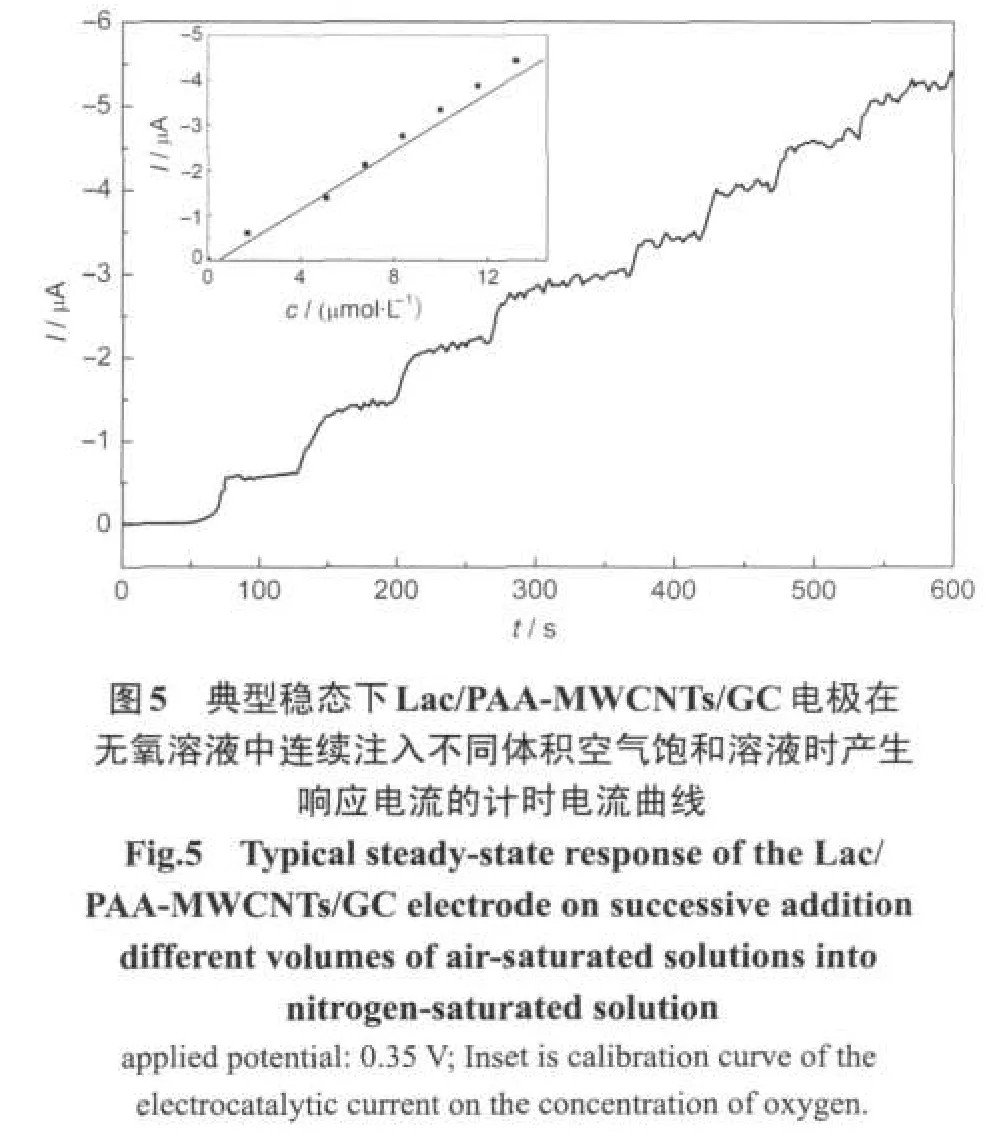
图5是Lac/PAA-MWCNTs/GC电极在无氧溶液中连续注入不同体积空气饱和溶液时产生响应电流的计时电流曲线.从图5中可以看出(从文献[7]可知:实验温度下空气饱和水溶液中氧气浓度可以设定为260 μmol·L-1):在氧气浓度从1.7-13.2 μmol·L-1的范围内,催化电流与氧气浓度成线性关系.氧气浓度检测限为0.57 μmol·L-1(S/N=3),其检测下限不到文献报道[6]的纳米管-壳聚糖固定漆酶氧传感器的氧气浓度检测限7.8 μmol·L-1的十分之一,而且无需加入中介体;由Lineweaver-Burk曲线(浓度倒数-催化电流倒数)可以推算KM=55.8 μmol· L-1,较文献报道[6]的纳米管-壳聚糖固定漆酶氧传感器的KM=3.22 mmol·L-1低得多.
3 结论
利用共价偶联成功制备了Lac/PAA-MWCNTs/ GC电极,通过石墨炉原子吸收法和分光光度法表征了酶在PAA-MWCNTs复合物上的担载量以及固定漆酶的比活力.并以电化学方法(循环伏安,计时电流法)表征了此电极的电化学行为和氧还原催化性能.研究表明:PAA-MWCNTs复合物固定漆酶的量较高且固定漆酶具有较高的比活力;Lac/ PAA-MWCNTs/GC电极在不含任何电子中介体的无氧磷酸盐缓冲液中能够实现酶活性中心与导电基体间的直接电子迁移,而且相当部分的固定漆酶具有电活性,此种固酶修饰电极具有较好的重复使用性和长期稳定性;在含氧溶液中,酶修饰电极生物电催化氧还原始于0.55 V,在大约0.35 V达到极限扩散电流.该电极对氧的检测限低至不足1 μmol·L-1,同时具有较高的氧亲和力,说明同时采用含有大比表面纳米结构的导电基体和对漆酶有兼容性的材料(与漆酶活性中心性质匹配或是具有能与漆酶活性中心邻近部位的基团发生化学键合的官能团)为载体固定漆酶,有望开发出高效的酶催化生物燃料电池的阴极以及电流型氧传感器,这方面的工作还在进行之中.
致谢: 本文特在此向中国科学技术大学化学物理系张广照教授及其研究小组给予的技术帮助和资金支持表示衷心的感谢.
1 Xu,F.Biochemistry,1996,35:7608
2 Piontek,K.;Antorini,M.;Choinowski,T.J.Biol.Chem.,2002,277: 37663
3 Zheng,W.;Li,Q.F.;Yan,Y.M.;Zhang,J.;Mao,L.Q. Electroanalysis,2006,18:587
4 Yarapolov,A.I.;Kharybin,A.N.;Emneus,J.;Marko-Varga,G.; Gorton,L.Bioelectrochem.Bioenerg.,1996,40:49
5 Shleev,S.;Kasmi,A.E.;Ruzgas,T.;Gorton,L.Electrochem. Commun.,2004,6:934
6 Liu,Y.;Qu,X.H.;Guo,H.W.;Chen,H.J.;Liu,B.F.;Dong,S.J. Biosensors&Bioelectronics,2006,21:2195
7 Rahman,M.A.;Noh,H.B.;Shim,Y.B.Anal.Chem.,2008,80:8020
8 Tarasevich,M.R.;Bogdanovskaya,V.A.;Kuznetsova,L.N.Russ.J. Phys.Chem.,2001,37:969
9 Stolarczyk,K.;Nazaruk,E.;Rogalski,J.;Bileswicz,R. Electrochimica Acta,2008,53:3983
10 Blanford,C.F.;Heath,R.S.;Armstrong,F.A.Chem.Commun.,2007: 1710
11 Blanford,C.F.;Foster,C.E.;Heath,R.E.;Armstrong,F.A.Faraday Discuss.,2008,140:319
12 Farneth,W.E.;Diner,B.A.;Gierke,T.D.;D'Amore,M.B. J.Electroanal.Chem.,2005,581:190
13 Katz,E.;Sheeney-Haj-Ichia,L.;Willner,I.Angew.Chem.Int.Edit., 2004,43:3292
14 Barriere,F.;Ferry,Y.;Rochefort,D.;Leech,D.Electrochem. Commun.,2004,6:237
15 Ohara,T.J.;Rajagopalan,R.;Heller,A.Anal.Chem.,1993,65:3512
16 Trudeau,F.;Daigle,F.;Leech,D.Anal.Chem.,1997,69:882
17 Ackermann,Y.;Guschin,D.A.;Eckhard,K.;Shleev,S.;Schuhmann, W.Electrochem.Commun.,2010,12:640
18 Klis,M.;Karbarz,M.;Stojek,Z.;Rogalski,J.;Bilewicz,R.J.Phys. Chem.B,2009,113:6062
19 Qiu,H.J.;Xu,C.X.;Huang,X.R.;Ding,Y.;Qu Y.B.;Gao,P.J. J.Phys.Chem.C,2008,112:14781
20 Stolarczyk,K.;Nazaruk,E.;Rogalski,J.;Bilewicz,R.Electrochem. Commun.,2007,9:115
21 Fei,J.F.;Song,H.Y.;Palmore,G.T.R.Chem.Mater.,2007,19(7): 1565
22 Katz,E.;Willner,I.;Kotlyar,A.B.J.Electroanal.Chem.,1999,479: 64
23 Karnicka,K.;Miecznikowski,K.;Kowalewska,B.;Skunik,M.; Opallo,M.;Rogalski,J.;Schuhmann,W.;Kulesza,P.J.Anal.Chem., 2008,80:7643
24 Liu,Y.;Wang,M.K.;Zhao,F.;Xu,Z.A.;Dong,S.J.Biosensors& Bioelectronics,2005,21:984
25 Qiu,H.J.;Xu,C.X.;Huang,X.R.;Ding,Y.;Gao,P.J.J.Phys. Chem.C,2009,113:2521
26 Liu,J.;Rinzler,A.G.;Dai,H.J.;Hafner,J.H.;Bradley,R.K.;Boul, P.J.;Lu,A.;Iverson,T.;Shelimov,K.;Huffman,C.B.; Rodriguez-Macias,F.;Shon,Y.S.;Lee,T.R.;Colbert,D.T.;Smalley, R.E.Science,1998,280:1253
27 Huang,J.;Zhou,J.Y.;Xiao,H.Y.;Long,S.Y.;Wang,J.T.Acta Chimica Sinica,2005,63(14):1343 [黄 俊,周菊英,肖海燕,龙胜亚,王军涛.化学学报,2005,63(14):1343]
28 Ivanov,I.;Vidakovic-Koch,T.;Sundmacher,K.Energies,2010,3:803
Poly Aryl Amide and Multiwalled Carbon Nanotube Composite Supported Laccase Electrode and Its Electrochemical Behavior
ZENG Han LIAO Ling-Wen LI Ming-Fang TAO Qian KANG Jing CHEN Yan-Xia*
(Hefei National Laboratory for Physical Sciences at Microscale,Department of Chemical Physics, University of Science and Technology of China,Hefei 230026,P.R.China)
A novel strategy for the immobilization of laccase onto a glassy carbon electrode with high stability and electrocatalytic performance is presented.Laccase is attached to a matrix of mixed poly aryl amide(PAA)and multiwalled carbon nanotubes(MWCNTs)(denoted Lac/PAA-MWCNTs/GCE)by covalently bonding the surface amine group of laccase to the terminal carboxyl group of PAA and hydrophobic-hydrophobic interaction between MWCNTs and the laccase.The PAA backbone avoids the detachment and denaturing of the laccase,and the intermixed MWCNTs provide high electronic conductivity. The loading of laccase is 56.0 mg·g-1and more than 68%shows electrochemical activity.The electrode delivers direct electron transfer between the redox center of the laccase and the electrode with two pairs of redox peaks at 0.73 and 0.38 V,which is close to the formal potential of the T1and T2Cu-sites(0.78 and 0.39 V(vs NHE)),respectively.The onset potential for O2reduction reaction(ORR)is ca 0.55 V in a phosphate buffer solution(pH=4.4).The Michaelis constant(KM)of the Lac/PAA-MWCNTs/GEs for O2is 55.8 μmol·L-1and the detection limit of oxygen reaches 0.57 μmol·L-1.After 2 months of storage at 4°Cthe ORR activity of the Lac/PAA-MWCNTs/GC electrode retains ca 86%of its initial values and the peak potential of the ORR shifts negatively by ca 50 mV.Given the excellent catalytic performance towards ORR and its high stability this strategy will be widely applicable to the development of an enzyme-based cathode for biofuel cells and amperometric biosensors for oxygen.
Laccase; Direct electron transfer; Oxygen reduction reaction; Bioelectrocatalysis; Biosensor
O646;O629.8
Received:July 7,2010;Revised:September 3,2010;Published on Web:October 29,2010.
∗Corresponding author.Email:yachen@ustc.edu.cn;Tel:+86-551-3601511.
The project was supported by the National Natural Science Foundation of China(20773116)and National Outstanding Young Scientists Foundation of China(20474060).
国家自然科学基金(20773116)和国家杰出青年基金(20474060)资助项目
ⒸEditorial office ofActa Physico-Chimica Sinica

