冰糖橙胚状体、胚性愈伤组织的诱导及植株再生
蔡小东,廖 伟
(长江大学园艺园林学院,湖北 荆州 434025)
冰糖橙胚状体、胚性愈伤组织的诱导及植株再生
蔡小东,廖 伟
(长江大学园艺园林学院,湖北 荆州 434025)
以冰糖橙(Citrussinensis)成熟果实中未发育胚珠为外植体,以MT为基本培养基,通过添加不同种类植物生长调节剂(ZT、GA3、BA、IAA以及2,4-D)、麦芽浸出物(ME)或AgNO3,诱导胚状体、胚性愈伤组织,并进行了植株再生研究。结果表明:不同培养基不仅影响胚状体的诱导率,而且影响诱导胚状体的类型;MT培养基有利于诱导出球型胚状体,MT+1.0 mg/L GA3+ 500 mg/L ME培养基有利于诱导子叶形胚状体;不同类型的胚状体在不同培养基中胚性愈伤组织发生的频率不同,球形胚状体和MT+0.5 mg/L IAA+0.1 mg/L ZT培养基最有利于胚性愈伤组织的诱导,球形胚状体接种于此培养基上胚性愈伤组织的发生率高达40%。这些胚状体经过生芽和生根培养,再生了大量完整植株。
冰糖橙(Citrussinensis);胚珠;胚状体;胚性愈伤组织
柑橘胚性愈伤组织不仅可以作为种质资源保存[1]、无病毒苗木培育[2,3]的原始材料,还广泛应用于原生质体培养和融合[4,5]以及遗传转化等研究中。因此,建立冰糖橙胚性愈伤组织诱导及再生体系,通过转化或体细胞杂交等方法进行冰糖橙品种的遗传改良,或通过胚性愈伤组织培育无病毒苗,在冰糖橙生物技术研究中具有重要的意义。虽然冰糖橙胚性愈伤组织的诱导已有报道[6],但随着继代次数的增加和保存时间的延长,愈伤组织的胚胎发生能力会下降,并且存在变异[7,8]。因此,有必要诱导新鲜的冰糖橙胚性愈伤组织,用于柑橘生物技术育种。
目前,通常以幼嫩的珠心组织、实生苗的下胚轴或成熟果实中的未发育胚珠等为外植体,诱导产生大量的胚性愈伤组织[1,6,7,9,10]。本研究以冰糖橙成熟果实中未发育胚珠为外植体,进行胚性愈伤组织的诱导和植株再生,通过探讨不同培养基配方、培养条件等对未发育胚珠胚性愈伤组织、胚状体发生率的影响,以找到较适合冰糖橙成熟果实中未发育胚珠诱导胚性愈伤组织的适合方法。
1 材料与方法
1.1 材料
供试材料为冰糖橙(Citrussinensis)成熟果实。在超净工作台上将果实浸泡在75%酒精中约8 min后,用镊子取出并用酒精灯外焰灼烧30~60 s。接着将果实放入已灭菌的培养皿(内放有多张滤纸)中剥开果皮,去掉果肉后可发现囊衣内紧靠中柱处有许多长约1.5~2.5 mm未发育胚珠,用尖嘴镊子将这些末发育胚珠轻轻挑下备用。
1.2 培养基及培养条件
以MT为基本培养基,通过添加不同种类的植物生长调节剂(ZT、GA3、BA、IAA以及2,4-D)、麦芽浸出物 (ME) 或AgNO3,共设计4种用途共12种培养基 (表1)。其中培养基A~I用于胚性愈伤组织诱导,培养基J为胚状体增殖培养基,培养基K为胚状体生芽培养基,培养基L为诱导芽生根培养基。所有培养基的pH均调至5.8,胚性愈伤组织诱导及增殖采用暗培养,其余均在光照周期14 h/8 h条件下培养,培养温度均为24~26 ℃。
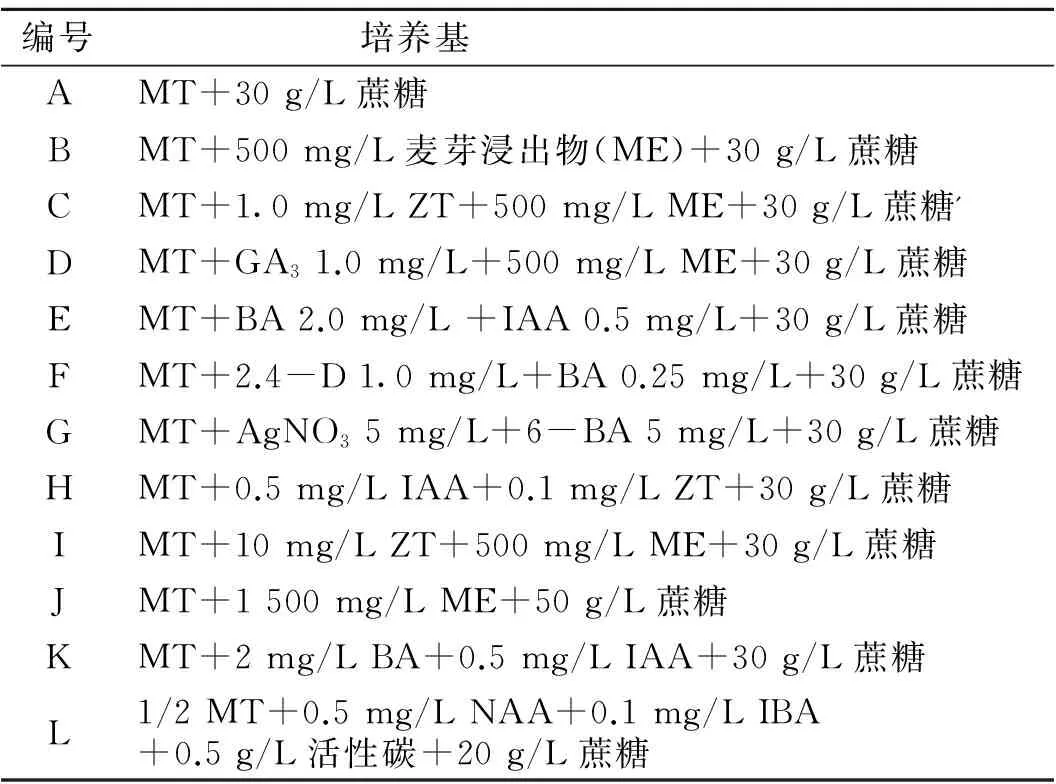
表1 培养基配方Table 1 The composition of induction media
1.3 胚性愈伤组织和体细胞胚胎的诱导
将冰糖橙未发育胚珠分别接种于上述培养基A、B、C、D、E中,每个处理培养10~11瓶,每瓶接种5个外植体,60 d后对胚性愈伤组织及胚状体的诱导频率进行统计。将获得的胚状体分别转至培养基A、B、F、G、H、I中以诱导胚性愈伤组织,每个处理接种5瓶,每瓶接种5个胚状体,45 d后对胚性愈伤组织的诱导率进行统计。再生的胚性愈伤组织转至未添加任何激素和附加物的培养基A进行增殖培养。
1.4 植株再生
将部分胚状体转至培养基J进行增殖培养,使其体积进一步增大,发育到子叶期的胚状体转移至培养基K上诱导生芽,将芽转接至培养基L上诱导生根。
2 结果与分析
2.1 胚状体的再生
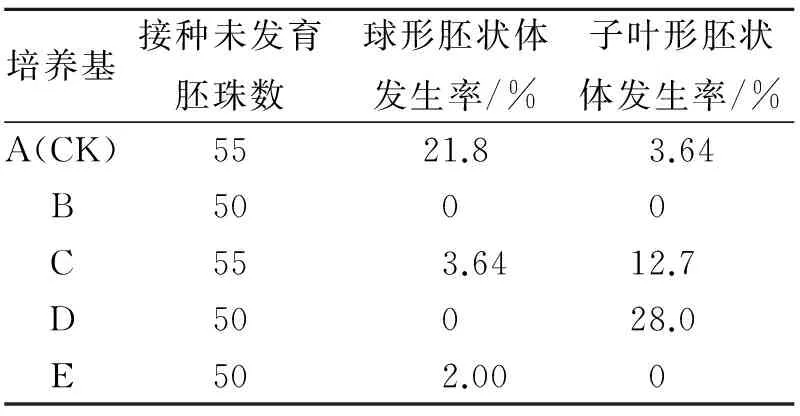
表2 不同培养基上胚状体的诱导率Table 2 The regeneration percentage of embryoids cultured on different media
将冰糖橙成熟果实中未发育胚珠接种于上述培养基A、B、C、D、E中,暗培养60 d后,结果如表2所示,5种供试培养基中除培养基B外其它4种都能诱导胚状体的再生(表2)。培养基A和C既能诱导球形胚状体的产生,也出现了子叶形胚状体。在这5种培养基中,培养基A中球形胚状体的诱导率为21.8%;培养基D中子叶形胚状体诱导率高达28%;培养基E中只观察到球形胚状体。但是,在胚状体的再生过程中,都未发现有胚性愈伤组织的出现。这些胚状体继续在原培养基上培养30 d后,有次生胚状体发生,大部分表现畸形。图1A所示为A培养基中再生的球形胚状体,且再生了许多次生胚状体,由于暗培养这些胚状体呈淡黄色。图1B所示为培养基中C中再生的子叶形胚状体。培养基D中个别胚状体甚至再生了根(图1C)

A.球形胚状体 B.子叶形胚状体 C.生根胚状体 图1 胚状体再生Figure 1 Embryoid regenration
2.2 胚性愈伤组织的诱导

图2 从球形胚状体诱导出的胚性愈伤组织Figure 2 Embryogenic callus induced from globular embryoids
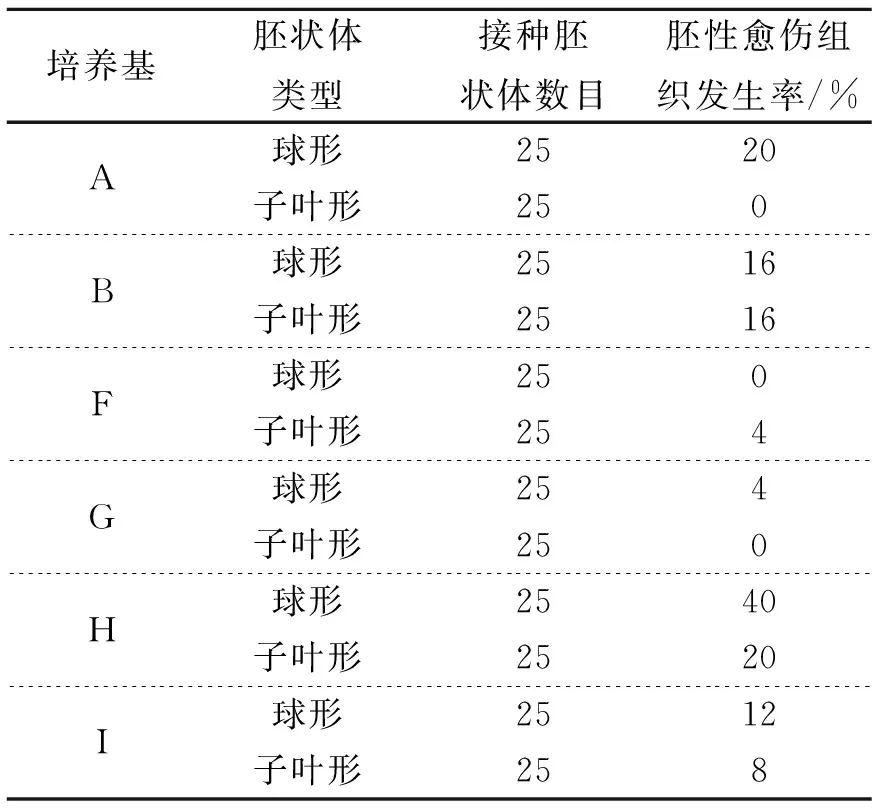
培养基胚状体类型接种胚状体数目胚性愈伤组织发生率/%ABFGHI球形2520子叶形250球形2516子叶形2516球形250子叶形254球形254子叶形250球形2540子叶形2520球形2512子叶形258
为获得冰糖橙胚性愈伤组织,本研究将上述球形胚状体和子叶形胚状体分别转移至新鲜胚性愈伤组织诱导培养基A、B、F、G、H、I中。暗培养45 d后,这些胚状体形成了大量次生胚状体,部分三角瓶出现乳白色、质地疏松的胚性愈伤组织,且部分胚状体出现了玻璃化现象。图2所示为培养基B中再生的胚性愈伤组织。胚性愈伤组织的诱导情况如表3所示。从表3可以看出,培养基B、H、I既能诱导球形胚状体产生胚性愈伤组织,也能诱导子叶形胚状体产生胚性愈伤组织;培养基A、G只能诱导球形胚状体产生胚性愈伤组织;培养基F只能诱导子叶形胚状体产生胚性愈伤组织。球形胚状体在培养基H上诱导率最高,高达40%;子叶形胚状体在培养基H上的诱导率也高达20%。
2.3 胚状体和胚性愈伤组织的增殖
将部分子叶形胚状体转移到培养基J上进行增殖培养,在光照条件下培养15 d后,子叶形胚状体逐渐变绿,有次生胚状体的产生,30 d后胚状体体积明显增大。少数胚状体萌发了小芽(图3A)。球形胚状体在黑暗中培养,30 d后体积明显增大,也有次生胚状体的产生(图3B)。胚性愈伤组织转移到未添加激素的A培养基中增殖,黑暗中培养,25 d左右出现大量颗粒小、乳白、质地疏松的胚性愈伤组织,少部分分化出胚状体(图3C)。
2.4 胚状体生芽及生根
将增殖培养后的部分胚状体转移到培养基K中诱导芽的再生,光照培养45 d后大部分都长出绿色芽,部分长出丛芽。切下分化出的1~2 cm长的芽,接种到培养基L中,光照培养1个月后所有芽均生根,叶色浓绿,根淡黄色。
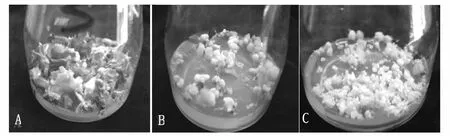
A增殖的子叶形胚状体 B增殖的球形胚状 C. 增殖30 d后的胚性愈伤组织图3 从球形胚状体诱导出的胚性愈伤组织Figure 3 Embryogenic callus induced from globular embryoids
3 讨论
前人研究表明,培养基中既添加500 mg/L麦芽提取物和GA3有利于柑橘未发育胚珠胚性愈伤组织的诱导[6]。而本研究结果却与之有差异:添加500 mg/L麦芽提取物和l mg/L GA3的培养基D并不能促进胚性愈伤组织的诱导,只能促进胚状体的发生,并且出现的都是子叶形胚状体;培养基B不仅没有诱导出胚性愈伤组织,而且也没出现胚状体。生长素类物质部分或完全抑制体细胞胚胎发生[11],培养基E中胚状体发生率低可能与BA和IAA浓度较高有关。在诱导胚性愈伤组织的过程中,添加AgNO3的培养基G并不能促进胚性愈伤组织的形成,这与范永梅等[12]的研究结果相一致。在愈伤组织的增殖过程中,会有小部分分化出胚状体,并且时间的越长分化出的胚状体就越多。吕柳新等[9]认为产生体细胞胚胎的多少与培养基中的蔗糖质量浓度密切相关。
本研究结果表明,胚状体可直接由成熟果实的未发育胚珠产生,并能在以后的培养中不断增殖,这说明未发育胚珠里的胚原基具有良好的胚胎发生潜力,并且可以由胚状体诱导胚性愈伤组织。它是研究柑桔柑橘原生质体培养和融合中利用生物技术进行品种改良和种质资源保存,以及无病毒苗木培育的良好试材。此外,研究中还发现培养基A中的胚状体培养35 d后大部分都会变成水渍状,这可能与胚状体培养中的一些生理生化指标相关,需要进一步的研究。
[1]霍合强,邓秀新.宽皮柑橘品种的胚性愈伤组织诱导[J].实验生物学报,1999,32(3):289~295.
[2]谭祖国,万蜀渊.朋娜和纽贺尔脐橙胚珠离体培养获得无病毒珠心苗方法研究[J].湖北农业科学,1998,38(4):43~45.
[3]董高峰,李耿光,张兰英,等.柑桔无病原体苗培育研究进展[J].广西植物,2001,21(1):53~58.
[4]Grosser J W,Ollitrault P,Olivares-Fuster O. Somatic hybridization inCitrus:An effective tool to facilitate variety improvement[J]. In Vitro Cell Dev Biol- Plant,2000,36:434~449.
[5]Cai X D,Fu J,Chen C L,etal. Cybrid/hybrid plants regenerated from somatic fusions between male sterileSatsumamandarinand seedy tangelos[J]. Sci Hortic,2009,122:323~327.
[6]范永梅,甘 霖,邓秀新.冰糖橙胚性愈伤组织的诱导与植株再生[J].华中农业大学学报2003,22(4):399~402
[7]霍合强,邓秀新.柑桔胚性愈伤组织的诱导、保存和利用[J].植物生理学通讯,2000,36(2):181~187.
[8]张俊娥,邓秀新.柑橘愈伤组织植株再生及其倍性鉴定[J].华中农业大学学报,2007,26(2):237~238.
[9]吕柳新,林顺权.3种柑橘亚科植物的珠心组织培养[J].福建农林大学学报(自然科学版),2003,32(1):193~195.
[10]张秀枝.红江橙与柠檬愈伤组织诱导的研究[J].广西农业科学,2008,39(1):6~11.
[11]Jimenez V M,Guevara E,Herrera J,etal. Endogenous hormone levels in habituated nucellarCitruscallus during the initial stages of regeneration [J]. Plant Cell Rep,2001,20:92~100.
[12]范永梅,李东栋,甘 霖,等.硝酸银对冰糖橙胚性愈伤组织诱导的影响[J].湖南农业大学学报(自然科学版),2003,29(4):338~340.
2010-01-12
国际科学基金(International Foundation for Science,IFS)项目(D/4756-1)
蔡小东(1978-),男,湖北浠水人,农学博士,讲师,主要从事园艺植物生物技术育种研究
10.3969/j.issn.1673-1409(S).2010.01.014
Q813.1
A
1673-1409(2010)01-S056-04

