吉西他滨和丝裂霉素联合应用对人肺癌细胞A549的作用
赵可新 李军霞 姜杉 王伟刚 胡建平 单靖珊
吉西他滨和丝裂霉素联合应用对人肺癌细胞A549的作用
赵可新 李军霞 姜杉 王伟刚 胡建平 单靖珊
目的观察吉西他滨和丝裂霉素联合应用对人肺癌细胞A549的抑制效应,并探讨其作用机制。方法 用MTT法检测化疗药物对人肺癌细胞A549生长的抑制作用;流式细胞术(FCM)检测细胞周期分布和凋亡率。结果 (1)丝裂霉素和吉西他滨单独和联合用药可浓度依赖性抑制A549细胞的生长。(2)丝裂霉素和吉西他滨在合用72 h后,当Fa>0.18时,丝裂霉素和吉西他滨合用指数CI均<1,两种药物之间是协同作用,当Fa<0.18时,合用指数CI大于1,两种药物之间为拮抗作用。(3)丝裂霉素和吉西他滨同时用药时抑制率最高,其次是先用丝裂霉素后用吉西他滨,抑制率最低是先用吉西他滨后用丝裂霉素。(4)丝裂霉素和不同浓度的吉西他滨合用,除与2.5 μg/ml吉西他滨合用时CI>1外,其余均<1。10 μg/ml吉西他滨和不同浓度的丝裂霉素合用,除与0.0625 μg/ml合用时CI>1外,其余均<1。(5)丝裂霉素和吉西他滨单用和合用时对细胞周期和凋亡均有影响。结论 丝裂霉素和吉西他滨单独和联合用药可浓度依赖性抑制A549细胞的生长。不同用药次序和药物浓度比例也影响药物联合作用。
吉西他滨;丝裂霉素;人肺癌A549;中效原理
肿瘤是一群失去正常生长调控机制,发生恶性转化的自身细胞,其在人群中发病率高,全世界每年死于恶性肿瘤的患者高达数百万人[1],人们提出了多种治疗方法包括手术治疗、放疗、化疗、免疫治疗等,其中化学治疗仍是主要的治疗方式,但是化学治疗也受到选择性低、不良反应大、耐药性等因素的限制,为了避免上述的缺点,采用合理的联合用药方式对肿瘤的治疗更具潜力。然而采用哪些药物,剂量怎么搭配等以往多凭经验。由于抗肿瘤药物的疗效差异很大,不同组织类型肿瘤对同一种药物反应不一致。因此在化疗前进行抗癌药物敏感性测试,用中效原理定量分析各抗癌药物之间的协同、相加、拮抗作用,将为临床正确部署抗癌药物联合化疗方案提供有价值的参考[2]。凋亡受阻是肿瘤发生的主要原因,诱导肿瘤细胞分化和凋亡是许多化疗药物抑制肿瘤细胞生长的主要机制之一,另外,对于细胞周期的干扰也是许多化疗药物主要的作用机制[3,4]。本实验中,我们利用中效原理研究了丝裂霉素和吉西他滨联合用药方式对培养的人肺癌细胞系A549的作用以及对细胞周期和凋亡的影响。
1 材料与方法
1.1 材料与仪器 酶标仪(德国BMG公司);恒温CO2培养箱(Kendro公司);电子天平(日本Olympus公司);倒置显微镜(江苏富华仪器厂);恒温水浴箱(Thermo Forma公司);超低温冰箱(VILBER LOURMAT公司);VD-1320型洁净工作台(哈尔滨市东联电子技术发展有限公司);Millipore纯水机(美国Millipore公司)。
1.2 药品 RPMI-1640培养基(Gibco公司);胰酶(Gibco公司);青霉素(华北制药集团公司);链霉素(华北制药集团公司);胎牛血清(Gibco公司);DMSO(Sigma公司);胎盘蓝(哈尔滨誉衡药业有限公司);吉西他滨(江苏恒瑞医药股份有限公司);丝裂霉素(浙江海正药业股份有限公司)。
1.3 实验用细胞系 人肺癌A549细胞株由河北医科大学病
理教研室惠赠,河北医科大学药理教研室传代培养。
1.4 方法
1.4.1 细胞培养:人肺癌A549细胞置于含10%小牛血清、100 U/ml青霉素及100 U/ml链霉素,pH值为7.2~7.4的RPMI-1640培养液中,于37℃,5%CO2和饱和湿度的培养箱中常规培养。1~2 d传代1次。
1.4.2 细胞毒的测定:取对数生长期的A549细胞制备细胞悬液,计数后用1640培养基调细胞浓度为1×105个/ml。按100 μl/孔接种于96孔板,待细胞贴壁6 h后,轻轻吸去上清,分别加入所需浓度药物200 μl,同时设不含药物的阴性对照孔。每浓度设6孔,继续培养72 h,在取样前4 h加入MTT(浓度为 5 g/L,用0.1mol/LPBS 配制)20 μl,继续培养4 h,轻轻弃去上清,每孔加入150 μl DMSO,微量振荡器振荡10 min,结晶物充分溶解后,酶标仪上测每孔的570 nm的OD值(OD570)。通过下列公式计算细胞生长抑制率(Fa):生长抑制率=(实验组OD570值-对照组OD570值)/对照组OD570值。
吉西他滨药物浓度为 2.5,5.0,10.0,20.0,40.0 μg/ml;丝裂霉素药物浓度为 0.0625、0.125、0.25、0.5、1.0 μg/ml;吉西他滨+丝裂霉素联合用药组药物浓度为逐一联合应用,分别为2.5+0.0625、5.0+0.125、10.0+0.25、20.0+0.5、40.0+1.0 μg/ml。
研究不同药物浓度依赖关系时,采用丝裂霉素0.25 μg/ml和不上述同浓度的吉西他滨合用,采用10 μg/ml吉西他滨和上述不同浓度的丝裂霉素合用。
1.4.3 中效剂量(Dm)及合用指数(CI)的计算:2个参数的计算参考文献[5]。
1.4.4 流式细胞术检测细胞周期分布和凋亡率:收集丝裂霉素组、吉西他滨组和联合用药组培养72 h后A549细胞,胰酶消化后,离心去上清,加PBS将细胞打匀,转入EP管中,再次离心去上清,加入预冷70%乙醇固定1 h,PBS洗2次,将等体积的细胞悬液和PI染液混合,4℃放置30min,混合液过300目尼龙网除去杂质,上机检测。
2 结果
2.1 丝裂霉素和吉西他滨单独和联合用药可依据浓度依赖性抑制A549细胞生长情况 丝裂霉素在0.0625~1 μg/ml药物浓度范围内,用药后72 h时抑制率增加到10.8% ~46.7%,IC50是1.07 μg/ml(表 1、2和图 1)。吉西他滨在 2.5~40 μg/ml药物浓度范围内,用药后72 h,抑制率增加到7.4% ~47.5%。IC50是49.62 μg/ml(表1、2和 图2)。联合应用丝裂霉素和吉西他滨后,在2.5625~41 μg/ml药物浓度范围内,用药后72 h时抑制率增加到 15.0% ~81.1%。IC50为9.68 μg/ml,其 中 含 丝 裂 霉 素 0.23 μg/ml 和 吉 西 他 滨9.45 μg/ml。见表 1、2 和图 3。
表1 丝裂霉素和吉西他滨单独和联合用药72 h后对人肺癌A549细胞的作用n=6,±s
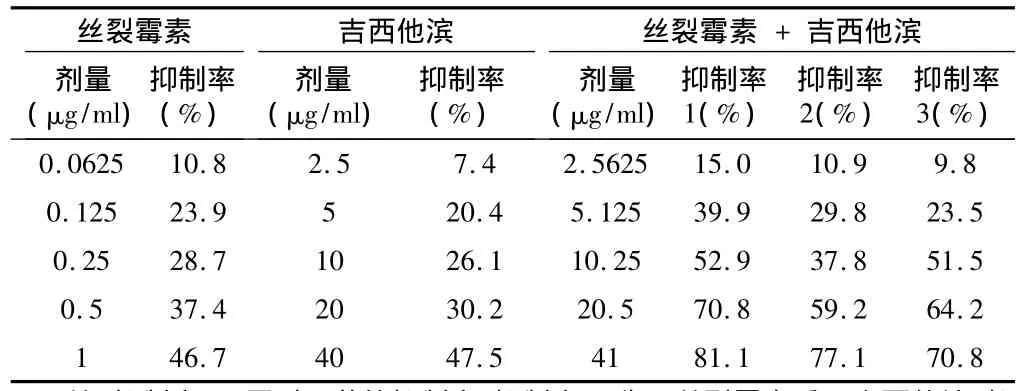
表1 丝裂霉素和吉西他滨单独和联合用药72 h后对人肺癌A549细胞的作用n=6,±s
注:抑制率1:同时用药的抑制率;抑制率2:先用丝裂霉素后用吉西他滨;抑制率3:先用吉西他滨后用丝裂霉素时的抑制率
丝裂霉素 +丝裂霉素剂量(μg/ml)抑制率(%)吉西他滨剂量(μg/ml)抑制率(%)吉西他滨剂量(μg/ml)抑制率1(%)抑制率2(%)抑制率3(%)0.0625 10.8 2.5 7.4 2.5625 15.0 10.9 9.8 0.125 23.9 5 20.4 5.125 39.9 29.8 23.5 0.25 28.7 10 26.1 10.25 52.9 37.8 51.5 0.5 37.4 20 30.2 20.5 70.8 59.2 64.2 1 46.7 40 47.5 41 81.1 77.1 70.8
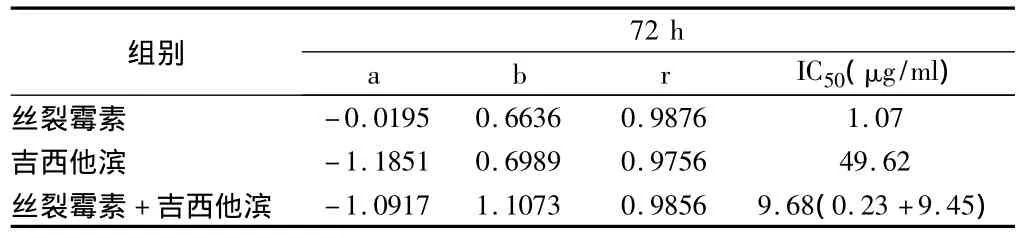
表2 丝裂霉素和吉西他滨单独和联合用药的相关系数(r)、斜率(b)、截距(a)和半数有效浓度(IC50)
图1 吉西他滨对A549肿瘤细胞生长的抑制作用
联合用药72 h后,丝裂霉素的IC50从单用的1.07 μg/ml降低到合用的0.23 μg/ml,降低了78.5%。吉西他滨的IC50从单用的49.62 μg/ml降低到9.45 μg/ml,降低了 81.0%。无论是丝裂霉素还是吉西他滨在合用后IC50均明显降低。
2.2 丝裂霉素和吉西他滨联合用药时的合用指数CI 在合用72 h后,当Fa>0.18时,丝裂霉素和吉西他滨合用指数CI均小于1,两种药物之间是协同作用,当Fa<0.18时,合用指数CI大于1,两种药物之间为拮抗。见表3、图4。
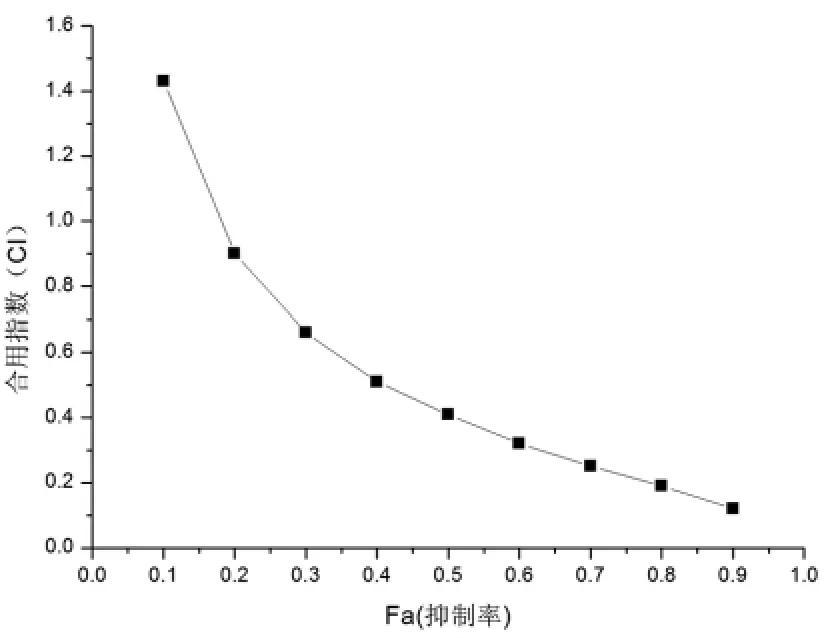
图2 吉西他滨和丝裂霉素联合用药时在不同抑制率下的合用指数
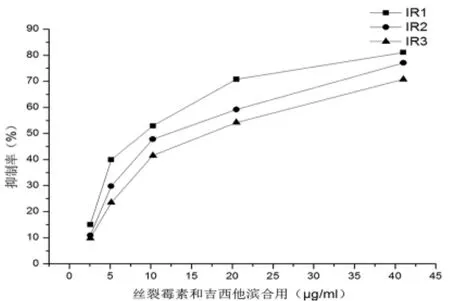
图3 丝裂霉素和吉西他滨联合用药对人肺癌A549细胞的作用

表3 丝裂霉素和吉西他滨联合用药时在不同抑制率下的合用指数
2.3 丝裂霉素和吉西他滨用药时间先后次序依赖关系 丝裂霉素和吉西他滨同时用药时抑制率最高,其次是先用丝裂霉素,抑制率最低是先用吉西他滨。见表1、图3。
2.4 丝裂霉素和吉西他滨合用时不同药物浓度依赖关系 丝裂霉素 0.25 μg/ml和不同浓度的吉西他滨合用,除与2.5 μg/ml合用时 CI>1 外,其余均 < 1.10 μg/ml,吉西他滨和不同浓度的丝裂霉素合用,除与0.0625 μg/ml合用时CI>1外,其余均<1。见表4。
2.5 丝裂霉素和吉西他滨单用或合用时对细胞周期和凋亡的作用 对照组细胞周期各比例分别为:G2/M期22.0%,G0/G1期59.6%,S期6.2%。应用0.25 μg/ml丝裂霉素后,G0/G1期和S期降低到21.5%和17.5%,G2/M期细胞比例升高到69.6%,凋亡率增加到15.9%。应用10 μg/ml吉西他滨后,G0/G1和G2/M期降低到53.8%和19.1%,S期细胞比例升高到27.2%,凋亡率升高24.7%。联合用药后,G0/G1和G2/M期细胞比例降低到53.6%和12.9%,S期细胞比例升高到33.3%,凋亡率升高44.7%。见表5、图5。
3 讨论
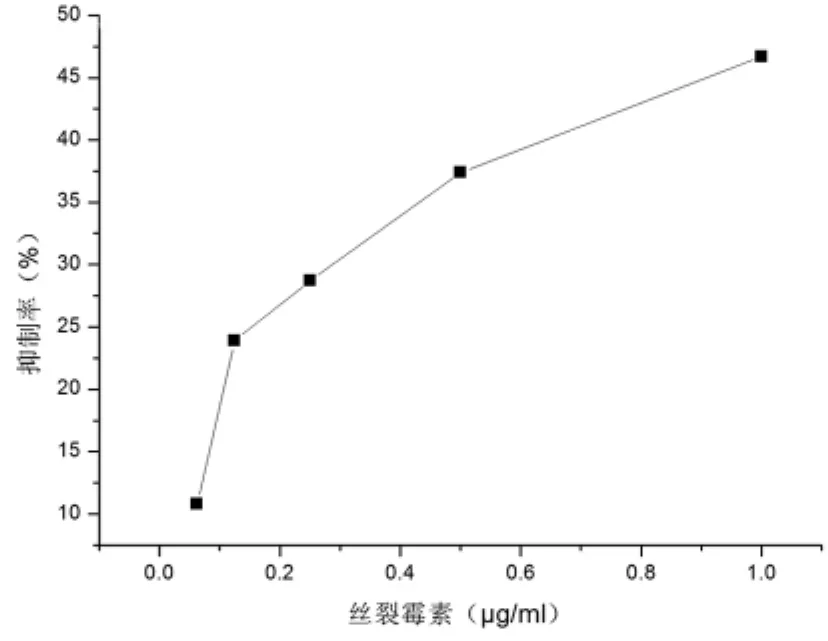
图4 丝裂霉素对A549肿瘤细胞生长的抑制作用
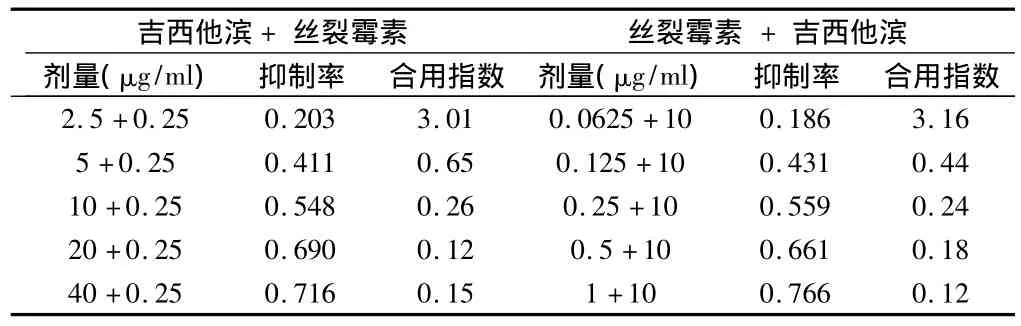
表4 丝裂霉素和吉西他滨不同剂量联合用药时的抑制率和合用指数
表5 丝裂霉素和吉西他滨单独或联合用药对A549细胞凋亡率和细胞周期分布的作用n=5,±s
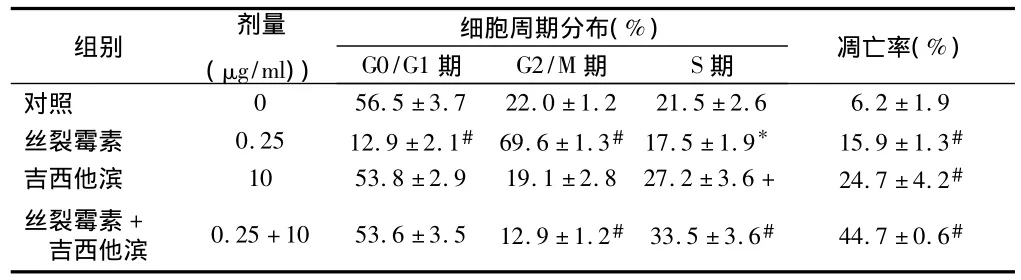
表5 丝裂霉素和吉西他滨单独或联合用药对A549细胞凋亡率和细胞周期分布的作用n=5,±s
注:与对照组比较,*P <0.05,*P <0.01
细胞周期分布(%)组别 剂量(μg/ml))G0/G1期 G2/M期 S期 凋亡率(%)对照0 56.5±3.7 22.0±1.2 21.5±2.6 6.2±1.9丝裂霉素 0.25 12.9±2.1# 69.6±1.3# 17.5±1.9* 15.9±1.3#吉西他滨 10 53.8±2.9 19.1±2.8 27.2±3.6+ 24.7±4.2#丝裂霉素+吉西他滨 0.25+10 53.6±3.5 12.9±1.2# 33.5±3.6# 44.7±0.6#
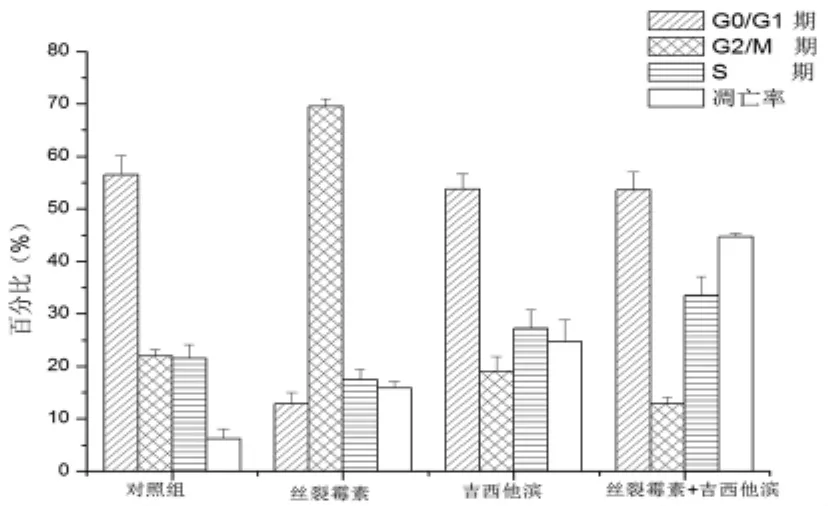
图5 丝裂霉素和吉西他滨单独或联合用药对A549细胞凋亡率和细胞周期分布的作用
由于肺癌没有有效的普查方法,患者在确诊时已属中晚期,手术治疗的可能性极低,因此,化疗成为延长肺癌患者生命的重要方法之一,而肺癌单药化疗疗效较差,且不良反应明显,合理的联合用药可减轻药物毒性而疗效不减[6]。在本实验中,我们研究了丝裂霉素和吉西他滨联合用药对人肺癌A549细胞的作用,丝裂霉素是一种烷化剂抗癌药,它的两个烷化中心可与DNA形成交叉连接,使细胞中DNA解聚,抑制DNA复制,还可引起DNA单链断裂[7]。我们也用流式细胞术检测了丝裂霉素对细胞周期和凋亡率的影响,流式细胞术是一种检测细胞周期和凋亡的确实可靠的实验方法[8],结果表明,丝裂霉素可浓度依赖性抑制肿瘤细胞的生长,与其使A549细胞停滞于G2/M期,诱发细胞凋亡有关。
吉西他滨是一种新型的脱氧胞苷类似物和核苷还原酶抑制剂,对多种实体瘤具有良好的抗肿瘤活性,是一种药物前体,被细胞摄入后,在细胞内转变为活性代谢物吉西他滨二磷酸酯或三磷酸酯,可竞争性抑制DNA链的延长,导致DNA片段形成和细胞死亡,发挥细胞毒作用[9,10]。我们的研究结果显示,吉西他滨可浓度依赖性抑制肿瘤细胞的生长,其机制与吉西他滨诱发细胞凋亡有关。
联合应用丝裂霉素和吉西他滨后,对A549细胞的抑制率明显高于单独用药时,丝裂霉素和吉西他滨的IC50与单独用药相比也均明显降低。通过对CI的分析也表明,当Fa>0.2时,丝裂霉素和吉西他滨之间呈现协同作用,<0.2时,呈现拮抗作用。这种化疗药物小剂量联合呈现拮抗,大剂量出现协同的现象也曾有报道[11]。联合应用丝裂霉素和吉西他滨后,A549细胞明显阻滞于S期,而且凋亡率明显增加。
丝裂霉素和吉西他滨给药次序不同也影响结果,研究结果表明,两种药物同时用药时,对肿瘤细胞A549的抑制率最高,其次是先用丝裂霉素,这可能与先用细胞非周期性药物杀死处于非增殖期的细胞(G0),然后用细胞周期特异性药物增强疗效有关[12]。
顺铂的作用似烷化剂,主要作用靶点为DNA,干扰DNA的复制,属于细胞周期时相非特异药物,只要细胞处于活化的细胞周期,药物就能起作用。随着药物作用时间的延长,活化期的细胞可被逐渐杀灭,而且处于静止期(G0)的细胞活化后进入细胞周期也可被药物杀灭[13]。我们的研究结果显示,顺铂可浓度依赖性抑制肿瘤细胞的生长,其机制与其阻滞细胞于G2/M期和诱发细胞凋亡有关。
吡柔比星是半合成的蒽环类抗癌药,进入细胞核内迅速嵌入DNA核酸碱基对间,干扰转录过程,阻止mRNA合成,抑制DNA聚合酶以及DNA拓扑异构酶Ⅱ活性,干扰DNA合成[14]。我们的研究结果显示,吡柔比星可浓度依赖性抑制肿瘤细胞的生长,其机制与其阻滞细胞于S期和诱导细胞凋亡有关。
联合应用吡柔比星和顺铂后,对A549细胞的抑制率明显高于单独用药时,吡柔比星和顺铂的IC50均比单独用药时均明显降低。通过对CI的分析也表明,吡柔比星和顺铂之间呈现协同关系。联合应用吡柔比星和顺铂后,可阻滞细胞于S期,细胞凋亡率也明显增加。
吡柔比星和顺铂给药次序不同也影响结果,两种药物同时用药时,对肿瘤细胞A549的抑制率最高,不同吡柔比星和顺铂浓度比例对细胞的抑制率也有明显的影响。
从本实验中,我们可以看到,小剂量联合应用化学药物可明显提高疗效;但是,两药合用并非药物浓度越大越好,适宜的浓度比例关系也是联合用药时需要考虑的因素。
丝裂霉素和吉西他滨单独或联合用药可浓度依赖性抑制A549细胞的生长。在合用72 h后,当Fa>0.18时,两种药物之间是协同作用,当Fa<0.18时,两种药物之间为拮抗。合用时不同用药次序和药物浓度比例也影响药物联合作用。所有药物的作用均与其诱导凋亡和影响细胞周期有关,但对细胞周期的影响各不相同。
1 郑东庆,薄挽澜,梁桃.三氧化二砷对人肺癌A549细胞凋亡及耐药基因表达的影响.中国基层医药,2010,17:7-8.
2 Nair SK,Verma A,Thomas TJ,et al.Synergistic apoptosis of MCF-7 breast cancer cells by 2-methoxyestradiol and bis(ethyl)norspermine.Cancer Lett,2007,250:311-322.
3 Hannun AH.Apoptosis and the dilemma of cancer chemotherapy.Blood,1997,89:1845-1853.
4 Glinsky GV,Glinsky VV,Ivanova AB,et al.Apoptosis and metastasis:increased apoptosis resistance of metastatic cancer cells is associated with the profound deficiency of apoptosis execution mechanisms.Cancer Lett,1997,115:185-193.
5 赵可新,李军霞,姜杉,等.吉西他滨和依托泊苷联合应用对人卵巢癌3AO细胞系的作用.中国医院用药评价与分析,2008,8:526-530.
6 Mortenson MM,Schlieman MG,Virudachalam S,et al.Effect of the proteasome inhibitor bortezomib alone and in combination with chemotherapy in the A549 non-small-cell lung cancercell line.Cancer Chemother Pharmacol,2004,54:343-353.
7 Aphinives P,Bhudhisawasdi V,Saeseow O,et al.5-fluorouracil and mitomycin-C:effective,low-cost chemotherapy for colorectal cancer.J Med Assoc Thai,2006,89:1885-1889.
8 Vermes I,Haanen C,Reutelingsperger C,et al.Flow cytometry of apoptotic cell death.J Immunol Methods,2000,243:167-190.
9 Giovannetti E,Mey V,Danesi R,et al.Interaction between gemcitabine and topotecan in human non-small-cell lung cancer cells:effects on cell survival,cell cycle and pharmacogenetic profile.Br J Cancer,2005,92:681-689.
10 Kroep JR,Loves WJ,Vander Wilt CL,et al.Pretreatment deoxycytidine kinase levels predict in vivo gemcitabine sensitivity.Mol Cancer Ther,2002,1:371-376.
11 龚军,王正文,朱明才,等.金雀异黄素和5-Fu对人结肠癌细胞株(SW480)的相互作用的体外观察.中国现代医学杂志,2006,16:873-876.
12 段红,张俊文,汤为学,等.5-氟尿嘧啶及丝裂霉素对人胃癌细胞株SGC-7901及BGC-823的相互作用的体外观察.中国病理生理杂志,2002,18:259-261.
13 Charoentum C,Thongprasert S,Chewaskulyong B,et al.Experience with gemcitabine and cisplatin in the therapy of inoperable and metastatic cholangiocarcinoma.World J Gastroenterol,2007,13:2852-2854.
14 Tanaka T,Umesaki N.Radiation reduces pirarubicin sensitivity in human cervical squamous cell carcinoma cells.Oncol Rep,2005,13:1165-1168.
The combination effect of gemcitabine with mitomycin on human lung cancer A549 cell line in vitro
ZHAO Kexin,LI Junxia,JIANG Shan,et al.Central Hospital of China Petroleum Natural Gas Group CO.,LTD,Hebei,Langfang065000,China
ObjectiveTo investigate the combination effect of gemcitabine with mitomycin on human lung cancer A549 cell line in vitro,and to explore its action mechanism.MethodsMTT assay was used to analyze the inhibition effect of chemotherapy drugs on the growth of human lung cancer A549 cell line,and the cell cycle and cell apoptosis were detected by flow cytometry.ResultsThe gemcitabine and mitomycin alone or combination application could inhibit the growth of human lung cancer A549 cell line in a time and concentration dependent mode.The combination index(CI)was less than 1 at 72h when Fa>0.18,which indicated that gemcitabine and mitomycin had synergistic effect.However,the combination index was more than 1 at 72h when Fa < 0.18,which indicated that gemcitabine and mitomycin had antagonistic effect.The combination application of gemcitabine with mitomycin could get the highest inhibitory rate,next,the moderate inhibitory rate was got when mitomycin was given prior to gemcitabine,and the lowest inhibitory rate was got when gemcitabine was given prior to mitocymin.The CI was all less than 1 when mitomycin was combined with gemcitabine at different concentrations.The gemcitabine and mitomycin alone or combination application had influence on the cell cycle and cell apoptosis.ConclusionThe gemcitabine and mitocymin alone or in combination application can inhibit the growth of human lung cancer A549 cell line in a time-and concentration-dependent manner.The different drug concentrations and medication succession may affect the synergistic effect of the drugs.
gemcitabine;mitomycin;human lung cancer A549 cell line;lente principle
R 730.5;R 734.2
A
1002-7386(2011)09-1301-04
10.3969/j.issn.1002-7386.2011.09.007
065000 河北省廊坊市,中国石油天然气集团公司中心医院(赵可新、姜杉、王伟刚、胡建平、单靖珊);河北医科大学药理学教研室(李军霞)
李军霞,050017 河北医科大学药理学教研室;E-mail:lyjunxia@yahoo.com.cn
2011-01-14)
·论著·

