侧脑室注射链脲佐菌素对大鼠海马tau蛋白过磷酸化表达的影响
陈玉静,田金洲,尹军祥,时 晶,黄小波
(1.首都医科大学宣武医院 中医科,北京 100053;2.北京中医药大学东直门医院,北京 100053)
tau蛋白和Aβ是阿尔茨海默病(AD)的两大病理特征,围绕着二者在AD中的致病机理及治疗对策学术界已开展了一系列研究,以往大多数研究人员把目光集中在以Aβ为目标靶点的药物研发上,但临床研究结果不甚满意,因此,越来越多的研究者已经开始考虑改变AD的药物开发策略。随着以tau蛋白异常磷酸化为靶点的AD发病分子机制研究的不断深入,以tau蛋白为靶标的AD药物研发吸引了越来越多的研究者。近年来有学者[1-2]应用侧脑室注射链脲佐菌素(Streptozotocin,STZ)制备拟AD模型。本研究将在前期研究基础上观察侧脑室注射链脲佐菌素(ICV-STZ)对脑内tau蛋白磷酸化的影响,为该模型的进一步应用和AD的药物研发提供理论依据。
1 材料与方法
1.1 实验动物及模型制备 SPF级健康雄性Sprague-Dawley(SD)大鼠30只,体重250~300 g,购自北京维通利华实验动物中心(合格证号:SCXK京2006-0008)。实验过程中动物自由摄食和饮水(术前禁食除外),室温22 ℃~26 ℃,湿度28%~30%。30只大鼠随机分成假手术组(对照组)和STZ侧脑室注射组(模型组),每组15只。参考Sharma等[2]研究方法,所有大鼠经10%水合氯醛(3 mL/kg)麻醉后,固定于江湾Ⅰ型C大鼠立体定位仪上,常规消毒皮肤,正中矢状切口,分离骨膜,锥颅器钻开颅骨,暴露硬脑膜。除假手术组外,其余组动物均用微量注射器每侧侧脑室各注射STZ(Merck)约15~18 μL(3 mg/kg,注射前将STZ溶于生理盐水,浓度为25 mg/mL)。坐标参考包新民《大鼠脑立体定向图谱》[3]:前囟后1.5 mm,矢状缝左右旁开1.5 mm,脑表面下3.5 mm。第3天重复注射,剂量同前。假手术组操作同前,以等量生理盐水替代STZ。
1.2 外周血糖检测 分别于术前和术后尾静脉采血,微量血糖仪(Roche)测定外周血糖。
1.3 动物取材 每组各取5只大鼠应用4%中性多聚甲醛经心肌灌注固定,完整取出鼠脑,置后固定液中,脑下沉后即可冰冻切片,行免疫组织化学染色。其余动物在麻醉状态下断头取脑,冰盒上迅速分离海马组织,称重,置于eppendorf管中。经Folin酚比色法对脑组织进行蛋白定量,行SDS-PAGE凝胶电泳。
1.4 免疫组织化学染色及定量分析 免疫组织化学染色采取漂浮染色法,每只大鼠于海马CA1区连续切片,片厚45 μm,采用抗生物素蛋白-生物复合物(ABC)法进行染色,经过1N的HCl修复后,给予3%H2O2消除内源性过氧化物酶的影响,用山羊血清封闭后,加入一抗。一抗为小鼠多克隆抗体tau-1(识别tau蛋白非磷酸化Ser199/202位点)、兔多克隆抗体pS199/202和pS396/404(分别识别tau蛋白磷酸化Ser199/202和396/404位点),4 ℃过夜。加入生物素标记的二抗(稀释度为1∶300),孵育2 h后,再加入稀释度为1∶300的生物素抗体过氧化物酶标记的链霉卵白素,室温、摇床孵育2 h;DAB显色。每组大鼠各5只,每只鼠脑取3张相同部位的脑切片,共取15张切片计数。采用Kodak图像分析系统及Image-Proplus软件,在10倍物镜下,计算各组海马CA1区域内tau-1、pS199/202和pS396/404的阳性神经元数目。
1.5 免疫印迹分析 各组大鼠在麻醉状态下断头取脑,冰盒上迅速分离海马组织,称重,置于eppendorf管中。经Folin酚比色法对脑组织进行蛋白定量,加入上样缓冲液,煮沸4 min,用10%SDS-PAGE凝胶电泳分离,将蛋白转移到硝酸纤维素膜上,封闭后,用tau-1、pS199/202和pS396/404抗体作用1 h,二抗孵育,显色,扫描仪扫描电泳条带。
2 结果
2.1 外周血糖检测 造模后所有动物常规饲养,死亡率约10%。ICV-STZ模型组和对照组术前和术后(取材前)相比,外周血糖无差异。
2.2 免疫组化结果 见表1。
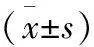
表1 海马CA1区不同抗体阳性神经细胞数目
2.3 免疫印迹结果 与对照组比较,模型组大鼠海马tau-1条带明显变浅,表明蛋白含量降低;pS199/202和pS396/404条带与对照组比较,明显增粗,表明蛋白含量增多,见图1。

图1 Western blotting检测侧脑室注射STZ对tau磷酸化表达的影响
3 讨论
STZ是一种甲基亚硝基脲产物,对实验动物的胰岛β细胞具有高度选择性的毒性作用,腹腔注射可导致1 型糖尿病,侧脑室注射STZ 后大鼠出现空间学习记忆功能异常,伴海马胆碱乙酰转移酶(ChAT)活性降低[3]。研究发现STZ在脑内干扰胰岛素和胰岛素样生长因子(IGF)信号转导,阻断胰岛素受体自身磷酸化和内在的酪氨酸激酶活性[4],但未引起外周血糖升高,胰腺结构和胰岛素的免疫活性也未受影响;实验中还发现ICV-STZ模型出现脑体积缩小,细胞丢失、β样淀粉酶(Aβ)沉积增多等一系列衰老的改变,该模型在某种程度上模拟了AD的病理特征[5],因此有学者应用侧脑室注射STZ来制备痴呆模型[6-7]。
在AD脑中,与神经元丢失相伴随出现的主要有两大病理改变:位于神经元外由β-淀粉样蛋白(β-amyloid,Aβ) 沉积构成的老年斑(senile plaque,SP)以及神经元内由异常过度磷酸化的tau蛋白构成的神经原纤维缠结(neurofibrillary tangle,NFT)[8]。其中NFT是导致神经元纤维退化的主要原因,可作为大脑早老化的标志[9],NFT的主要成分是双股螺旋细丝(Paired helical filament,PHF),而PHF的亚单位主要是过度磷酸化的tau蛋白。
tau蛋白是含量最高的微管相关蛋白,生理情况下,tau蛋白主要定位于中枢和外周神经系统的神经元轴突内,与微管相结合,促进微管蛋白集聚和维持微管稳定性;并参与维持细胞形态、信号传递和轴突生长发育。tau蛋白的异常磷酸化是AD神经原纤维变性的基础,用特异性抗体和质谱等分析技术证明:在AD脑中tau蛋白至少有21个异常磷酸化位点,异常磷酸化的tau蛋白完全丧失其生物学活性。tau蛋白参与神经原纤维缠结的形成和稳定性的维持,从而在AD神经元退变中起重要作用。因此,研究AD患者tau异常修饰的机制,对最终阻止AD病变具有指导意义。
pS199/202和pS396/404能够识别Ser199/202和Se396/404位点的磷酸化tau蛋白,Tau-1能够识别Ser199/202位点的非磷酸化tau蛋白。本研究中发现ICV-STZ模型大鼠体内Ser199/202和Ser396/404位点磷酸化表达增多,而tau-1的表达减少,这说明在Ser199/202和Ser396/404位点tau蛋白发生了异常磷酸化。由于本研究中选择的位点有限,是否存在其他位点的磷酸化还有待于进一步研究。
[1]Sonkusare S,Srinivasan K,Kaul C,et al.Effect of donepezil and lercanidipine on memory impairment induced by intracerebroventricular streptozotocin in rats[J].Life sci,2005,77(1):1.
[2]Shoham S,Bejar C,Kovalev E,et al.Intracerebroventricular injection of streptozotocin causes neurotoxicity to myelin that contributes to spatial memory deficits in rats[J].Exp Neurol.2003,184(2):1043-1052.
[3]Blokland A,Jolles J.Spatial learning deficit and reduced hippocampal ChAT activity in rats after an ICV injection of streptozotocin[J].Pharmacol Biochem Behav,1993,44(2):491-494.
[4]Lester-coll N,Rivera EJ,Soscia SJ,et al.Intracerebral streptozotocin model of type 3 diabetes:relevance to sporadic Alzheimer's disease[J].Alzheimers Dis,2006,9(1):13-33.
[5]Lannert H,Hoyer S.Intracerebroventricular administration of streptozotocin causes long-term diminutions in learning and memory abilities and in cerebral energy metabolism in adult rats[J].Behav Neurosci,1998,112(5):1199-1208.
[6]Rallul A,Ethika T,Rakesh S,et al.A study of brain insulin receptors,AChE actibity and oxidative stress in rat model of ICV STZ induced dememia[J].Neuropharmacol,2009,56(4):779-787.
[7]Nataniel L,Enrique JR,Strephanie JS,et al.Intracerebral streptozotocin model of type 3 diabetes:Relevance to sporadic Alzheimer’s disease[J].Alzheimers Dis,2006,9(1):13-33.
[8]Selkoe DJ.The molecular pathology of Alzheimer’s disease[J].Neuron,1991,6(4):487-498.
[9]王建枝.tau蛋白基因突变与神经退行性疾病[J].生命的化学,1999,19(6):288-290.

