肝纤维化大鼠肝细胞内质网形态及GRP78表达的研究
温静静, 谢汝佳, 韩 冰, 杨 婷, 钱 程, 杨 勤
(贵阳医学院病理生理教研室,贵州 贵阳 550004)
内质网应激是指某种原因导致细胞内质网钙稳态失衡或蛋白质加工运输障碍、生理功能紊乱的一种亚细胞器病理过程。近些年发现,内质网应激与机体的多种疾病密切相关,如心血管疾病、糖尿病、神经系统疾病以及肝损伤[1]。关于内质网应激与肝损伤的关系已有一些研究报道,但关慢性肝损伤与内质网应激关系的研究甚少,特别是关于肝纤维化发生中内质网应激的研究鲜有报道,仅有的研究大多针对内质网应激的分子生物学改变上,而对内质网形态学观察较少。因此,本研究拟以内质网应激为切入点,从亚细胞水平探讨内质网的结构及功能改变在慢性肝细胞损伤、肝纤维化发生机制中的作用。
材料和方法
1 材料
1.1 试剂 四氯化碳(carbon tetrachloride,CCl4)(分析纯,天津福晨化学试剂厂,天津);GRP78(glucose-regulated protein 78)多克隆抗体、DAB显色试剂盒和SABC试剂盒(武汉博士德公司);总RNA提取试剂盒(Fermentas);GRP78引物由大连宝生物科技公司设计合成。
1.2 动物分组 健康雄性Wistar大鼠32只,体重(180±20)g(贵阳医学院实验动物中心提供)。大鼠适应性喂养1周后,随机分为:正常对照组、肝纤维化组,每组各16只。
1.3 动物模型建立 新鲜配制60%CCl4植物油溶液,按3 L/kg的剂量皮下注射,每隔3 d注射1次造模。分别在实验第4周末和第8周末股动脉放血处死正常对照组与肝纤维化组大鼠,处死前称体重,留取血液及全部肝脏。
2 方法
2.1 计算肝脏指数 计算方法为(肝脏重量/体重)×100﹪。
2.2 测定血清丙氨酸氨基转移酶 (alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)采用Siemens Advia 1650全自动生化分析仪测定。
2.3 肝组织病理切片 常规石蜡包埋切片,行HE及VG染色,光镜下观察肝脏病理变化,并参照肝纤维化分级法[2]进行胶原纤维增生程度半定量分析。
2.4 肝组织超微结构观察 采用3%戊二醛前固定,1%四氧化锇后固定;脱水;包埋;聚合;切片,切片厚度为50 μm;染色采用醋酸双氧铀和柠檬酸铅双染法;HITACHI H-7650透射电子显微镜进行观察、拍照。
2.5 GRP78免疫组化检查 采用SABC法按试剂盒说明操作。阴性对照以PBS液代替Ⅰ抗。结果判定:光镜下观察胞浆染成棕黄色的细胞为阳性。400倍下观察不少于5个高倍视野,记数阳性细胞个数并计算其阳性细胞所占百分比(﹪)。
2.6 GRP78 mRNA real-time PCR检测 采用双股DNA结合荧光系统(SYBR Green),按逆转录反应试剂盒操作程序进行。反应总体积为25 μL,反应条件:50℃ 2 min,95℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40 个循环,保存其循环阈值(Ct)。以每例标本组织的目的片段与带内参照片段的Ct比值作为该标本基因表达的相对数值。β-actin上游引物5'-TCCTCCTGAGCGCAAGTACTCT-3',下游引物 5' -GCTCAGTAACAGTCCGCCTAGA-3',扩增条带700 bp。GRP78上游引物5'-TGGAATCTTCACCTCAGAGTG-3',下游引物 5'-ATATCCAAGGTGAACACACAC -3',扩增条带164 bp。
3 统计学处理
数据用SPSS 17.0统计软件分析,计量资料以均数±标准差()表示,病理学半定量结果采用秩和检验。
结 果
1 各组大鼠肝脏指数、血清ALT和AST活性的比较
由表1可见,肝纤维化4周组、8周组大鼠肝脏指数均显著高于正常组大鼠(P<0.01);血清AST和ALT活性均较正常组大鼠显著增加(P<0.01)。
表1 各组大鼠肝脏指数、血清ALT和AST活性Table 1.The liver index and serum activity of ALT and AST in each group of rats(.n=8)
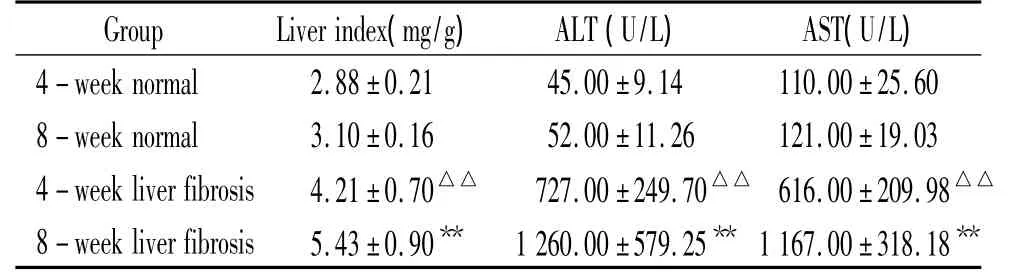
表1 各组大鼠肝脏指数、血清ALT和AST活性Table 1.The liver index and serum activity of ALT and AST in each group of rats(.n=8)
△△P <0.01 vs normal groups;**P <0.01 vs 4-week liver fibrosis group.
4-week normal 2.88±0.21 45.00±9.14 110.00±25.608-week normal 3.10 ±0.16 52.00 ±11.26 121.00±19.034-week liver fibrosis 4.21±0.70△△ 727.00±249.70△△ 616.00±209.98△△8-week liver fibrosis 5.43±0.90** 1260.00±579.25** 1167.00±318.18**
2 肝脏病理变化
HE染色镜下可见正常组大鼠肝细胞以中央静脉为中心呈放射状排列,无胶原纤维增生;肝纤维化4周组大鼠肝细胞轻度脂肪样变,汇管区纤维结缔组织轻度增生;肝纤维化8周组大鼠肝细胞脂肪样变严重,肝小叶结构破坏,肝索排列紊乱,汇管区纤维结缔组织大量增生,内有较多炎症细胞浸润,胶原纤维形成纤维间隔,可见假小叶形成,见图1。

Figure 1.HE staining of rat hepatic tissues in each group(×400).A:normal group;B:4-week liver fibrosis group;C:8-week liver fibrosis group.图1 各组大鼠肝组织HE染色结果
3 各组大鼠肝细胞超微结构及内质网形态学变化
图2可见,正常组大鼠肝细胞胞膜完整,胞质均匀,细胞核圆且居中,核仁明显,脂滴少见。细胞质内可见丰富的粗面内质网,排列整齐,排列的方向与细胞长轴平行。肝纤维化4周组大鼠肝细胞肿胀,脂滴增多,粗面内质网减少,出现不规则扩张、断裂、扭曲。肝纤维化8周组大鼠肝细胞缩小,脂滴明显增多,细胞核皱缩形状不规则,染色质边集,核仁消失,核周间隙增宽,间质增生,粗面内质网数目明显减少,明显扩张。

Figure 2.The morphological changes of endoplasmic reticulum in rats of each group(×2000).The arrows showed endoplasmic reticulum structure.A:normal group;B:4-week liver fibrosis group;C:8-week liver fibrosis group.图2 各组大鼠肝细胞超微结构
4 各组大鼠肝脏GRP78蛋白表达
由表2和图3可见,棕黄色阳性表达的GRP78蛋白在正常组大鼠肝细胞中很少见;在肝纤维化4周组大鼠肝细胞中可见较多表达,与正常组比较有明显差异;在肝纤维化维化8周组大鼠可见GRP78蛋白广泛在小叶内肝细胞胞浆中呈强阳性表达,且显著多于正常组及肝纤维化4周组,差异显著(P<0.01)。肝纤维化4周组大鼠肝脏GRP78 mRNA表达较正常组明显增加(P<0.01);肝纤维化8周组大鼠肝脏GRP78 mRNA表达较正常组及肝纤4周组均显著增加,差异显著(P<0.01)。
表2 各组大鼠肝脏GRP78蛋白及mRNA表达比较Table 2.The expression of GRP78 protein and mRNA in livers of each group(.n=8)
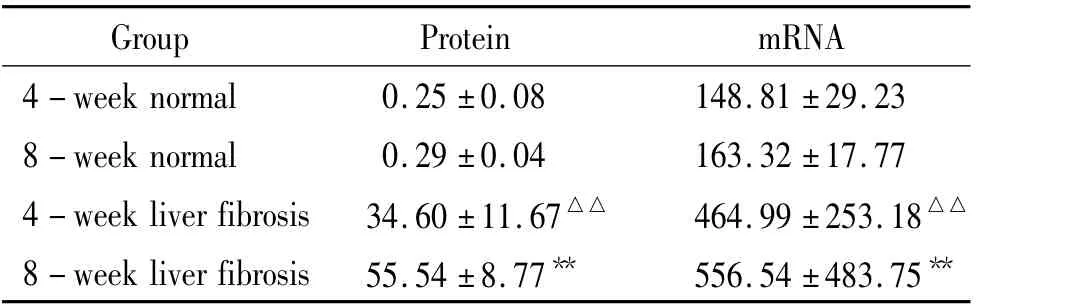
表2 各组大鼠肝脏GRP78蛋白及mRNA表达比较Table 2.The expression of GRP78 protein and mRNA in livers of each group(.n=8)
△△P<0.01 vs normal groups;**P<0.01 vs 4-week liver fibrosis group.
4 - week normal 0.25 ±0.08 148.81 ±29.238 - week normal 0.29 ±0.04 163.32 ±17.774 - week liver fibrosis 34.60 ±11.67△△ 464.99 ±253.18△△8 - week liver fibrosis 55.54 ±8.77** 556.54 ±483.75**

Figure 3.Expression of GRP78 in rat liver tissues(×400).A:normal group;B:4-week liver fibrosis group;C:8-week liver fibrosis group.图3 免疫组化显示肝组织中GRP78的表达
讨 论
内质网(endoplasmic reticulum,ER)的主要生理功能是负责正确折叠蛋白质的合成转运、信号肽识别和糖基化修饰、Ca2+的贮存和调节及信号转导等。然而,当内质网摄取、释放Ca2+紊乱或者蛋白质的加工运输障碍时,就会引起内质网应激(endoplasmic reticulum stress,ERS)。研究证实,ERS是一种信号反应通路系统,属细胞自我保护机制的一部分[3]。GRP78是内质网分子伴侣蛋白,GRP78作为分子伴侣,介导新生蛋白的加工成熟,是促进正常生长状态下细胞蛋白质成熟、维系细胞机能和生命的关键性调节蛋白,被认为是ERS标志性蛋白[4,5]。有研究表明在热休克、低糖、低氧、过氧化物增多等多种应激状态下,内质网内新生蛋白发生错误折叠,激活细胞内的未折叠蛋白反应(unfolded protein response,UPR),通过活化转录因子6(activation transfer factor-6,ATF-6)作用于GRP78启动子,上调GRP78基因的转录活性,使其表达量增高[6,7]。
肝细胞拥有高度发达的内质网,参与肝细胞的许多重要功能,诸如蛋白质合成、糖化和分泌,脂类物质的代谢、糖代谢、毒物及药物代谢等。当肝组织发生损伤,蛋白质不能在肝细胞内进行正常折叠,那么就可能引发ERS。近些年,关于ERS与各种原因引起的肝损伤的关系已逐渐被关注。研究发现酒精性脂肪肝肝细胞有ERS发生,认为ERS发生时膜表面合成的胆固醇减少,因此通过激活固醇调节元件结合蛋白通路反应途径进入胞核,与靶基因结合,增强靶基因转录,发挥调节脂质代谢的作用[8,9]。还有研究显示,酒精性肝损伤大鼠转氨酶升高,肝组织出现明显的病理损伤的同时肝脏GRP78 mRNA表达量较正常组显著增加[10]。病毒性肝炎所引起的肝损伤与ERS也有密切关系[11]。皮下注射CCl4引起的大鼠急性肝损伤时,CCl4给药3 h后,大鼠肝组织GRP78 mRNA的表达量比正常组显著增加;在CCl4给药6h后肝组织SOD活性降低,MDA含量升高;且随着时间延长,SOD活性下降和MDA浓度升高趋势更为明显,提示CCl4引起的急性肝损伤中,ERS可能与氧化应激有关系[12]。本研究发现,CCl4引起大鼠肝脏的慢性损伤后,大鼠血清ALT、AST水平明显增加,肝脏病理组织学HE、VG染色结果均显示有明显脂肪肝和肝纤维化形成。进一步利用透射电镜成功观察到肝细胞中内质网的形态学变化,结果显示肝细胞超微结构在肝纤维化4周、8周组大鼠与正常组大鼠明显不同:肝纤维化组大鼠肝细胞内脂滴明显增多,细胞核形状不规则,核周间隙增宽,粗面内质网减少且排列不整齐,出现不规则扩张、断裂、扭曲,内质网形态学发生了明显损伤性变化,同时免疫组化和real-time PCR研究显示肝纤维化4周、8周组大鼠肝组织中ERS标志性蛋白GRP78蛋白及mRNA的表达量也较正常组显著增加,且随时间延长明显增加,提示ERS参与了慢性肝损伤、肝纤维化的形成。有关ERS与CCl4引起肝纤维化发生机制中的作用目前不十分清楚,本课题组前期的研究已发现CCl4可引发大鼠肝细胞产生大量自由基并引起脂质过氧化及肝细胞SOD含量下降,因而造成对自由基的清除能力下降[13];同时本课题组的研究也发现在肝纤维化形成过程中肝细胞钙激活中性蛋白酶(calcium-activated neutral protease,calpain)表达发生变化(待发表),结合 Fei等[14]的研究,我们推测,当CCl4进入肝细胞,在肝细胞内代谢过程中产生大量氧自由基,引起肝细胞内质网受损,内质网内Ca2+大量释放进入胞浆,造成细胞内Ca2+超载,由此导致肝细胞大量破坏;另外,当细胞内Ca2+浓度升高,可能通过激活钙蛋白酶表达增高,过多表达的calpain通过促进NF-κB的表达诱导肝细胞凋亡增加,这可能是CCl4引起肝细胞损伤,导致纤维化发生一个可能的机制。但有关机制尚待深入研究。
[1]Dally S,Monceau V,Corvazier E,et al.Compartmentalized expression of three novel sarco/endoplasmic reticulum Ca2+ATPase 3 isoforms including the switch to ER stress,SERCA3f,in non - failing and failing human heart[J].Cell Calcium,2009,45(2):144 -154.
[2]程明亮,杨长青.肝纤维化的基础研究及临床[M].第2版.北京:人民卫生出版社,2002.269-270.
[3]Tardif KD,Waris G,Siddiqui A.Hepatitis C virus,ER stress and oxidative stress[J].Trends Microbiol,2005,13(4):159-163.
[4]Mu YP,Ogawa T,Kawada N.Reversibility of fibrosis,inflammation,and endoplasmic reticulum stress in the liver of rats fed a methionine - choline - deficient diet[J].Lab Invest,2010,90(2):245 -256.
[5]冀菁荃,张慧英,贾建桃,等.糖调节蛋白78在大鼠肠源性内毒素血症促进肝硬化形成中的作用[J].中国病理生理杂志,2010,26(12):2447 -2452.
[6]Neve EP,Ingelman - Sundberg M.Cytochrome P450 proteins:retention and distribution from the endoplasmic reticulum[J].Curr Opin Drug Discov Devel,2010,13(1):78-85.
[7]Friedman SL,Bansal MB.Reversal of hepatic fibrosis-Fact or fantasy?[J].Hepatology,2006,43(S1):S82 - S88.
[8]Wei Y,Wang D,Gentile CL,et al.Reduced endoplasmic reticulum luminal calcium links saturated fatty acid-mediated endoplasmic reticulum stress and cell death in liver cells[J].Mol Cell Biochem,2009,331(1 -2):31 -40.
[9]Hegde K,Joshi AB.Hepatoprotective effect of Carissa carandas Linn root extract against CCl4and paracetamol induced hepatic oxidative stress[J].Indian J Exp Biol,2009,47(8):660 -667.
[10]Tamaki N,Hatano E,Taura K,et al.CHOP deficiency attenuates cholestasis induced liver fibrosis by reduction of hepatocyte injury[J].Am J Physiol Gastrointest Liver physiol,2008,294(2):G498 - G505.
[11]钟卫卫,林世德.内质网应激与肝损伤研究进展[J].世界华人消化杂志,2010,18(10):1021 -1025.
[12]温 韬,张海燕,卢 静,等.内质网应激在四氯化碳致大鼠急性肝损伤中的作用探讨[J].胃肠病学和肝病学杂志,2008,10(10):786 -789.
[13]伍徐娴,杨 勤,罗新华,等.丹芍化纤胶囊对肝细胞线粒体脂质过氧化的影响[J].贵阳医学院学报,2004,29(5):405 -406,409.
[14]Wang Q,Zhang H,Zhao B,et al.H.IL -1β caused pancreatic β-cells apoptosis is mediated in part by endoplasmic reticulum stress via the induction of endoplasmic reticulum Ca2+release through the c-Jun N-terminal kinase pathway[J].Mol Cell Biochem,2009,324(1 -2):183 -190.
——疾病防治的新靶标

