花生四烯酸与氧化应激的研究进展*
陶 磊,傅淑霞
(河北医科大学第二医院肾内科,河北 石家庄 050000)
花生四烯酸(arachidonic acid,AA)是一种人体内含量最丰富、性质最活跃、分布最广泛的多不饱和必需脂肪酸,具有很强的生物活性,其代谢网络是炎症代谢网络的重要组成部分。AA不仅在炎症中发挥重要作用而且与氧化应激关系密切。对两者相互作用的研究能够更好地阐明疾病发生的机制,对病因探究及疾病治疗具有重要意义。
1 AA及其代谢
AA属于n-6系多不饱和必需脂肪酸,简记为20:4(n-6),由油酸转化而来。在哺乳动物体内,绝大部分AA与甘油磷脂上的羟基结合,以酯的形式几乎全部存在于膜磷脂Sn-2的位置。通过以下3条途径从膜磷脂中释放:(1)非特异性磷脂酶A2的直接水解;(2)磷脂酰肌醇特异性的磷脂酶C和二酰甘油脂肪酶联合作用;(3)特异性磷脂酶A2水解作用。其次AA的释放还受酰基转移酶的影响,抑制其活性,可以降低再酰化的速率,提高游离 AA的水平[1]。释放的 AA经3条途径被代谢:(1)环氧酶(cyclooxygenase,COX)途径,催化生成前列腺素类和血栓素;(2)脂氧酶(lipoxygenase,LOX)途径,生成过氧化氢廿碳四烯酸、白三烯类、羟化廿碳四烯酸和脂氧素;(3)经细胞色素 P450酶(cytochrome P450,CYP450)途径,生成羟化廿碳四烯酸、环氧化二十碳四烯酸及其下级产物二羟基二十碳三烯酸。
2 AA对氧化应激的影响
氧化应激指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)产生过多,超出了机体对氧化物的清除能力,氧化系统和抗氧化系统失衡,导致组织损伤。组织和细胞的氧化损伤被认为是许多人类疾病发展的中心环节,正常的氧化代谢会产生活性氧,但浓度非常低,低浓度的活性氧可作为信号转导通路中的信号分子,或者本身作为细胞的刺激物发挥重要的生理作用,然而高浓度的活性氧是致命的,氧化应激过程中产生的大量活性氧通过脂质过氧化反应,对膜磷脂内的脂肪酸进行修饰,改变了膜的流动性、膜蛋白结构及细胞信号转导通路等,导致细胞的坏死或凋亡。
2.1 AA诱导氧化应激的产生 AA对氧化应激的诱导主要是通过产生大量活性氧来实现的。AA主要通过以下几条通路促进活性氧的大量产生:首先,AA能够激活细胞膜上的钙通道致钙内流,使细胞内钙离子浓度增加[2,3],增加的钙离子能够激活 NADPH氧化酶,产生大量活性氧[4]。其次,AA和高糖共同作用能够激活蛋白激酶C(protein kinase C,PKC)进而激活PKC依赖的NADPH氧化酶,产生大量活性氧[5]。通过使用活性氧(ROS)捕获剂双氢罗丹明123,进一步证实了AA和高糖能够显著增加ROS的形成,并且随着AA和高糖的浓度增加,培养液中脂质过氧化物及氧化型谷胱甘肽(L-glutathione oxidized,GSSG)的量也逐渐增加,从而说明氧化应激逐渐加重[6,7]。AA还能诱导人中性粒细胞释放超氧基[8]。此外,AA通过激活受体交互作用蛋白1(receptor- interacting protein 1,RIP1),产生大量ROS[9]。AA还能通过抑制线粒体呼吸链中的复合酶I和III的活性以及增加线粒体膜的流动性,诱导ROS的产生,并且有研究发现在老鼠的心肌细胞线粒体中,ROS的产生量和复合酶III的抑制程度呈线性正相关[10]。除上述途径外,AA在通过COX、LOX途径代谢时,也产生大量活性氧,包括脂质过氧化物和超氧阴离子,加重氧化应激[11]。
2.2 AA抑制氧化应激 AA通过提高抗氧化酶活性及减少线粒体ROS的生成,抑制氧化应激,见图1。AA通过激活过氧化物酶增殖体激活受体(peroxisome proliferator-activated receptor,PPAR)及促进新蛋白的合成,提高了铜锌超氧化物歧化酶(copper/zinc superoxide dismutase,Cu/Zn-SOD)、锰超氧化物歧化酶、谷胱甘肽-过氧化物酶(glutathione peroxidase,GPx)及过氧化氢酶(catalase)4种抗氧化酶的活性,对抗谷氨酸盐及过氧化氢(H2O2)造成的氧化应激损伤,并且对于提高每种抗氧化酶活性所需AA的量及诱导时间各不相同,具有特异性[12]。PPAR包括PPAR-α、PPAR-γ等多种亚型,为进一步明确AA通过激活何种亚型而发挥作用,在实验中使用了PPAR-α抑制剂MK886,PPAR-γ抑制剂双酚A二缩水甘油醚(bisphenol A diglycidyl ether,BADGE)以及真核生物蛋白合成抑制剂放线菌酮(cycloheximide),发现其中BADGE和cycloheximide能够完全阻断AA的保护作用,MK886不能阻断AA的保护作用,证明AA对抗氧化应激的神经保护作用主要是通过激活PPAR-γ和合成新蛋白来实现的。尽管MK886不能阻断AA的保护作用,但是也不能除外AA可能通过PPAR-α途径发挥保护作用的可能性,因为MK886在阻断PPAR-α同时,其本身有直接的神经保护作用[12]。AA还能通过激活表皮生长因子受 体 (epidermal growth factor receptor,EGFR)[13],进而激活谷胱甘肽过氧化物酶[14]。除上述通过提高抗氧化酶活性抑制氧化应激外,AA还通过以下途径减少ROS的生成抑制氧化应激:首先,AA通过解偶联作用,降低线粒体膜电位,阻止反向电子转运(reverse electron transport,RET),进而阻止依赖 RET的ROS产生[10]。其次,AA通过降低NADPH氧化酶p47亚基的表达,抑制NADPH氧化酶的活性[15],减少ROS的生成。AA还能通过抑制一氧化氮合酶(nitric oxide synthase,NOS)的活性,抑制具有强氧化性的ROS-过氧亚硝酸盐(ONOO-)的形成[16]。
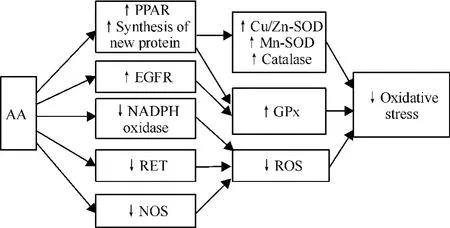
Figure 1.The inhibitory effect of AA on oxidative stress.图1 花生四烯酸对氧化应激的抑制作用
3 氧化应激对AA的影响
3.1 氧化应激促进AA的释放
①氧化应激通过增强磷脂酶A2活性,促进AA释放。磷脂酶A2是一种能水解甘油磷脂分子中第2位酯键的酶,分布广泛,根据其存在部位、氨基酸顺序同源性及生化功能不同分为3类:分泌型磷脂酶A2(secreted phospholipase A2,sPLA2);胞质型磷脂酶A2(cytosolic phospholipase A2,cPLA2),这两者都表现出对Ca2+的高度敏感性;以及Ca2+非依赖型磷脂酶A2(calcium - independent phospholipase A2,iPLA2)。其中cPLA2被认为是氧化应激状态下激活产生AA的主要酶,cPLA2水平与AA的释放量呈正相关。cPLA2主要通过以下几条途径激活,见图2。(1)氧化应激能够增加细胞内游离钙离子浓度([Ca2+]i),增加的钙离子,一方面通过激活丝裂原激活的蛋白激酶/细胞外信号调节激酶的激酶1(MAPK/ERK kinase 1,MEK-1),进而激活细胞外信号调节蛋白激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2),使cPLA2磷酸化激活;另一方面促进cPLA2从胞质向膜的转运,这两方面共同促进膜磷脂释放AA[17]。(2)氧化应激能够激活 PKC,被激活的PKC一方面通过激活ERK1/2,磷酸化激活cPLA2;另一方面PKC也能直接磷酸化激活cPLA2,促进AA的释放[17]。(3)氧化应激能够直接诱导ERK1/2和p38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)的磷酸化激活[18],激活的这两种酶能够分别诱导cPLA2磷酸化,激活cPLA2,释放 AA[19,20]。(4)氧化应激还能通过 Raf- MEK -p42/44(MAPK)通路,致 cPLA2磷酸化,激活 cPLA2,释放AA[21]。(5)氧化应激状态下膜磷脂发生脂质过氧化,cPLA2对氧化的膜磷脂具有高度亲和力和选择性的降解作用,进一步增强cPLA2活性,增加AA释放[21]。(6)氧化应激下存在sPLA2的激活,激活的sPLA2通过增强PKC和ERK的活性,进而增加cPLA2的激活,促进 AA释放[17]。除上述 cPLA2激活外,氧化的膜磷脂能够显著增加sPLA2的活性[22],并且氧化应激下激活的cPLA2也能进一步增强sPLA2的活性[17]。由此可见,氧化应激状态下存在cPLA2和sPLA2两种酶的激活,并且两者之间存在着复杂相互关系,共同作用促进AA释放。

Figure 2.The activation of cPLA2and the release of AA under oxidative stress.图2 氧化应激下cPLA2的激活及AA的释放
对于iPLA2是否参与氧化应激下AA的释放,存在争议,在星形胶质细胞研究中发现,氧化应激状态下抑制 iPLA2的活性,对 AA的释放没有影响[18]。然而在U937吞噬细胞研究中却发现,iPLA2是氧化应激下释放AA的主要酶[23]。
②氧化应激抑制AA的再酰化,增加游离的AA浓度。AA参与了膜磷脂的脱酰基和再酰基作用循环,AA被PLA2从磷脂膜上水解下来,另1个脂肪酸通过酰基辅酶A合成酶和溶血磷脂酯酰转移酶结合到膜磷脂上,这个循环是构成AA和其它脂肪酸结合到磷脂上的主要通路,氧化应激状态时AA的再酰化被抑制。氧化应激通过损伤线粒体,抑制三磷酸腺苷(adenosine triphosphate,ATP)的合成[24],而 ATP 是合成酰化作用中间产物脂肪酰辅酶A所必须的,通过抑制ATP的合成,从而抑制了AA的酯化作用,增加了AA的释放。
3.2 氧化应激抑制血小板 AA的释放 Sorrell等[25]利用吩嗪衍生物绿脓菌素的氧化还原特性产生了少量的活性氧自由基,来研究氧化应激对人血小板内AA代谢的影响,血小板内的AA预先用[3H]标记,并且向培养液中加入钙离子载体A23187,使钙离子快速进入细胞内,保证了细胞质的游离钙离子浓度,结果发现用绿脓菌素处理的血小板游离AA标记量减少,相对应的是膜磷脂上的标记增加。在向培养液中加入绿脓菌素前用抗氧化剂,超氧化物歧化酶,过氧化氢酶或者羟自由基清除剂,甘露醇等预处理,能够恢复AA的释放和类花生四烯酸的量,从而说明氧化应激抑制血小板膜磷脂AA释放,然而,绿脓菌素产生的活性氧对加入外源性AA的代谢没有影响。
4 小结
综上所述,AA既能诱导氧化应激产生,也能抑制氧化应激,同时氧化应激对AA的释放也有正反两方面作用。AA作为一种重要的炎症因子,与氧化应激之间存在着复杂的相互关系,不同细胞间二者的相互关系也不尽相同,通过AA的桥梁作用,不仅能够将炎症和氧化应激有机结合起来,从炎症和氧化应激两方面系统阐述疾病发生发展全过程,而且还能从这两个方面对疾病进行治疗,对临床疾病的诊治具有重大意义。
[1]陈 瑗,周 玫.自由基医学基础与病理生理[M].第1版.北京:人民卫生出版社,2002.175 -179.
[2]Fiorio Pla A,Genova T,Pupo E,et al.Multiple roles of protein kinase A in arachidonic acid-mediated Ca2+entry and tumor- derived human endothelial cell migration[J].Mol Cancer Res,2010,8(11):1466 -1476.
[3]Thompson J,Mignen O,Shuttleworth TJ.The N - terminal domain of Orai3 determines selectivity for activation of the store - independent ARC channel by arachidonic acid[J].Channels(Austin),2010,4(5):398 -410.
[4]Jagnandan D,Church JE,Banfi B,et al.Novel mechanism of activation of NADPH oxidase 5.Calcium sensitization via phosphorylation[J].J Biol Chem,2007,282(9):6494-6507.
[5]Inoguchi T,Li P,Umeda F,et al.High glucose level and free fatty acid stimulate reactive oxygen species production through protein kinase C-dependent activation of NAD(P)H oxidase in cultured vascular cells[J].Diabetes,2000,49(11):1939 -1945.
[6]Lee SJ,Mun GI,An SM,et al.Evidence for the association of peroxidases with the antioxidant effect of p-coumaric acid in endothelial cells exposed to high glucose plus arachidonic acid[J].BMP Rep,2009,42(9):561 -567.
[7]Mun GI,An SM,Park H,et al.Laminar shear stress inhibits lipid peroxidation induced by high glucose plus arachidonic acid in endothelial cells[J].Am J Physiol Heart Circ Physiol,2008,295(5):H1966 - H1973.
[8]黄铁生.花生四烯酸及其衍生物对肿瘤坏死因子诱导的中性粒细胞超氧基释放的影响[J].中国病理生理杂志,2000,16(4):347 -350.
[9]Kim S,Dayani L,Rosenberg PA,et al.RIP1 kinase mediates arachidonic acid-induced oxidative death of oligodendrocyte precursors[J].Int J Physiol Pathophysiol Pharmacol,2010,2(2):137 -147.
[10]Schönfeld P,Wojtczak L.Fatty acids decrease mitochondrial generation of reactive oxygen species at the reverse electron transport but increase it at the forward transport[J].Biochim Biophys Acta,2007,1767(8):1032 -1040.
[11]陈 瑗,周 玫.自由基-炎症与衰老性疾病[M].第1 版.北京:科学出版社,2007.11 -16.
[12]Wang ZJ,Liang CL,Li GM,et al.Neuroprotective effects of arachidonic acid against oxidative stress on rat hippocampal slices[J].Chem Biol Interact,2006,163(3):207-217.
[13]Freeman EJ,Sheakley ML,Clements RJ.Angiotensin II-dependent growth of vascular smooth muscle cells requires transactivation of the epidermal growth factor receptor via a cytosolic phospholipase A(2)-mediated release of arachidonic acid[J].Arch Biochem Biophys,2010,498(1):50-56.
[14]Duval C,Augé N,Frisach MF,et al.Mitochondrial oxidative stress is modulated by oleic acid via an epidermal growth factor receptor-dependent activation of glutathione peroxidase[J].Biochem J,2002,367(Pt3):889 -894.
[15]Keane DC,Takahashi HK,Dhayal S,et al.Arachidonic acid actions on functional integrity and attenuation of the negative effects of palmitic acid in a clonal pancreatic βcell line[J].Clin Sci(Lond),2011,120(5):195 -206.
[16]Palomba L,Cerioni L,Cantoni O.Arachidonic acid inhibits neuronal nitric oxide synthase elicited by proinflammatory stimuli and promotes astrocyte survival with both exogenous and endogenous peroxynitrite via different mechanisms[J].J Neurosci Res,2010,88(11):2459 -2468.
[17]Han WK,Sapirstein A,Hung CC,et al.Cross-talk between cytosolic phospholipase A2α(cPLA2α)and secretory phospholipase A2(sPLA2)in hydrogen peroxide-induced arachidonic acid release in murine mesangial cells:sPLA2regulates cPLA2alpha activity that is responsible for arachidonic acid release[J].J Biol Chem,2003,278(26):24153-24163.
[18]Zhu D,Hu C,Sheng W,et al.NAD(P)H oxidase-mediated reactive oxygen species production alters astrocyte membrane molecular order via phospholipase A2[J].Biochem J,2009,421(2):201 -210.
[19]Shelat PB,Chalimoniuk M,Wang JH,et al.Amyloid beta peptide and NMDA induce ROS from NADPH oxidase and AA release from cytosolic phospholipase A2in cortical neurons[J].J Neurochem,2008,106(1):45 -55.
[20]Nito C,Kamada H,Endo H,et al.Role of the p38 mitogen-activated protein kinase/cytosolic phospholipase A2signaling pathway in blood-brain barrier disruption after focal cerebral ischemia and reperfusion[J].J Cereb Blood Flow Metab,2008,28(10):1686 -1696.
[21]van Rossum GS,Drummen GP,Verkleij AJ,et al.Activation of cytosolic phospholipase A2in Her14 fibroblasts by hydrogen peroxide:a p42/44MAPK-dependent and phosphorylation- independent mechanism[J].Biochim Biophys Acta,2004,1636(2 -3):183 -195.
[22]Korotaeva AA,Samoilova EV,Piksina GF,et al.Oxidized phosphatidylcholine stimulates activity of secretory phospholipase A2group IIA and abolishes sphingomyelininduced inhibition of the enzyme[J].Prostaglandins Other Lipid Mediat,2010,91(1 -2):38 -41.
[23]Pérez R,Balboa MA,Balsinde J.Involvement of group VIA calcium-independent phospholipase A2in macrophage engulfment of hydrogen peroxide-treated U937 cells[J].J Immunol,2006,176(4):2555 - 2561.
[24]Maenpaa CJ,Shames BD,Van Why SK,et al.Oxidant-mediated apoptosis in proximal tubular epithelial cells following ATP depletion and recovery[J].Free Radic Biol Med,2008,44(4):518 -526.
[25]Muller M,Sorrell TC.Oxidative stress and the mobilisation of arachidonic acid in stimulated human platelets:role of hydroxyl radical[J].Prostaglandins,1997,54(1):493-509.

