抗生素对重组约氏疟原虫BY265株感染斯氏按蚊的影响
周桃莉,付雍,王艳艳,丁艳,谭章平,徐文岳
(第三军医大学基础部病原生物学教研室,重庆 400038)
疟疾是一种严重危害人类健康的热带传染病。构建的约氏疟原虫/斯氏按蚊实验模型不但为探讨疟原虫与蚊相互关系,而且也为研究红外期疟原虫发育机制,最终预防和阻断疟疾的传播提供了重要的实验平台。付雍等[1]构建的表达绿色荧光蛋白的重组约氏疟原虫BY265-GFP为疟疾防治机制研究提供了一种更加直观的模型,然而与野生株约氏疟原虫相比,重组约氏疟原虫BY265-GFP感染斯氏按蚊的能力明显下降,一定程度上限制了这一模型的应用。鉴于按蚊肠道细菌能活化按蚊天然免疫抑制疟原虫发育,因此,本研究观察抗生素的联合应用对斯氏按蚊感染重组约氏疟原虫BY265-GFP株的影响。
1 材料与方法
1.1 供试疟原虫、蚊媒和动物
约氏疟原虫(Plasmodium yoelii)BY265-GFP株为本室构建的基因重组疟原虫[1],每周用昆明株小鼠血传1次,每5 w蚊传1次;斯氏按蚊(Anopheles stephensi):Hor株,为本实验室长期饲养繁殖的稳定蚊种。成蚊在24~26℃、相对湿度为70%~80%的养蚊室中饲养;雌性昆明株小鼠,清洁级,重约20 g,由第三军医大学实验动物中心提供。
1.2 主要试剂
庆大霉素、青霉素、链霉素、新霉素、泛影葡胺(上海海普药业)、新生牛血清和 RPMI1640培养基。
1.3 抗生素糖水的配制
首先将10%的糖水高压灭菌,按下列配方加入抗生素:每毫升糖水含庆大霉素15 μ g 、青霉素 10 U 、链霉素 10 μ g 、新霉素 20 μ g 。
1.4 实验分组
将3~4日龄斯氏按蚊随机分成4笼,每笼约300只雌性按蚊,设实验1组(感染前后1 d都饲糖水组),实验2组(感染前1 d饲糖水组),实验3组(感染后1 d饲糖水组)和对照组(饲普通糖水组)。
1.5 重组约氏疟原虫感染小鼠动物模型的建立
将液氮保存的红内期重组约氏疟原虫感染1只昆明株小鼠,当原虫血症达10%以上时,摘除眼球取血并离心去除血清,用PBS将沉淀红细胞稀释,注射12只昆明株小鼠,每只小鼠注射200 μ l红细胞稀释液。3 d后查原虫血症,当感染小鼠内的重组约氏疟原虫BY265-GFP株的配子体约为1%时,供上述4组斯氏按蚊叮咬吸血,每笼随机抽取3只小鼠供血。
1.6 斯氏按蚊卵囊的观察和唾液腺子孢子的分离计数
卵囊的观察:于感染后7 d用乙醚轻度麻醉蚊子,在解剖镜下解剖蚊胃后放于显微镜下观察。唾液腺子孢子的分离计数[2]:收集吸食约氏疟原虫感染小鼠血后16 d的斯氏按蚊(雌蚊)约300只,用乙醚轻度麻醉蚊子。去除蚊的头腹部,将蚊的胸部组织收集于研钵中,加入少量RPMI1640培养基,研磨3 min,将研磨所得的匀浆液与30 ml的 RPMI1640培养基混合,移入50 ml离心管内,4℃,300 g离心5 min。将上清液(含子孢子)移至另一50 ml离心管内,4℃,16 000 g离心10 min。弃去上清液,加入RPMI1640培养基2 ml重悬子孢子沉淀。用60%泛影葡胺、新生牛血清和RPMI1640培养基配制密度梯度离心液,取子孢子重悬液1 ml加入密度梯度离心液上面,水平离心,4℃,16 000 g离心10 min。用1 ml注射器从双层梯离心液界面吸取富含子孢子层,加入RPMI1640培养基30 ml,4℃,16 000 g离心10 min。弃去上清液,用RPMI1640培养基1 ml重悬子孢子沉淀,在改良血细胞计数板上计数。
2 结果
2.1 抗生素对斯氏按蚊卵囊感染率的影响
吸血感染后7 d解剖斯氏按蚊中肠,对照组共解剖86只,卵囊阳性的 45只,感染率为 52.3%(有卵囊蚊数/检查蚊数),实验1组解剖90只,卵囊阳性的89只,感染率为98.9%,实验2组解剖90只,卵囊阳性的88只,感染率为97.8%,实验3组解剖90只,卵囊阳性的48只,感染率为53.3%。以上结果说明在感染前加饲抗生素对斯氏按蚊感染疟原虫的卵囊发育有明显促进作用,大大提高了按蚊的感染率,而在感染后加饲抗生素是没有作用的。

图1 感染前后加饲抗生素组蚊胃卵囊 图2 对照组蚊胃卵囊Fig.1 oocyst of the antibiotic-treated group Fig.2 oocyst of the control group
2.2 抗生素对斯氏按蚊唾液腺子孢子数量的影响
在吸血感染后16 d,采用密度梯度离心法分离唾液腺子孢子,对照组和实验各组收集100只感染蚊,分离后用细胞计数板计数(结果见表2),对照组为5.4×105,实验1、2组均明显高于对照组的子孢子数,而实验3组与对照组差别不大,说明在感染前加饲抗生素可明显提高唾液腺子孢子的数量,而在感染后加饲抗生素对唾液腺子孢子的数量没有影响。
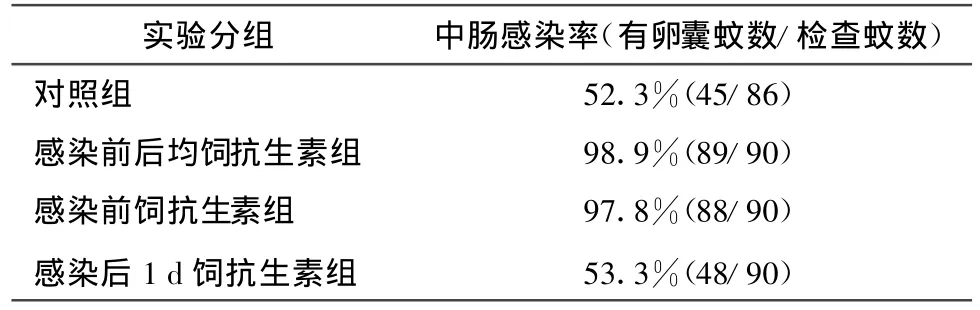
表1 抗生素对斯氏按蚊中肠感染率的影响Tab.1 Effect of antibiotic on infection rate of oocyst in Anopheles stephensi

表2 抗生素对唾液腺子孢子数量的影响Tab.2 Effect of antibiotic on sporozoite quantity in Anopheles stephensi
3 讨论
疟原虫发育及其致病机理的研究是制定有效疟疾防治手段的前提。由于受研究模型的限制,相对于红内期疟原虫而言,红外期和蚊期疟原虫的研究相对滞缓。疟原虫感染按蚊模型不但有助于我们研究疟原虫在按蚊体内的发育机制,而且可为红外期疟原虫的研究提供重要的子孢子来源。另外,由于疟原虫在按蚊体内进行有性生殖,因此疟原虫感染按蚊模型还可为疟原虫之间的杂交以及疟原虫致死遗传分析提供重要的平台。
斯氏按蚊是疟疾重要的传播媒介,约氏疟原虫/斯氏按蚊是目前公认的重要模型。温度是疟原虫在蚊体内发育中的关键性因素[3],杨松、张健等[4-7]证实斯氏按蚊丝氨酸蛋白酶基因、前酚氧化酶及酚氧化酶、T EP1基因与约氏疟原虫卵囊黑化有关,可影响按蚊体内卵囊的发育。研究发现,雌蚊中肠是疟原虫在蚊体内发育的重要场所,当中肠的环境改变时,对疟原虫的发育会产生影响[8-10]。近年来的研究发现,按蚊的中肠通常含有多种细菌,而细菌的存在可能通过活化按蚊的天然免疫反应,抑制疟原虫在蚊体内的发育。约氏疟原虫BY265/斯氏按蚊是本室的常用模型,斯氏按蚊的疟原虫感染率和感染度通常很高。重组约氏疟原虫BY265-GFP株是我室构建的能在疟原虫整个生活史持续发绿色荧光的重组疟原虫,可为我们研究疟原虫在蚊体内的发育提供更加直观的模型,然而可能由于外源基因的插入,构建的重组约氏疟原虫BY265-GFP株对斯氏按蚊的感染率和感染度却较低,从而影响了此模型在科学研究中的应用。鉴此,本研究在加饲联合抗生素的情况下,分别观察了对斯氏按蚊中肠感染率和感染度、唾液腺子孢子数量的影响,以优化重组约氏疟原虫BY265-GFP株/斯氏按蚊模型。结果发现,抗生素对斯氏按蚊感染重组约氏疟原虫BY265-GFP株的卵囊和子孢子形成的影响明显。我们认为适当的加饲抗生素能提高斯氏按蚊对重组约氏疟原虫BY265—GFP株的感染率,有助于对这一模型更好的应用,并为进一步研究疟原虫在宿主体内的发育和感染提供依据。
[1]付雍,丁艳,周桃莉.蚊期和红内期持续表达绿色荧光蛋白的重组约氏疟原虫[J].中国寄生虫学与寄生虫病杂志,2009,27(6):488-491.
[2]Pacheco ND,Strome CP,Mitchell F,et al.Beaudoin.1979.Rapid,large-scale isolation of Plasmodium berg hei sporozoites from infected mosquitoes.J.Parasitol,1979,65(3):414-417.
[3]Blanford S,Read AF,Thomas MB.Thermal behaviour of A-nopheles stephensi in response to infection with malaria and fungal entomopathogens[J].Malar J,2009,8:72.
[4]杨松,黄复生,段建华.斯氏按蚊丝氨酸蛋白酶基因克隆及其与约氏疟原虫卵囊黑化关系的研究[J].中国人兽共患病杂志,2005,12(21):1059-1063.
[5]Zhang J,Huang FS,Xu WY,et al.Plasmodium yoelii:Correlation of up-regulated Prophenoloxidase and Phenoloxidases with melanization induced by the antimalarial,nitroquine[J].Experimental Parasitology,2008,118(3):308-314.
[6]Zhang J,Huang FS,Xu WY,et al.Plasmodium yoelii:correlation of TEP1 with mosquito melanization induced by nitroquine[J].Experimental Parasitology,2011,127(1):52-57.
[7]张健,徐文岳,段建华.按蚊 TEP1基因与硝喹诱导疟原虫卵囊黑化反应的相关性[J].中国寄生虫学与寄生虫病杂志,2009,4(27):322-325.
[8]Suneja A,Gulia M,Gakhar SK.Blocking of malaria parasite development in mosquito and fecundity reduction by midgut antibodies in Anopheles stephensi(Diptera:Culicidae)[J].Arch Insect Biochem Phy siol,2003,52(2):63-70.
[9]Gakhar SK,Suneja A,Adak T.Midgut antibodies reduce the reproductive capacity of Anopheles stephensi(Diptera:Culicidae)[J].Indian J Exp Biol,2005,43(4):330-334.
[10]魏秋芬,曾令娥,孙宝清.抗斯氏按蚊中肠蛋白组分的抗体对约氏疟原虫卵囊的作用[J].中国寄生虫学与寄生虫病杂志,2006,24(6):441-444.