血管活性肠肽对慢性阻塞性肺病患者外周血单个核细胞分泌TNF-α和IL-8的影响
王彦霞 籍文强 杨 涛 石玉珍赵红敏 (河北医科大学第一医院急诊科,河北 石家庄 05008)
血管活性肠肽对慢性阻塞性肺病患者外周血单个核细胞分泌TNF-α和IL-8的影响
王彦霞 籍文强 杨 涛 石玉珍1赵红敏 (河北医科大学第一医院急诊科,河北 石家庄 050081)
目的 观察血管活性肠肽(VIP)对体外培养慢性阻塞性肺病(COPD)患者外周血单个核细胞(PBMC)产生肿瘤坏死因子-α(TNF-α)和白介素-8(IL-8)水平的影响。方法 应用不同浓度VIP预处理COPD缓解期患者PBMC,再以脂多糖(LPS)诱导,用ELISA法检测细胞培养上清液中TNF-α和IL-8含量。结果 不同浓度VIP均能降低LPS诱导的PBMC产生TNF-α和IL-8,在10-8mol/L浓度最低。VIP可以降低COPD急性加重期治疗前后有或无LPS诱导的PBMC产生TNF-α和IL-8含量。结论 VIP对COPD患者PBMC有直接抗炎作用。
慢性阻塞性肺病;肿瘤坏死因子-α;白介素-8;血管活性肠肽
血管活性肠肽(VIP)是肺内含量最丰富的神经肽类物质之一,通过与其受体结合发挥广泛的生物学调节作用。VIP作为配体,可以在人类激活的外周血单个核细胞(PBMC)中发现特异性受体,通过与细胞膜表面特异性受体结合发挥抗炎作用。慢性阻塞性肺疾病(COPD)是呼吸系统最常见的老年慢性炎症性疾病之一,PBMC参与其炎症反应过程。革兰阴性杆菌感染是COPD急性加重的主要原因之一,而脂多糖(LPS)是革兰阴性杆菌外膜的一种大分子物质。本实验采用COPD患者PBMC为研究对象进行体外培养,应用VIP进行干预,通过测定PBMC产生肿瘤坏死因子(TNF-α)和白介素-8(IL-8)的含量,探讨其对COPD的抗炎作用。
1 资料与方法
1.1 对象 选定2009年10月至2011年6月河北医科大学第一医院急诊科及呼吸内科病房住院的COPD急性加重期患者为治疗前组,入院后经过积极治疗后病情好转达到稳定期的为治疗后组,年龄55~80〔平均(67.7±6.2)〕岁。病情恶化或死亡者被排除。COPD缓解期组来源于同期来我院门诊复诊的患者。以上病例均符合2007年COPD诊治指南修订版〔1〕,并排除心脑血管系统的所有疾病、呼吸系统其他疾病、较严重的消化系统疾病、肾病、糖尿病等内分泌代谢疾病、肿瘤以及重大手术和结缔组织病等。
1.2 方法
1.2.1 收集PBMC 取试验对象空腹无菌静脉血(肝素抗凝),用等体积的0.9%氯化钠注射液稀释抗凝管中的血液,充分混匀。取等体积淋巴细胞分离液加入10 ml无菌离心管中,将上述稀释的血液沿离心管壁缓缓平铺在淋巴细胞分离液面上层,保持两液间界限分明。4℃离心(2 000 r/min,25 min),吸取血浆与分离交接面白色云雾状层的单个核细胞,并将其移至另一10 ml无菌离心管中,加5倍体积的0.9%氯化钠注射液稀释,充分混匀,4℃离心(1 000 r/min,10 min),倾去上清液,轻轻弹起细胞沉淀,再加5倍体积的0.9%氯化钠注射液稀释,并充分混匀,4℃离心(1 000 r/min,10 min),尽量去掉上清液,底层为单个核细胞。0.4%台盼蓝染色,排除无活性的细胞,活细胞数>90%可采用。淋巴细胞分离液由北京鼎国生物技术有限责任公司提供。
1.2.2 试验分组 取6例COPD缓解期患者外周血分离出的单个核细胞,用无血清1640培养液调节细胞浓度均为2.0×106个/ml。细胞种于48孔培养板中。每份单个核细胞按VIP剂量分为若干组,每组种3孔,取其平均值。不同剂量的VIP培养30 min后,加入终浓度为1 mg/L的LPS进行刺激。另外,将每例治疗前后COPD患者PBMC平均分成4组,分别为空白对照组、VIP组、LPS组和 LPS+VIP组,VIP终浓度为10-8mol/L。取等体积的每组细胞分别培养30 min后,需用LPS刺激的细胞培养液体中加入终浓度为1 mg/L的LPS,于37℃、5%CO2、95% ~100%湿度的培养箱内培养8 h,取上清液于-70℃冰箱冻存,待测继续培养(RPMI 1640培养基购自美国Gibco公司,VIP、LPS由美国Sigma公司提供)。
1.3 检测TNF-α、IL-8水平 用ELISA法检测细胞上清液中TNF-α、IL-8的含量。TNF-α和IL-8的ELISA试剂盒均购自深圳晶美公司,具体操作按试剂盒说明书进行。
1.4 统计学方法 应用SPSS13.0统计软件进行分析,各计量数据以±s表示,组间比较采用单因素方差分析(One way ANOVY),如差异有显著性进一步用 Student-Newman-Keuls(SNK-q)检验。
2 结果
2.1 VIP干预COPD缓解期PBMC分泌TNF-α、IL-8的影响VIP能明显降低LPS诱导下的COPD缓解期 PBMC分泌的TNF-α和IL-8(P<0.05)。随着 VIP剂量的增加,TNF、IL-8的含量降低越来越明显,当 VIP浓度为10-8mol/L时,TNF-α、IL-8的含量到达最低,随后逐渐升高,但均低于LPS+0 mol/L(P<0.05)。见表1。
2.2 VIP干预不同条件下COPD急性加重期治疗前后PBMC分泌TNF-α、IL-8的影响 VIP能够降低COPD急性加重期治疗前后PBMC分泌TNF-α和IL-8的含量(P<0.05);LPS可以上调COPD急性加重期治疗前后PBMC分泌TNF和IL-8的含量(P<0.05);VIP对LPS诱导的COPD急性加重期治疗前后PBMC分泌TNF-α和 IL-8的含量同样具有抑制作用(P<0.05)。见表2。
表1 不同浓度VIP对COPD稳定期PBMC分泌TNF-α、IL-8 的影响(±s,n=6,mg/ml)
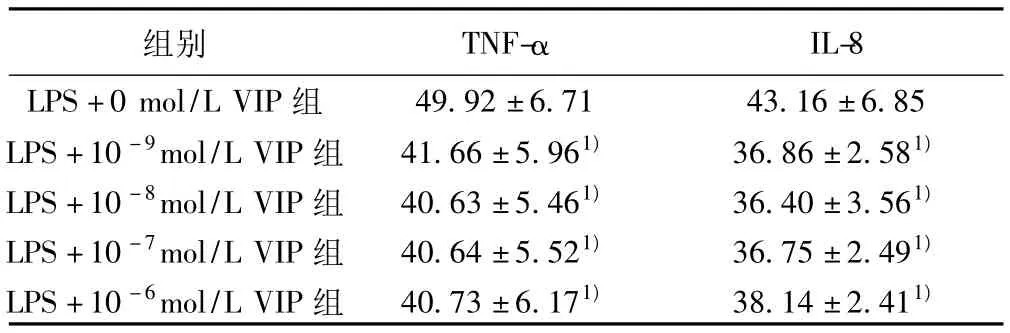
表1 不同浓度VIP对COPD稳定期PBMC分泌TNF-α、IL-8 的影响(±s,n=6,mg/ml)
与LPS+0 mol/L VIP组比较:1)P<0.05
组别 TNF-αIL-8 LPS+0 mol/L VIP组49.92±6.71 43.16±6.85 LPS+10-9mol/L VIP组 41.66±5.961)36.86±2.581)LPS+10-8mol/L VIP组 40.63±5.461)36.40±3.561)LPS+10-7mol/L VIP组 40.64±5.521)36.75±2.491)LPS+10-6mol/L VIP组 40.73±6.171)38.14±2.411)
表2 VIP干预不同条件下COPD治疗前后PBMC分泌TNF-α、IL-8 的影响(±s,n=20,pg/ml)
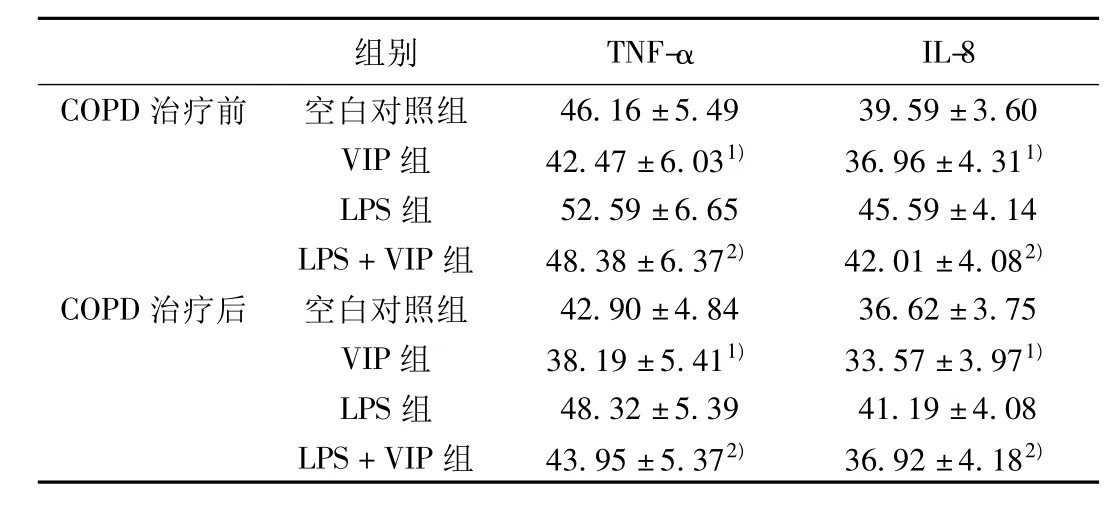
表2 VIP干预不同条件下COPD治疗前后PBMC分泌TNF-α、IL-8 的影响(±s,n=20,pg/ml)
与空白对照组比较:1)P<0.05;与LPS组比较:2)P<0.05
组别 TNF-αIL-8 COPD治疗前 空白对照组46.16±5.49 39.59±3.60 VIP组 42.47±6.031)36.96±4.311)LPS组 52.59±6.65 45.59±4.14 LPS+VIP组 48.38±6.372)42.01±4.082)COPD治疗后 空白对照组 42.90±4.84 36.62±3.75 VIP组 38.19±5.411)33.57±3.971)LPS组 48.32±5.39 41.19±4.08 LPS+VIP组 43.95±5.372)36.92±4.182)
3 讨论
多种炎性细胞、炎症介质和细胞因子参与了COPD的慢性气道炎症反应,支气管肺组织炎症、损伤、修复和重塑是其病情不断进展的病理发展过程。TNF-α是早期炎症反应的启动因子,能激活炎性细胞,尤其是巨噬细胞和中性粒细胞,使其细胞毒性增加,可以刺激其释放更多的氧和氮基团以及其他细胞因子〔2〕,形成炎症级联反应。Gallelli等〔3〕应用 TNF-α 诱导支气管上皮细胞,发现IL-8含量较前明显增高。可见TNF-α能够促进炎性介质分泌,扩大气道的炎症反应。而且,TNF-α能增强中性粒细胞的细胞外蛋白分解作用,刺激气道细胞增殖,诱导气道黏液细胞化生,激活炎症介质等气道炎症和重塑,是COPD气流受限的主要原因之一。多方面研究显示:COPD患者不同阶段血浆、诱导痰、肺泡灌洗液中IL-8含量存在明显差异,并且明显高于正常对照组〔4,5〕,提示 IL-8是促进 COPD气道炎症反应持续发展的重要因子之一,而且贯穿于COPD气道炎症反应过程的始终,发挥引发维持甚至加重气道炎症的重要作用。TNF-α和 IL-8在炎症反应中相互促进、相互调节。COPD急性加重期血清及痰液中的TNF-α和IL-8同步升高,且呈显著正相关,说明两者协同作用共同参与COPD的气道炎症反应过程。抑制TNF-α和IL-8的分泌,可能是阻止COPD炎症反应的重要手段之一。
VIP是由28个氨基酸组成的直链肽,属于胰高血糖素促胰岛素家族〔2〕,通过分布于肺血管平滑肌、气道平滑肌、气道上皮层、黏膜下的腺体、巨噬细胞、肺泡上皮和淋巴细胞等的受体而发挥抗炎作用。国外研究者在人的肺泡巨噬细胞表面发现有VIP受体表达,并证明VIP能下调IL-8的分泌〔6〕,对TNF-α分泌也有一定的抑制作用〔7〕。本实验证明,VIP可以抑制COPD患者PBMC分泌TNF-α和IL-8,并存在一定的量效关系。
VIP对炎性因子的调节作用属于转录水平,通过限制多种转录因子的重新表达或核迁移,使促炎因子的mRNA及合成的蛋白水平降低。涉及两条信号转导途径:①cAMP依赖途径,即通过抑制促炎因子cAMP反应元件结合蛋白(CBP)的合成〔8〕,降低促炎因子mRNA的合成。②cAMP非依赖途径,即VIP通过抑制核转录因子(NF)-κB的活性,从而阻止NF-κB核移位和与DNA的结合,优先阻止炎性介质基因启动区与NF-κB位点的结合,减少炎性介质的合成,通过相反机制提高抗炎因子IL-10 mRNA 和蛋白水平〔9〕。
VIP对COPD患者PBMC有一定的抗炎作用,但仅靠体内已有的VIP不足以发挥其应有的生物学作用,适量补充VIP或VIP类似物不乏是治疗COPD的一种有效方法。
1 中华医学会呼吸病学会分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)〔J〕.中华结核和呼吸杂志,2007;30(1):8-17.
2 Scheele I,Larsson K,Palmberg L.Budesonide enhances Toll-like receptor2 expression in activated bronchial epithelial cells〔J〕.Inhal Toxicol,2010;22(6):493-9.
3 Gallelli L,Pelaia G,Fratto D,et al.Effects of budesonide on P38 MAPK activation,apoptosis and IL-8 secretion,induced by TNF-alpha and Haemophilus influenzae in human bronchial epithelial cells〔J〕.Int Immunopathol Pharmacol,2010;23(2):471-9.
4 姚海燕,吴大玮.慢性阻塞性肺疾病患者诱导痰IL-8、TNF-a水平和炎症细胞的分布〔J〕.中国老年学杂志,2007;27(14):1366-9.
5 王春雷,蔡日丹,康 健,等.慢性阻塞性肺病患者细胞因子与氧自由基的相关性〔J〕.中国老年学杂志,2010;30(3):310-2.
6 Burian B,Storka A,Marzluf BA,et al.Vasoactive intestinal peptide(VIP)receptor expression in monocyte-derived macrophages from COPD patients〔J〕.Peptides,2010;31(4)603-8.
7 张海红,刘先洲,饶帮忠,等.血管活性肠肽对肺炎支原体诱导的人肺上皮细胞分泌TNF-α的影响〔J〕.武汉大学学报(医学版),2008;29(6)747-50.
8 Delgado M,Ganea D.Vasoactive intestinal peptide inhibits IL-8 production in human monocytes〔J〕.Biochem Biophys Res Commun,2003;301(4):825-32.
9 Catley MC,Sukkar MB,Chung KF,et al.Validation of the anti-inflammatory properties of small-molecule I kappaB Kinase(IKK)-2 inhibitors by comparison with adenoviral-mediated delivery of dominant-negative IKK1 and IKK2 in human airways smooth muscle〔J〕.Mol Pharmacol,2006;70(2):697-705.
〔2012-01-26收稿 2012-03-20修回〕
(编辑 袁左鸣)
R56
A
1005-9202(2012)17-3684-02;
10.3969/j.issn.1005-9202.2012.17.032
1 河北医科大学第二医院呼吸内科
王彦霞(1971-),女,主治医师,主要从事慢性阻塞性肺病的临床研究。

