通过下调Lewis肺癌细胞Vav3基因的表达抑制细胞增殖
王绍清 于秀文 赵春明 胡 南 (齐齐哈尔医学院病理教研室,黑龙江 齐齐哈尔 161006)
通过下调Lewis肺癌细胞Vav3基因的表达抑制细胞增殖
王绍清 于秀文 赵春明 胡 南 (齐齐哈尔医学院病理教研室,黑龙江 齐齐哈尔 161006)
目的 通过下调Lewis肺癌细胞Vav3基因的表达,观察Vav3表达对Lewis肺癌细胞体外增殖能力的影响。方法 设计合成3条针对小鼠Vav3的小干扰RNA序列(Vav3-mus-163,Vav3-mus-309,Vav3-mus-375),瞬时转染至Lewis肺癌细胞,采用Real-time PCR和Western印迹方法检测干扰前后Vav3的表达,并挑选出下调效果最好的一条干扰序列进行细胞MTT实验,分别在24、、72 h观察下调Vav3基因表达后对Lewis肺癌细胞体外增殖能力的影响。结果 瞬时转染三条siRNA序列Vav3-mus-163、Vav3-mus-309、Vav3-mus-375,检测Vav3基因相对表达含量分别为1.121 7±0.105 5、2.030 5±0.386 1和3.175 9±0.730 4。分别与Lewis肺癌细胞组(6.704 5±0.183 3)和阴性对照组(6.083 7±0.317 2)相比,转染Vav3-mus-163组和转染Vav3-mus-375组的Lewis肺癌细胞Vav3基因表达明显下调(P<0.01,P<0.05)。在蛋白水平瞬时转染三条小干扰RNA序列Vav3的表达分别为0.112 8±0.005 8、0.203 2±0.008 3、0.293 8±0.219 1,与Lewis肺癌细胞组(0.408 3±0.004 6)和阴性对照组(0.388 9±0.005 4)比较,转染Vav3-mus-163组Vav3蛋白表达明显下调(P<0.05)。Vav3-mus-163序列能够在mRNA水平和蛋白水平显著下调Vav3的表达。MTT法检测瞬时转染Vav3-mus-163后72 h细胞的增殖率为78.4%,与阴性对照组细胞增殖率92.9%相比差异显著(P<0.05)。结论 下调Lewis肺癌细胞中Vav3的表达,可使癌细胞的增殖能力下降,说明Vav3具有促进Lewis肺癌细胞增殖的作用。Vav3表达与肺癌的发生发展有关联。
Vav3;小干扰RNA;Lewis肺癌细胞;增殖
鸟嘌呤核苷酸交换因子(Vav)3属于Vav家族成员之一,活化的Vav可以催化Rho家族GTP酶活化蛋白(GTPase)结合的GDP变为GTP,从而激活GTPase活性,在细胞骨架调节、黏着斑通路、信号转导及细胞运动等过程中发挥重要调节作用〔1〕。有研究表明 Vav3 具有原癌基因的功能〔2,3〕。本文通过瞬时转染小干扰RNA(siRNA)序列下调Lewis肺癌细胞(LLC)中Vav3中的表达,观察其对肺癌细胞体外增殖能力的影响,进一步阐明Vav3在Lewis肺癌发生发展中的作用。
1 材料与方法
1.1 主要试剂 LCC购自湖南远泰生物技术公司,一抗山羊Vav3 antibody,二抗兔抗山羊IgG/辣根过氧化物酶(HRP)(Santa Cruz);Opti-MEM®I低血清培养基,LipofectamineTM2000(Sigma);蛋白提取试剂盒(ProMab);MTT检测试剂盒(KGA);Trizol(Invitrogen);RevertAidTMH Minus First Strand cDNA Synthesis Kit、Deoxyribonuclease I、RiboLockTMRibonuclease Inhibitor(Fermentas),SYBR Green PCR Master Mix(ABI)。
1.2 方法
1.2.1 细胞培养 LCC培养在含10%胎牛血清(FBS)的DMEM培养基,置于37℃,5%CO2细胞培养箱。
1.2.2 siRNA序列合成 四条siRNA双链由上海吉玛制药技术有限公司合成。Vav3-mus-163:正义5'UGG ACC CAG GUU UGC CGA ATT 3',反义 5'UUC GGC AAA CCU GGG UCC ATT 3';Vav3-mus-309:正义5'GGA CGA AAC UUA GCU UCA GTT 3',反义 5'CUG AAG CUA AGU UUC GUC CTT3';Vav3-mus-375:正义 5'GUA CCU AAA CCA GUA GAU UTT 3',反义 5'AAU CUA CUG GUU UAG GUA CTT 3';荧光标记阴性对照(Negative control,NC-FAM):正义 5'UUC UCC GAA CGU GUC ACG UTT 3',反义 5'ACG UGA CAC GUU CGG AGA ATT 3'。鼠GAPDH-420:正义 5'CAC UCA AGA UUG UCA GCA ATT 3',反义5'UUG CUG ACA AUC UUG AGU GAG 3'。
1.2.3 siRNA瞬时转染 实验分为5组:组1为未作处理组(LLC);组2:转染荧光标记的阴性序列对照组(Vav3-mus-NC);组3:转染 Vav3-mus-163;组4:转染 Vav3-mus-309;组5:转染Vav3-mus-375。
将5×104LCC接种在6孔板上,每孔含2 ml 10%FBS的DMEM培养基,24 h后细胞融合达到70%进行转染 。250 μl Opti-MEM®I稀释5 μl LipofectamineTM2 000,混匀室温下孵育5 min。250 μl Opti-MEM®I稀释 7.5 μl siRNA,室温下混匀。上述两种液体混合,在室温下孵育20 min,形成复合物。将siRNA-LipofectamineTM2000复合物加入到接种细胞的六孔板中并混合。37℃,5%CO2培养箱孵育6 h,对转染荧光标记的阴性序列对照组进行荧光检测并更换含10%FBS的DMEM培养基;孵育48 h后,收集各组细胞进行Western印迹、Real-time PCR检测。
1.2.4 Western印迹 提取细胞总蛋白,12%聚丙烯酰胺凝胶电泳(SDS-PAGE),用湿转法将蛋白转移至聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉37℃封闭2 h。加入一抗山羊Vav3抗体(1∶400),室温结合3 h。加入二抗兔抗山羊(1∶4 000),室温结合1 h。PVDF膜依次与抗体作用后与免疫印迹化学发光。3-磷酸甘油醛脱氢酶(GAPDH)为内参。选取下调效果最好的siRNA序列进行后续MTT实验。
1.2.5 Real-time PCR 总RNA提取:每样孔加入0.8 ml Trizol,按试剂使用说明提取细胞总RNA。基因组DNA的去除:按顺序依次加入总 RNA 1 μg,10×反应缓冲液 1 μl,Ribo-LockTMRibonuclease9 μl,再加入 DNase I(1 U/μl)1 μl,37℃孵育 30 min;加入 1 μl 25 mmol/L的乙二胺四乙酸(EDTA),65℃温育10 min使酶失活。
反 转 录 (20 μl 体 系): 总 RNA 2 μg,Oligo(dT)18(0.5 μmol/μl)1 μl,加入 DEPC 处理水至 11 μl,70℃ 5 min,冰上冷却。5×反应缓冲液 4 μl,4种 dNTP混合物(10 mmol/μl)2 μl,Ribonuclease 抑制剂(40 U/μl)0.5 μl,37℃ 5 min。Revert AidTMM-MulV 逆转录酶 (200 U/μl)1 μl,42℃ 60 min,70℃10 min后置于冰上。
Real-time PCR(25 μl体系):取上述反转录产物 1 μl,Vav3及GAPDH上下游各100 mmol/L,2×SYBR Green PCR Master混合液 12.5 μl,加 ddH2O至 25 μl。然后按下述条件反应:95℃ 5 min,94℃ 20 s,(Vav3 基因 56℃、GAPDH 基因 59℃)20 s,72℃ 20 s共40 个循环,72℃ 20 s,55℃ 10 s。见表1。
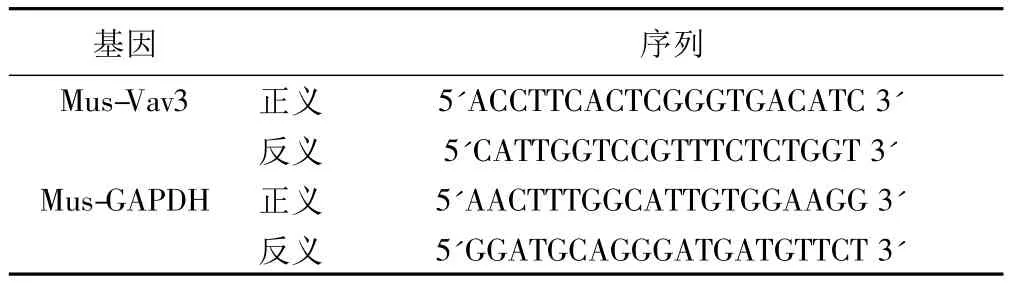
表1 小鼠Vav3及GAPDH扩增序列
1.2.6 MTT方法检测细胞增殖活性 实验步骤按MTT检测试剂盒说明书进行。在96孔板加入细胞100 μl/孔(1×104个细胞),置于37℃ 5%CO2细胞培养箱培养24 h。每孔加50 μl 1 × MTT,在 37℃ 孵育 4 h。吸出上清液,每孔加 150 μl DMSO使甲臜溶解,用平板摇床摇匀。酶标仪在570 nm波长处检测每孔的光密度。细胞存活率% =(干扰组细胞OD-本底OD/对照细胞OD-本底OD)×100%。
1.3 统计学方法 应用SSPS13.0统计软件进行分析,所有数据用±s表示,资料数据进行方差分析。
2 结果
2.1 转染率检测 转染后6 h,通过比对带有荧光标记的对照组细胞荧光镜与光镜下图像,观察siRNA的转染效率达到70%以上。
2.2 Real-time PCR检测 目的基因的扩增曲线符合4个特征性阶段的平滑的S型曲线,阴性对照(模板为水)无显著荧光信号,目的基因得到有效扩增。在熔点曲线中显示形状只有一个峰值,没有出现杂峰,提示无非特异性荧光信号,目的基因扩增产物单一。用2-ΔΔCt表示样品中Vav3 mRNA相对定量。Vav3 mRNA相对含量在第3组、第4组细胞中表达较1、2组明显下调(P<0.001,P<0.05),差异有统计学意义。见表2。
2.3 Western印迹分析 转染Vav3-mus-163序列的第3组细胞中Vav3蛋白表达明显下调。半定量分析蛋白表达的光密度值,第3组细胞中Vav蛋白表达下调明显,与第1组及第2组细胞相比差异有统计学意义(P<0.05)。结果显示转染VAV3-siRNA-163对Vav3基因的沉默效应最好,可以用于后续MTT实验。见图1,表2。
2.4 MTT检测细胞增殖活性 分别在转染VAV3-siRNA-163后24、48、72 h后检测细胞的增殖率,结果显示转染后72 h LLC增殖能力明显下降,与第1组及第2组细胞比较差异有统计学意义(P<0.05)。见表3。
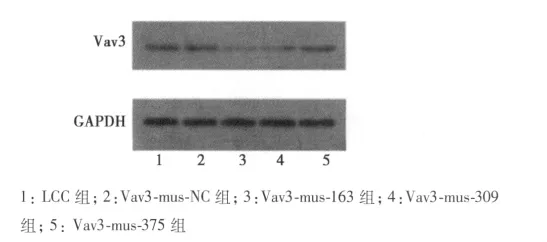
图1 各实验组细胞Vav3蛋白表达
表2 各组细胞中Vav3 mRNA和蛋白相对含量(±s,n=4)

表2 各组细胞中Vav3 mRNA和蛋白相对含量(±s,n=4)
与组1、组2比较:1)P<0.05;2)P<0.01;下表同
组别 Vav3 mRNA Vav3蛋白组1 3.175 9±0.730 4 0.293 8±0.219 1 6.704 5±0.183 3 0.408 3±0.004 6组2 6.083 7±0.317 2 0.388 9±0.005 4组3 1.121 7±0.105 52)0.112 8±0.005 81)组4 2.030 5±0.386 11)0.203 2±0.008 3组5
表3 各组细胞72 h的OD值(±s,n=4)

表3 各组细胞72 h的OD值(±s,n=4)
与1组、2组比较:1)P<0.05
组别 OD值 增殖率(%)组1 78.4 0.792 5±0.142 0 100.0组2 0.736 0±0.184 5 92.9组3 0.621 5±0.104 71)
3 讨论
Vav3基因定位于1号染色体,蛋白表达于胞质中,分子量为97 kD,在体内广泛分布。Vav3作为一种鸟嘌呤交换因子参与多种信号通路传导及细胞转化过程调节〔1〕。静息状态下Vav3 Ac结构域上174位的酪氨酸残基的磷酸化是Vav3活化的关键,上游Src家族及Syk家族酪氨酸蛋白激酶可以通过这种磷酸化形式激活Vav3〔4〕。活化后的Vav3通过C3肉毒素底物/蛋白活化激酶(Rac1/PAK)通路调控血管平滑肌细胞的增殖和运动功能,对维持心血管系统的稳态可能发挥重要作用〔5,6〕。原代神经细胞培养显示,Vav3促进神经细胞树突分支发育,而且在Vav3缺失小鼠模型中对小鼠小脑发育过程起重要的调节作用〔7〕。研究发现,Vav1/2/3缺失小鼠模型产生无效应的T细胞或B细胞,而且T细胞受体通路和B细胞受体信号通路也被破坏,说明Vav3参与T细胞和B细胞发育过程〔8〕。已有研究表明Vav3在多种肿瘤组织及肿瘤细胞中表达增加〔2,3,9,10〕,具有原癌基因的功能。在前列腺癌〔2〕和乳腺癌〔3〕的癌细胞中Vav3表达增加,并且通过磷脂酰肌醇3激酶-蛋白激酶B(PI3K-Akt)通路激活AR及ERα活性,促进肿瘤细胞的生长。
本研究结果提示,Vav3表达下调后,肿瘤细胞增殖率降低,说明Vav3在调控LLC生长过程中发挥重要的作用。作为一种鸟嘌呤调节因子,Vav3在相应的刺激因子作用下发挥其鸟嘌呤交换因子(GEF)活性,调节Rho家族GTPase活性,如Rac1、Cdc42、RhoA,进一步激活 MAPK信号通路、JNK信号通路,发挥改变细胞形态、促进细胞生长和诱导细胞转化等生物学效应,或者通过核转录因子(NF)-κB等转录水平的活性促进细胞增殖〔10〕。Vav3在调控LLC生长的机制有待进一步研究。
综上所述,本研究首次在细胞水平初步证实了Vav3在LLC中的表达及Vav3的表达与细胞增殖能力有关,Vav3在Lewis肺癌发生发展过程中可能有着重要的作用。
1 Movilla N,Bustelo XR.Biological and regulatory properties of Vav-3,a new member of the Vav family of oncoproteins〔J〕.Mol Cell Biol,1999;19(11):7870-85.
2 Dong ZY,Liu Y,Levin L,et al.Vav3 oncogene is involved in regulation of secretory phospholipase A2-Ⅱa expression in prostate cancer〔J〕.Oncol Rep,2011;25(6):1511-6.
3 Lee K,Liu Y,Mo JQ,et al.Vav3 oncogene activates estrogen receptor and its overexpression may be involved in human breast cancer〔J〕.BMC Cancer,2008;8(1):158.
4 Bustelo XR.Regulatory and signaling properties of the Vav family〔J〕.Mol Cell Biol,2000;20(5):1461-77.
5 Sauzeau V,Sevilla MA,Rivas-Elena JV,et al.Vav3 proto-oncogene deficiency leads to sympathetic hyperactivity and cardiovascular dysfunction〔J〕.Nat Med,2006;12(7):841-5.
6 Toumaniantz G,Ferland-McCollough D,Cario-Toumaniantz C,et al.The Rho protein exchange factor Vav3 regulates vascular smooth muscle cell proliferation and migration〔J〕.Cardiovasc Res,2010;86(1):131-40.
7 Quevedo C,Sauzeau V,Menacho-Márquez M,et al.Vav3-deficient mice exhibit a transient delay in cerebullar development〔J〕.Mol Biol Cell,2010;21(6):1125-39.
8 Fujikawa K,Miletic AV,Alt FW,et al.Vav1/2/3-null mice define an essential role for Vav family proteins in lymphocyte development and activation but a differential requirement in MAPK signaling in T and B cells〔J〕.J Exp Med,2003;198(10):1595-608.
9 Sal hia B,Tran NL,Chan A,et al.The gluanine nucleotide exchange factors trio,Ect2,and Vav3 mediate the invasive behavior of glioblastoma〔J〕.Am J Pathol,2008;173(6):1828-38.
10 Falmby TR,Abe K,Kamoub AE,et al.Vav transformation requires activation of multiple GTPases and regulation of gene expression〔J〕.Mol Cancer Res,2004;2(12):702-11.
〔2012-01-04收稿 2012-01-24修回〕
(编辑 袁左鸣)
R73
A
1005-9202(2012)17-3726-03;
10.3969/j.issn.1005-9202.2012.17.051
黑龙江省卫生厅科研课题(No.2010-231)
王绍清(1979-),男,博士,讲师,主要从事肿瘤遗传学方面的研究。

