鹿茸多糖分离纯化及抗氧化活性研究
赵玉红,金秀明,韩 睿
(东北林业大学林学院食品科学系,黑龙江哈尔滨 150040)
鹿茸多糖分离纯化及抗氧化活性研究
赵玉红,金秀明,韩 睿
(东北林业大学林学院食品科学系,黑龙江哈尔滨 150040)
采用DEAE-52离子交换层析和Sepharose CL-6B凝胶排阻层析对鹿茸粗多糖进行分离纯化,并通过对DPPH自由基、羟基自由基(·OH)、超氧阴离子自由基(·)清除能力和还原能力的测定,研究了粗多糖及纯化后多糖的抗氧化能力。结果表明:DEAE-52离子交换层析和Sepharose CL-6B凝胶排阻层析对鹿茸多糖分离效果较好,可以分离纯化得到一种单一多糖;粗多糖和纯化后多糖对DPPH·、·OH·均有清除作用,且具有一定的还原能力,纯化后多糖抗氧化活性和还原能力均大于粗多糖。
鹿茸,多糖,分离纯化,抗氧化
多糖是一类天然高分子化合物,与蛋白质、核酸共同列为最基本的三大生命物质。随着分子生物学的发展,多糖的生物功能逐渐被人们认识,它存在于植物、微生物、藻类及动物体内。近年来,从自然资源中提取分离出的多糖在生物化学和药理学等领域已引起广泛关注[1],它在免疫调节、细胞的识别及细胞间物质运输等方面都发挥着巨大作用,具有抗肿瘤、抗氧化、保护心血管系统等功能[2]。鹿茸是雄性梅花鹿或马鹿头上一对尚未骨化的幼角,末端呈圆形,表面有绒状绒毛,内部是结缔组织和软骨组织,代谢旺盛,具有生长速度快,可再生的特点[3]。鹿茸作为药材应用在中国已有上千年的历史,是滋补强壮佳品。《神农本草经》和《本草纲目》对其都有记载,《中国药典》中介绍鹿茸的功能为“壮肾阳,益精血,强筋骨,调冲任,托疮毒”[4]。鹿茸中含有丰富的蛋白质、氨基酸、多糖、磷脂、胆固醇等多种活性物质。人们对鹿茸多糖的活性进行了研究,为鹿茸的开发利用提供了理论基础。王本祥等[5]对胃溃疡老鼠喂食鹿茸多糖提取物,发现鹿茸多糖对多种类型胃溃疡均有明显治疗作用。陈晓光[6]通过对肝损伤小鼠的研究,证明鹿茸多糖具有抗肝损伤及抗脂质过氧化的作用。Sunwoo[7]等对马鹿茸中蛋白多糖进行分离纯化,经电泳图谱分析证明鹿茸中至少含有三种蛋白多糖。本文以梅花鹿茸为原料制备鹿茸多糖(PAPS),采用DEAE-52离子交换层析和CL-6B琼脂糖凝胶层析进行分离纯化,并通过体外抗氧化能力实验,考察了粗多糖及纯化后多糖的抗氧化活性,以期为进一步研究其构效关系提供实验基础,为鹿茸多糖的应用及研发提供理论依据。
1 材料与方法
1.1 材料与仪器
梅花鹿鹿茸 黑龙江省大庄园集团提供;DEAE-52纤维素交换树脂 美国 Whatman公司; Sepharose CL-6B 美国Pharmacia公司;MD-44透析袋、DPPH 美国Sigma公司;邻苯三酚、水杨酸、硫酸亚铁和铁氰化钾等 均为分析纯,天津东正精细化学试剂厂。
TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司;HL-2数显恒流泵 上海青浦沪西仪器厂;BSZ-100电脑自动部分收集器 上海精科实业有限公司。
1.2 实验方法
1.2.1 鹿茸多糖的提取 新鲜鹿茸脱皮,去血后切成1~2cm3的小块,冷冻干燥24h,粉碎,过40目筛得鹿茸粉末。取一定量鹿茸粉末,石油醚浸泡12h脱脂,之后加入20倍体积0.2mol/L pH8.0磷酸盐缓冲液100℃提取4h,4000r/min离心15min,连续提取两次,合并上清液,浓缩到原体积的1/3~2/3,加入3倍体积95%乙醇,充分搅拌,4℃浸泡12h,离心,收集醇沉物,至通风处晾干后,将沉淀物加水复溶,用sevage法除蛋白2~3次,透析48h,浓缩,冷冻干燥得鹿茸粗多糖。
1.2.2 离子交换层析 鹿茸多糖初级分离纯化采用DEAE-52离子交换柱。称取鹿茸多糖80mg,溶于10m L蒸馏水中,4000 r/m in离心10m in,取上清液上样,依次用蒸馏水,0.3、0.5、0.7、1mol/L NaCl溶液梯度洗脱,流速控制为 0.5m L/min,分管收集,每管5m L,苯酚硫酸法跟踪检测多糖含量,绘制洗脱曲线,合并同一吸收峰的洗脱液,蒸馏水透析24h,减压浓缩,冷冻干燥,即得DEAE-52纯化多糖。
1.2.3 凝胶排阻层析 鹿茸多糖进一步分离纯化采用Sepharose CL-6B凝胶排阻层析柱。将经DEAE-52分离后的多糖溶于蒸馏水,浓度为10mg/m L,以2m L/次上样,蒸馏水洗脱,流速控制为30m L/h,每管5m L,苯酚硫酸法跟踪检测,绘制洗脱曲线,收集、合并相同洗脱组分,透析,冷冻干燥即得 Sepharose CL-6B纯化多糖。
1.2.4 鹿茸多糖紫外扫描 将Sepharose CL-6B纯化后精制多糖配成一定浓度溶液,190~400nm下进行紫外光谱扫描,以蒸馏水作空白。
1.2.5 鹿茸多糖抗氧化活性
1.2.5.1 清除DPPH·能力测定 取不同浓度的样品溶液2m L和0.2mmol/L DPPH乙醇溶液2m L,加入同一具塞试管中,混匀后室温避光反应 30m in,在517nm下测吸光值Ai;2m L DPPH溶液加2m L蒸馏水的吸光值为Ao;2m L无水乙醇加2m L样品溶液吸光值为Aj,同时以等体积的蒸馏水和无水乙醇混合调空白[8]。自由基清除率根据下列公式计算:

1.2.5.2 清除羟基自由基(·OH)能力测定 采用Fenton反应[9],分别在试管中加入各浓度样品溶液1m L,6mmol/L FeSO41m L,6mmol/L水杨酸乙醇溶液1m L,6mmol/L H2O21m L,混匀,37℃水浴加热30m in,510nm下测吸光值Ai,将体系中样品溶液改为1m L蒸馏水,测得吸光值Ao,将体系中H2O2用蒸馏水代替,测得吸光值Aj。
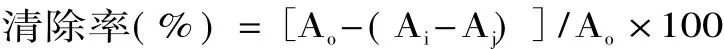

1.2.5.4 还原能力测定 取不同浓度样品溶液1m L,加入2.5m L pH6.6磷酸盐缓冲液及2.5m L 1%的铁氰化钾溶液,于50℃水浴20min,迅速冷却,加入2.5m L 10%的三氯乙酸,以4000 r/min离心7m in,取上清液2.5m L,依次加入2.5m L蒸馏水,0.5m L 0.1%三氯化铁溶液,混匀,静置10min,在700nm处测体系吸光值。吸光值大小与样品溶液还原能力呈正相关[11]。
1.2.6 数据统计分析 所有实验数据重复测定3次,所得结果为平均值 ±标准差(±s,n=3),采用Excel2003及 Minitab16数学统计软件对数据进行分析。
2 结果与分析
2.1 离子交换柱层析纯化
鹿茸粗多糖经DEAE-52离子交换柱层析后,分离结果如图1所示。

图1 鹿茸多糖DEAE-52的洗脱曲线Fig.1 Elution curve of antler polysaccharide on DEAE-52 chromatography
由图1可知,离子交换层析后得到4个洗脱峰,分别为蒸馏水、0.3mol/L NaCl、0.5mol/L NaCl和0.7mol/L NaCl洗脱部分,依次命名为PAPS1、PAPS2、PAPS3、PAPS4,其中PAPS3峰面积较大,含量最多,收集此部分洗脱液,透析后冷冻干燥,进行凝胶排阻层析。
2.2 凝胶排阻层析柱纯化
对于经过离子交换层析得到的组分PAPS3,虽然洗脱峰上较为对称。但是在分子水平上,其分子量分布、残留片段以及结构并不一致。因此,需要对其进行进一步的精细结构研究。多糖 PAPS3过Sepharose CL-6B柱,洗脱曲线如图2所示。

图2 鹿茸多糖Sepharose CL-6B的洗脱曲线Fig.2 Elution curve of antler polysaccharide on Sepharose CL-6B chromatography
鹿茸多糖PAPS3经进一步纯化后得到两个洗脱峰,PAPS3a和PAPS3b。由图2可知,PAPS3b含量较少,因此不做后续深入研究。收集PAPS3a组分,进行纯度鉴定。
2.3 鹿茸多糖紫外扫描图谱
对经Sepharose CL-6B分离纯化后的多糖进行紫外扫描,其扫描结果见图3。

图3 PAPS3a紫外扫描光谱Fig.3 UV spectrum of PAPS3a
由图3可知,分离纯化后的鹿茸多糖在190nm处有明显的多糖特征吸收峰,在260nm和280nm没有明显的吸收峰,表明PAPS3a基本无蛋白质和核酸杂质存在。此结果与钱韵旭等[12]对纯化后白花蛇草多糖进行紫外光谱分析结果一致,说明PAPS3a纯度较高。
2.4 鹿茸多糖抗氧化活性分析
2.4.1 清除DPPH·能力分析 DPPH是一种稳定的有机自由基,其溶液在517nm处有强吸收,当存在自由基清除剂时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其所接受的电子数成定量关系,因而可用分光法进行定量分析,评价目标物抗氧化活性强弱[13]。
由图4可知,PAPS及PAPS3a对DPPH·均有清除作用,且随质量浓度增加而增大,其中多糖活性顺序为PAPS3a>PAPS。PAPS在该体系中的半抑制浓度IC50为8.9mg/m L,PAPS3a的IC50为7.0mg/m L。采用单因素方差分析对数据进行分析比较,两者对DPPH·清除能力差异显著(p<0.05)。当 PAPS3a浓度为12mg/m L时,DPPH·清除率为75.3%。刘晓宁[14]对鱼头中多糖抗氧化活性进行研究,得知当多糖浓度为4mg/m L时,DPPH·清除率达到最大为45.8%,此后,随着浓度的增加,清除率逐渐降低。说明PAPS3a具有较强的抗氧化活性。
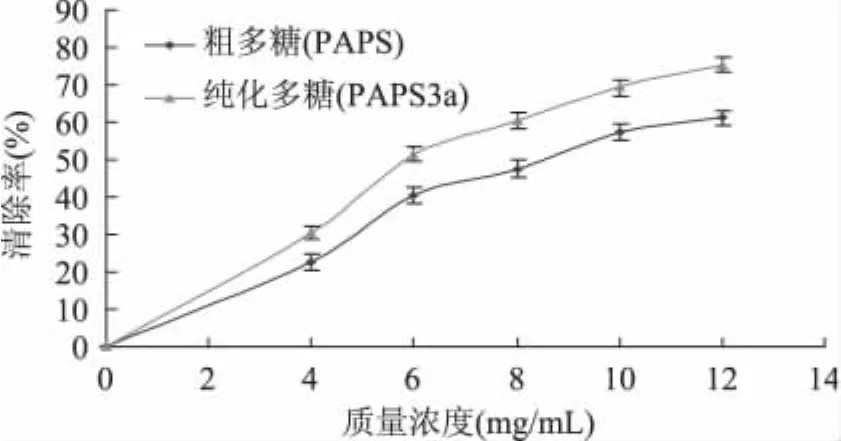
图4 鹿茸多糖清除DPPH·能力比较Fig.4 Scavenging effect of antler polysaccharides on DPPH·
2.4.2 清除羟基自由基(·OH)能力分析 ·OH是最活泼的活性氧自由基,也是危害最大的氧自由基。它可以与活细胞中的任何分子发生反应而造成损害,且反应速度极快,对细胞内DNA破坏最大[15]。
由图5可知,当质量浓度小于4mg/m L时,二者对自由基清除率相差不多,超过4mg/m L后,PAPS3a清除自由基能力明显高于PAPS。在一定范围内,PAPS及PAPS3a对·OH清除能力随质量浓度增加不断增大,当浓度大于10mg/m L时,清除率随浓度增大幅度减缓。PAPS在该体系中的IC50为7.8mg/m L,PAPS3a的 IC50为6.6mg/m L。两者差异显著(p<0.05)。当浓度为12mg/m L时,PAPS3a对·OH清除率可达 86.4%。叶明等[16]对黑芝胞体多糖清除·OH能力分析得知,当多糖浓度为40mg/m L时,·OH清除率为39.8%。·OH是活性氧的一种,在人体内生物活性最活泼,许多疾病的产生与引发都与其有关,如肿瘤、癌症、炎症、衰老、动脉粥样硬化等大多是因为自由基得不到及时地消除而引起的[17]。鹿茸多糖PAPS及PAPS3a对·OH都有明显的清除作用,且作用较强,进一步说明鹿茸多糖具有较强的生物活性。
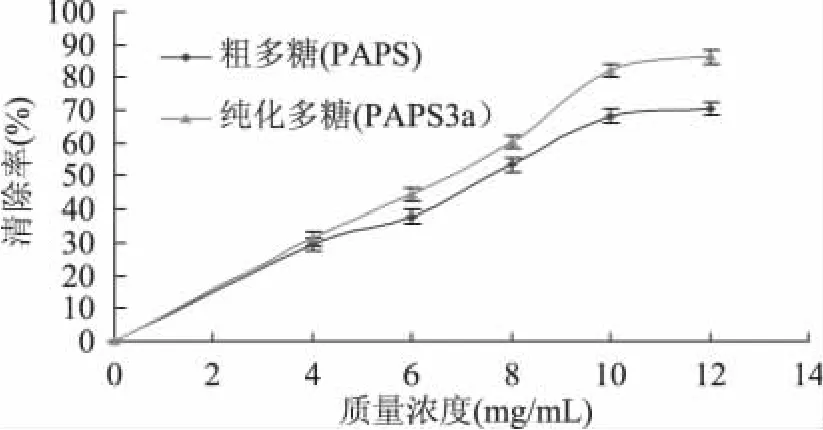
图5 鹿茸多糖清除·OH能力比较Fig.5 Scavenging effect of antler polysaccharides on·OH
2.4.3 清除超氧阴离子(O2-·)能力分析 邻苯三酚在碱性条件下发生自氧化,释放出超氧阴离子,当释放出的超氧阴离子受到抑制或清除时,就可以阻止中间产物的积累。因此可以通过邻苯三酚自氧化速率计算样品对超氧阴离子的清除率[18]。
由图6可知,随着质量浓度的增加,PAPS和PAPS3a对超氧阴离子清除率都增大,质量浓度小于6mg/m L时,两种多糖对超氧阴离子清除率相差不大;质量浓度大于6mg/m L时,PAPS3a对·清除率大于PAPS。PAPS在该体系中的IC50为9.4mg/m L,PAPS3a的 IC50为 7.8mg/m L,两者差异显著(p<0.05)。当PAPS3a浓度为10mg/m L时,对·清除率为62.5%。有报道称[19],当浓度为10mg/m L时,破壁灵芝孢子多糖对·清除率为 59.3%。说明PAPS3a具有较强的清除·的能力。
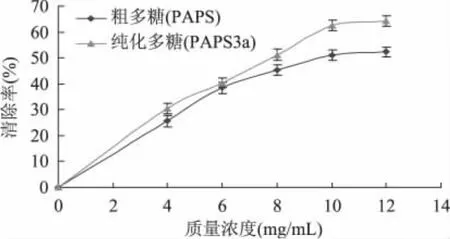
图6 鹿茸多糖清除超氧阴离子自由基的能力比较Fig.6 Scavenging effect of antler polysaccharides on superoxide radical
2.4.4 还原能力分析 一般情况下,样品的还原力与抗氧化活性有明显相关性。抗氧化剂通过自身的还原作用给出电子从而清除自由基。还原能力越强,抗氧化性越强。通常采用铁氰化钾氧化样品来表征还原力,体系中Fe3+在抗氧化剂的促进下变成Fe2+,形成的Fe2+在700nm处有吸收峰检出。最终测定的吸光值越大,还原力越强[20]。因此,一种物质的还原力可作为考察其潜在抗氧化能力的重要指标。
由图7可知,鹿茸多糖的还原能力随着质量浓度的增加而增大,PAPS3a还原力大于PAPS。当多糖浓度为12mg/m L时,吸光值(700nm)分别为0.508和0.302,两者差异显著(p<0.05)。破壁灵芝孢子多糖在浓度为5mg/m L时,还原力的吸光值为0.942[19]。由以上结果可知,鹿茸多糖具有较强的抗氧化活性,与一些动物性或植物性多糖相比,具有较强的清除自由基能力,但还原力相对弱一些。

图7 鹿茸多糖还原能力比较Fig.7 Reducing effect of antler polysaccharides
3 结论
从鹿茸中提取的粗多糖,经DEAE-52离子交换层析洗脱后分离出四种多糖组分:PAPS1、PAPS2、PAPS3、PAPS4;主要组分 PAPS3经过 Sepharose CL-6B凝胶排阻层析后得到单一多糖组分PAPS3a。紫外扫描表明该方法体系精制的鹿茸多糖纯度较高,可作为鹿茸多糖纯化的有效方法。PAPS和PAPS3a对DPPH·、·OH、·都有一定的清除作用,鹿茸纯化多糖抗氧化活性优于粗多糖。
[1]Yang Liqun,Zhang LiMing.Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J].Carbohydrate Polymers,2009,76 (3):349-361.
[2]Chen Ruizhan,Meng Fanlei,Liu Zhiqiang,et al.Antitumor activities of different fractions of polysaccharide purified fromOrnithogalumcaudatumAit[J].Carbohydrate Polymers,2010,80 (3):845-851.
[3]杨若明,张经华,张林源,等.麋鹿茸、马鹿茸和梅花鹿茸营养成分比较研究[J].广东微量元素科学,2000,7(12): 47-51.
[4]国家药典委员会.中国药典(一部)[S].2005:226.
[5]王本祥,刘爱晶,程秀娟,等.鹿茸多糖抗溃疡作用[J].药学学报,1985,20(5):321-325.
[6]陈晓光.鹿茸多糖抗肝损伤作用的生化药理学研究[D].长春:吉林大学,2002.
[7]Hoon H Sunwoo,Takuo Nakano,Jeong S Sim.Isolation and characterization of proteoglycans from growing antlers of wapiti (Cervus elaphus)[J].Comparative Biochemistry and Physiology Part B,1998,121:437-442.
[8]吕英华,苏平,那宇,等.桑椹色素体外抗氧化能力研究[J].浙江大学学报,2007,3(1):102-107.
[9]吴兰芳,景永帅,张振东,等.吊灯花提取物体外抗氧化活性评价[J].食品工业科技,2010,31(11):78-80.
[10]吕晓玲,邱松山,孙晓侠,等.油茶总皂苷的抗氧化及清除自由基能力初步研究[J].食品科学,2005,26(11):86-90.
[11]Bena-Marie Lue,Nina Skall Nielsen,Charlotte Jacobsen,et al.Antioxidant properties of modified rutin esters by DPPH,reducing power,iron chelation and human low density lipoprotein assays[J].Food Chemistry,2010,123(2):221-230.
[12]钱韵旭,刘裴,李莉,等.白花蛇草多糖的分离纯化及PMP柱前衍生高效液相分析[J].云南中医学院学报,2010,33 (3):43-46.
[13]聂少平,谢明勇,罗珍.用清除有机自由基DPPH法评价茶叶多糖的抗氧化活性[J].食品科学,2006,27(3):34-36.
[14]刘晓宁.鱼头多糖的分离提取、纯化及功能鉴定[D].天津:天津科技大学,2007.
[15]Nicholas JMiller,Julia Sampson,Luis P Candeias,et al. Antioxidant activities of carotenes and xanthophylls[J].FEBS letters,1996,384(2):240-242.
[16]叶明,陈九山,杨柳,等.黑芝胞外多糖提取工艺条件优化及体外抗氧化活性研究[J].食品科学,2009,30(8):47-50.
[17]田光辉,刘存芳,辜天琪,等.野生藿香中多糖的提取与测定及抗氧化活性研究[J].食品工业科技,2010,31(2): 249-251.
[18]李朝阳,李珊,刘魁,等.大蒜多糖的分离纯化及抗氧化性的研究[J].河北科技大学学报,2007,28(3):243-346.
[19]李坚.破壁灵芝孢子中多糖的提取、纯化及抗氧化的研究[D].长沙:湖南农业大学,2010.
[20]Isabel C F R Ferreira,Maria-Joäo R P Queiroz,Miguel Vilas-Boas,et al.Evaluation of the antioxidant properties of diarylamines in the benzo[b]thiophene series by free radical scavenging activity and reducing power[J].Bioorganic&Medicinal Chemistry Letters,2006,1384-1387.
Purification and antioxidant activity of polysaccharide from velvet antler
ZHAO Yu-hong,JIN Xiu-m ing,HAN Rui
(College of Forestry,Northeast Forestry University,Harbin 150040,China)
DEAE-52 ion-exchange column chromatog raphy and Sepharose CL-6B gel exc lusion chromatog raphy were used to isolate the crude polysaccharide.Antioxidant activities of the crude and purified polysaccharide were evaluated through their capability of scavenging DPPH·,·OH,· rad icals and reducing power.The result showed that,DEAE-52 ion-exchange column chromatography and Sepharose CL-6B gel exc lusion chrom atog raphy were suitab le for separating and purifying polysaccharide from velvet antlers,a kind of purified polysaccharide was isolated from the crude polysaccharide.Both of the polysaccharide crude and purified had significanteffecton scavenging DPPH·,·OH,·radicals and also had reduction ability.Furthermore purified polysaccharide had m ore ac tivity antioxidant than c rude polysaccharide.
antler;polysaccharide;isolation and purification;antioxidation
TS201.2+3
A
1002-0306(2012)12-0155-04
2011-10-10
赵玉红(1968-),女,博士,副教授,研究方向:林特产品精深加工。
黑龙江省教育厅科学技术研究指导项目(11553036)。

