酶解水牛奶酪蛋白制备抗氧化活性肽工艺的研究
闭秋华,宫 霞,白文娟,陈文硕,李全阳,*
(1.广西大学轻工与食品工程学院,广西南宁 530004;2.上海商学院旅游与食品学院,上海 200235)
酶解水牛奶酪蛋白制备抗氧化活性肽工艺的研究
闭秋华1,宫 霞2,白文娟1,陈文硕1,李全阳1,*
(1.广西大学轻工与食品工程学院,广西南宁 530004;2.上海商学院旅游与食品学院,上海 200235)
以水解度、还原能力和DPPH自由基清除率为检测指标,比较筛选碱性蛋白酶、中性蛋白酶、胰蛋白酶、木瓜蛋白酶和胃蛋白酶水解水牛奶酪蛋白制备抗氧化活性肽,筛选出中性蛋白酶是最适用酶。应用单因素和响应面法对酶解工艺进行优化。结果表明:中性蛋白酶酶解酪蛋白的最佳工艺参数:pH为6.9,温度为46℃,酶与底物浓度比为4.6%,酶解时间4.0h,此时10mg/mL酶解物的还原能力为0.457。实测结果与预测值符合性良好。
水牛奶,酪蛋白酶解物,抗氧化活性肽,响应面优化法
目前,各种功能性的生物活性多肽受到了研究者的的青睐。这些功能性多肽主要包括抗氧化肽、阿片活性肽、免疫调节肽、抑制肽、抗菌肽、抗凝血肽、酪蛋白糖肽等[1]。其中,乳源性生物活性肽的研究最为深入,已经从乳蛋白中发现了几十种具有重要生理功能的生物活性肽。酪蛋白约占牛奶中蛋白的80%,酪蛋白源的生物活性肽的生理功能越来越引起人们的重视,它们具有刺激肠道受体激素和酶分泌,发挥调节机体免疫和胃肠道功能、降血压、抗血栓、抗病毒等生理作用[2]。其中,抗氧化活性肽是研究最多的功能性活性肽之一[3]。研究发现荷斯坦牛奶酪蛋白及其酶解物具有抗氧化活性,如Laakso等[4]研究发现牛乳酪蛋白具有抑制脂肪氧合酶催化脂肪过氧化作用;Rival等[5]发现酪蛋白和酪蛋白的水解物具有抑制脂肪氧合酶的特性,且β-CN(β-酪蛋白)的胰蛋白酶水解物具有很强地抑制脂肪氧合酶的特性;Diaz和Decker[6]利用胰蛋白酶水解酪蛋白得到了酪蛋白f169~176片段具有抑制亚油酸氧化的作用。但是,目前对于水牛奶中酪蛋白各种生物活性肽的研究还没有相关报告。因此,本研究以水牛奶为原料,通过分离得到酪蛋白,酶法制备抗氧化活性肽,并对其工艺进行筛选和参数优化,为水牛奶酪蛋白制备抗氧化活性多肽的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
胰蛋白酶、木瓜蛋白酶、胃蛋白酶 Am resco公司;中性蛋白酶、碱性蛋白酶 Solarbio公司;新鲜水牛奶,二苯代苦味酰基自由基(DPPH),其他试剂均为分析纯。
PB-10型酸度计 Sartorius公司;722S型可见分光光度计 上海精密科学仪器有限公司;JRA-2型数显磁力搅拌水浴锅 江苏省金坛市科杰仪器厂;LG10-2.4A型离心机 北京医用离心机厂。
1.2 实验方法
1.2.1 水牛奶中酪蛋白的分离[7]采用离心法对新鲜水牛乳进行脱脂,离心后去掉上层脂肪。取脱脂新鲜牛奶置于烧杯中,预热后加入醋酸溶液,调pH至其等电点附近使酪蛋白沉淀充分。过滤后去除乳清,真空干燥后保存待用。
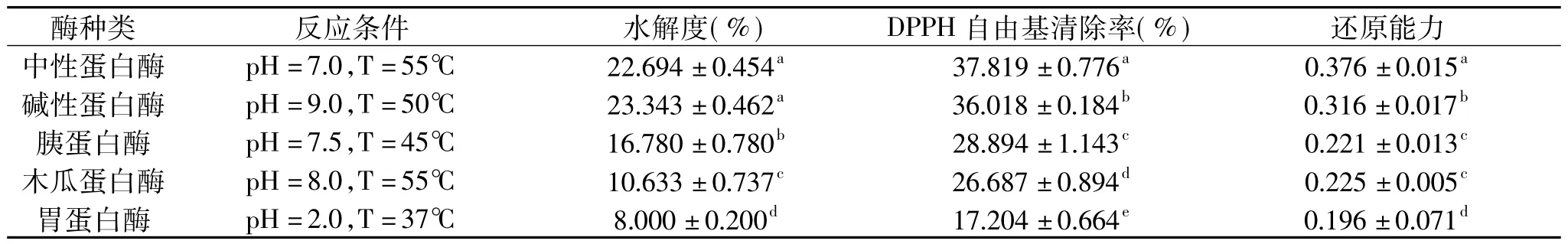
表2 不同蛋白酶酶解酪蛋白的水解度、DPPH自由基清除率、还原能力测定结果Table 2 Results of degree of hydrolysis,DPPH radical-scavenging capacity and reducing power of five enzymes hydrolysis
1.2.2 水牛奶酪蛋白抗氧化肽的制备[8]酪蛋白酶解物的制备:水牛奶酪蛋白7.5g,溶于150m L蒸馏水,90℃处理5min;冷却,调节pH至所用酶的最适值。置于恒温磁力搅拌水浴锅上,水浴调节到酶的最适作用温度,然后加入蛋白酶启动水解反应。在反应过程中以1.0mo1/L的NaOH维持pH恒定,水解至预定时间后,酶解物调 pH7.0。水解结束后,100℃灭酶10m in,以8000 r/min离心10m in,取上清液进行测定。
1.2.3 水牛奶酪蛋白酶解工艺的研究
1.2.3.1 酶筛选实验 本实验选用胃蛋白酶、胰蛋白酶、木瓜蛋白酶、碱性蛋白酶和中性蛋白酶,分别在各种酶的最适pH和温度下,以相同的酶与底物比(E∶S)对酪蛋白进行酶解反应,以酶解物的DPPH自由基清除率、还原能力、水解度作为指标,筛选合适的蛋白酶。
1.2.3.2 单因素实验 以水解度、还原力和DPPH自由基清除率为考察指标,考察pH(6.0、6.5、7.0、7.5、8.0)、温度(35、40、45、50、55℃)、时间(1、2、3、4、5h)以及E∶S(1.0、2.0、3.0、4.0、5.0%)对酶解效果的影响。每个处理做3个重复。
1.2.3.3 酶解工艺优化 根据Box-Benhnken的中心组合实验设计原理,在单因素实验的基础上,选取以pH(A)、温度(B)、E∶S(C)对酪蛋白酶解物的还原能力影响显著的3个因素,采用三因素三水平的响应面分析方法,用Design-Expert 7.0来对实验结果进行统计分析。
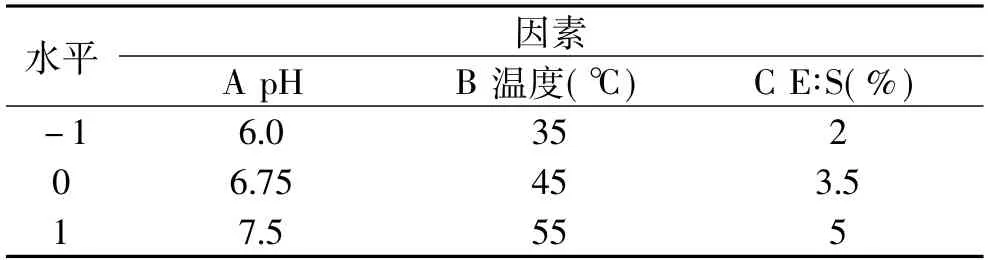
表1 响应面分析因素与水平表Table 1 Factors and levels of response surface analysis
1.2.4 水解度的测定[9]pH-stat法。酪蛋白的水解度(DH)根据消耗的NaOH的量表示,按下式进行计算:
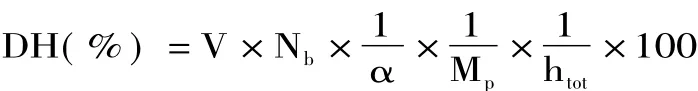
式中:htot:单位质量蛋白质中肽键的总量(mmoL-1);V:水解过程中所消耗的碱量(m L);Nb:碱液的浓度(mol·L-1);Mp:酶解物中蛋白质的质量(g);α:α-氨基的平均解离度。
1.2.5 酶解后产物抗氧化活性的测定
1.2.5.1 酶解后产物还原能力测定[10]将样品按一定浓度溶于蒸馏水中,取1m L样品溶液,然后加入2.5m L,0.2mol/L PBS(磷酸盐缓冲溶液,pH6.6)和2.5m L 1%的铁氰化钾溶液于试管中混匀。混合物在50℃水浴中反应20m in,迅速冷却并加入2.5m L 10%的三氯乙酸,混匀后以3000r/min离心10m in。取2.5m L上清液加入0.5m L 0.1%的三氯化铁溶液混匀,再加2.5m L蒸馏水摇匀,以蒸馏水调零,在700nm处测定吸光度。吸光度值越高,说明样品的还原能力越强。
1.2.5.2 酶解后产物清除 DPPH自由基活性的测定[11]配制浓度为2×10-4mol·L-1DPPH无水乙醇溶液,避光保存。取2m L样品与2m L DPPH无水乙醇溶液混合,并剧烈振荡,在室温下避光反应30min,然后在517nm处测定其吸光度值Ai。空白组以等体积无水乙醇溶液替代DPPH溶液,对照组以等体积蒸馏水替代样品溶液。DPPH自由基清除率用下式计算:
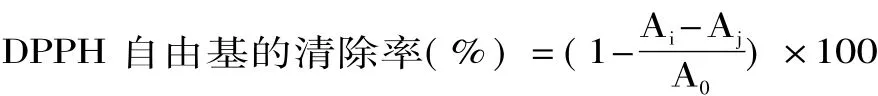
式中:A0-对照组吸光度值;Ai-样品组吸光度值;Aj-空白组吸光度值。
2 结果与讨论
2.1 酶筛选实验结果
本实验选用胃蛋白酶、胰蛋白酶、木瓜蛋白酶、碱性蛋白酶和中性蛋白酶五种蛋白酶分别对水牛奶酪蛋白进行水解。利用SPSS17.0对实验结果进行分析,重复三次测定,结果见表2。
从表2可以看出,五种酪蛋白酶解物中,碱性蛋白酶的水解度最大,中性蛋白酶次之,但两者之间不存在显著性差异,而中性蛋白酶酶解物还原能力和DPPH自由基清除率显著高于其他的四种蛋白酶,说明其酶解物的抗氧化活性最高。因此本实验选用中性蛋白酶对水牛奶酪蛋白进行酶解制备抗氧化活性多肽。
2.2 单因素实验结果
2.2.1 pH对水牛奶酪蛋白酶解制备抗氧化肽的影响 pH对中性蛋白酶水解水牛奶酪蛋白影响结果见图1。
从图1可以看出中性蛋白酶随着pH的增加,水解度也迅速增加,当pH为7.0时,水解度、还原力和DPPH自由基清除率都达到最大值,分别为23.62%、0.401、39.34%,随着pH的继续增加,水解度、还原力和DPPH自由基清除率逐渐下降。因此,反应pH为 7.0为中性蛋白酶反应的最适pH。
2.2.2 温度对水牛奶酪蛋白酶解制备抗氧化肽的影响 温度对中性蛋白酶水解水牛奶酪蛋白影响结果见图2。
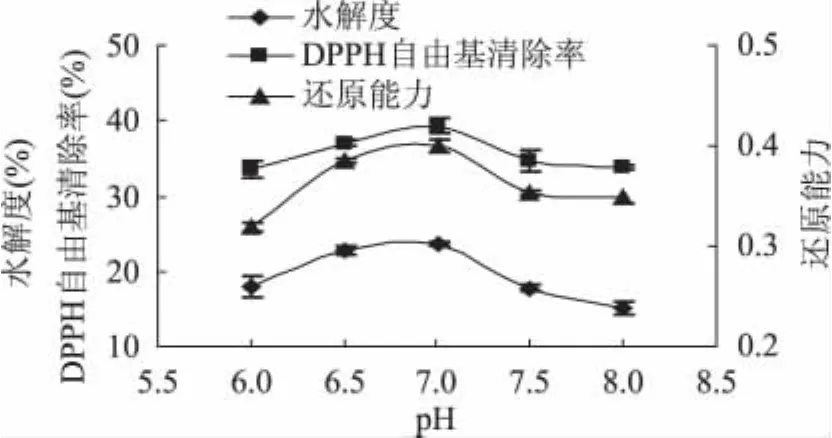
图1 pH对样品的水解度、DPPH自由基清除率和还原能力的影响Fig.1 Effect of pH on degree of hydrolysis,DPPH radical-scavenging capacity and reducing power of hydrolysis
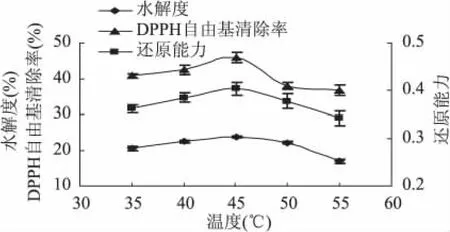
图2 温度对样品的水解度、DPPH自由基清除率和还原能力的影响Fig.2 Effect of temperature on degree of hydrolysis,DPPH radical-scavenging capacity and reducing power of hydrolysis
从图2可以看出,随着温度的增加,水解度、还原能力和DPPH自由基清除率随之增大,温度达到45℃时,水解度、酶解物的还原能力和DPPH自由基清除率最大值,分别为23.90%、0.410、45.90%。随着温度的逐渐增加,它们反而逐渐降低。因此,当温度为45℃时,反应具有最大的水解度,且其酶解物具有最高还原能力和DPPH自由基清除率,选择45℃作为中性蛋白酶的最适反应温度。
2.2.3 时间对水牛奶酪蛋白酶解制备抗氧化肽的影响 时间对中性蛋白酶水解水牛奶酪蛋白影响结果见图3所示。
从图3可以看出,中性蛋白酶酶解时间在4h内,水解度随着酶解时间的增加而增加,在4h时水解度达到最大值并且基本保持不变。当酶解时间达到4h时,酶解物的还原能力和DPPH自由基清除率达到最大值,分别为0.410和45.90%。因此,当作用时间为4h时,反应具有最大的水解度,并且其酶解物具有最好的还原能力和DPPH自由基清除率,选择4h作为中性蛋白酶的最适反应时间。
2.2.4 E∶S浓度比对水牛奶酪蛋白酶解制备抗氧化肽的影响 酶浓度对中性蛋白酶水解水牛奶酪蛋白影响结果见图4。
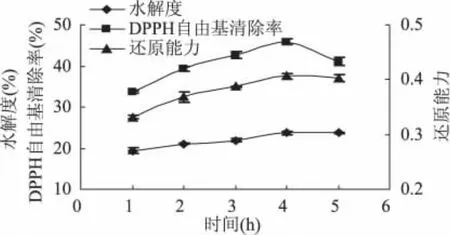
图3 酶解时间对样品的水解度、DPPH自由基清除率和还原能力的影响Fig.3 Effect of the hydrolysis time on degree of hydrolysis,DPPH radical-scavenging capacity and reducing power of hydrolysis
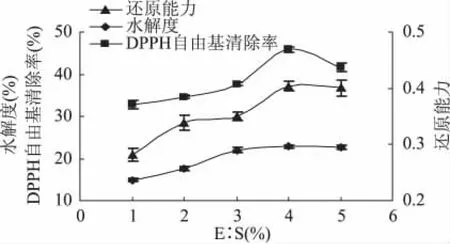
图4 酶与底物浓度比对样品的水解度、DPPH自由基清除率和还原能力的影响Fig.4 Effect of E∶S ratio on degree of hydrolysis,DPPH radical-scavenging capacity and reducing power of hydrolysis
从图4可以看出,中性蛋白酶的E∶S浓度增加,水解度不断的增加,当E∶S浓度比为4%、5%时酪蛋白的水解度达到最大值。这说明在底物浓度不变的情况下,增加酶用量可以提高酶与底物的结合效率。当E∶S浓度比为4%时酶解物的还原能力和DPPH自由基清除率最大,但随着E∶S的继续增加,还原能力和DPPH自由基清除率减小。因此选择E∶S浓度比为4%。
2.3 水牛奶酪蛋白酶解工艺的优化
2.3.1 Box-Behnken设计方案及响应值 根据单因素分析所得结果,按照Box-Behnken设计方案对酶解工艺进行优化。前期的研究结果表明,水解度、还原能力、DPPH自由基清除率之间存在线性关系。所以,选择还原能力作为响应面指标的响应值,固定反应时间为4h,对酶解反应的pH、温度、E∶S进行三因素三水平响应面实验,具体设计及实验结果见表3。
2.3.2 多元二次响应面回归模型分析 采用Design-Expert 7.0软件对表3实验结果进行二次回归响应面分析,建立多元二次响应面回归模型,结果见表4。
由Box-Behnken实验拟合出的回归方程为:Y= 0.42+0.027A+0.027B+0.055C-4.500E+003AB-0.024AC-0.025BC-0.024A2-0.032B2-0.033C2。
从表4可以看出,回归方程的模型p值是极显著的(p<0.0010),且模型的拟合度(R2=0.9801)较高,说明预测值与真实值之间具有较高的相关性。从表4中回归模型的决定系数 A(pH)、B(温度)、 C(E∶S)、BC(温度与E∶S的交互作用),AC(pH与E∶S的交互作用),它们的Prob>F值分别为0.0029、0.0027、0.0001、0.0168、0.0181,对酶解物的还原能力影响显著,说明该模型的拟合度良好。影响酪蛋白酶解物还原能力的各因素按影响大小排序依次为C(E∶S)>B(温度)>A(pH),三个因素的影响均达到极著显著水平。
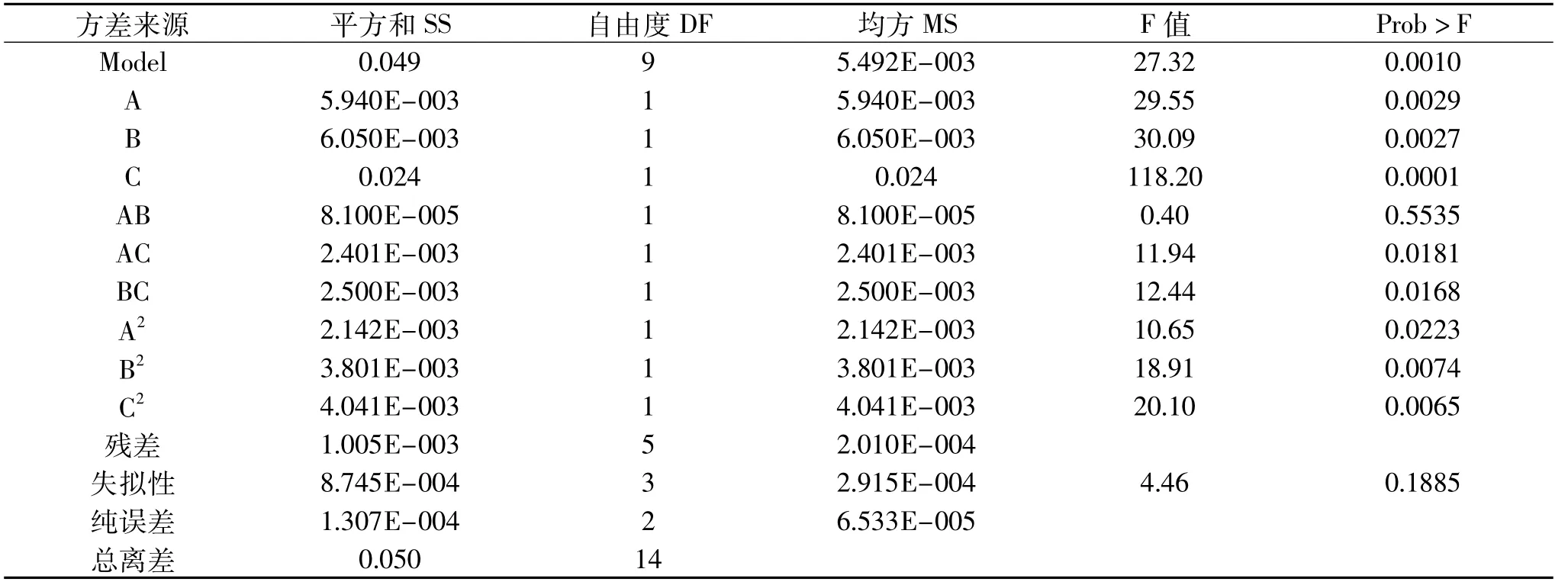
表4 二次响应面回归模型方差分析Table 4 Analysis of variance for the fitted regression model
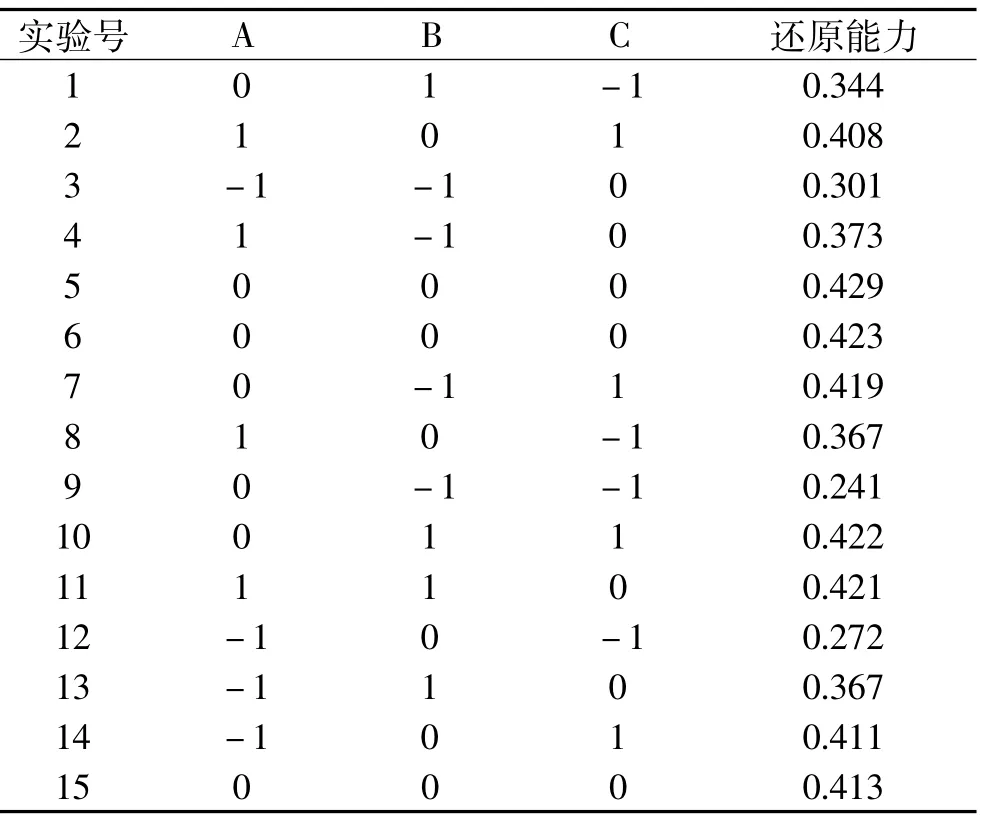
表3 Box-Behnken设计方案响应值结果Table 3 Experimental design and results for response surface analysis
从响应曲面图可以直观地看出各参数之间的相互作用和最大响应值,它是回归方程的图形描述,三因素对还原能力的交互作用见图5~图7。从图5中可知在E∶S一定时,随着pH和温度的增加,水牛奶酪蛋白酶解物的还原能力先增加后逐渐减少。由此可见适当的增加pH和温度可以提高酶解物的抗氧化活性。从图6中可知,随着E∶S的增加,酶解物的还原能力先快速增加后缓慢降低,而随着pH的增大,酶解物还原能力先增大后减小。从图7中可知,随着E∶S的增加酶解物的还原能力先升高而后趋于平缓,而随着温度的升高酶解物的还原能力先增大后减小,从图中还可以直观看出,E∶S和温度的交互作用在图形中反映出适宜的条件使酶解物的还原能力达到最大值,过高或过低都会使酶解物还原能力降低。从响应面分析图可以看出,BC(温度与E∶S),AC(pH与E∶S)的交互作用显著,而AB(pH与温度)交互作用不显著,表现为图6、图7的曲线较陡。
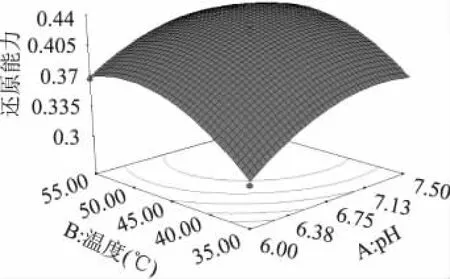
图5 pH和温度的交互作用响应曲面图Fig.5 Response surface plot for the pairwise of pH and temperature
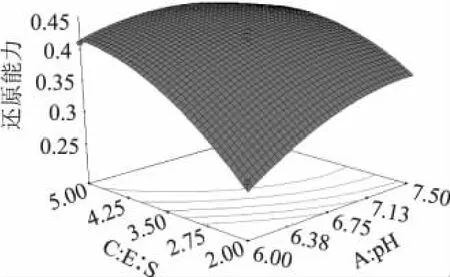
图6 pH和E∶S交互作用响应曲面图Fig.6 Response surface plot for the pairwise effect of pH and E∶S
根据Design-Expert7.0软件分析得到还原能力最强时的最佳工艺为在 pH为6.90,反应温度为46.44℃,E∶S为4.54%的工艺条件下,酪蛋白酶解物还原能力最大值的预测值为0.445。为了检验响应面分析法的可靠性,将优化后的酶解工艺参数适当修正后进行水解验证实验。将酪蛋白酶解工艺的最佳条件修正为pH为6.90,温度为46℃,酶与底物浓度比为4.6%,并以此条件做三次平行实验,验证实验有效性。实际测得的酪蛋白酶解物的还原能力为0.457±0.017,与理论预测值0.445相差不大。因此,采用RSA法优化得到的酶解工艺条件准确可靠,具有实用价值。
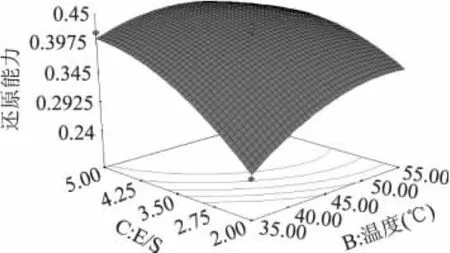
图7 温度与E∶S交互作用响应曲面图Fig.7 Response surface plot for the pairwise effect of temperature and E∶S
Liu[12]、Suetsuna[13]和吴丹[14]等分别利用胰蛋白酶、胃蛋白酶和木瓜蛋白酶对荷斯坦牛奶中酪蛋白进行酶解制备抗氧化活性肽,研究结果表明这些小分子肽都具有较强的抗氧化活性。本实验首次利用水牛奶作为原料分离得到水牛奶酪蛋白,然后选用五种蛋白酶对得到的酪蛋白进行酶解制备抗氧化活性肽。实验结果表明通过不同的蛋白酶酶解水牛奶酪蛋白得到的多肽都具有抗氧化活性,但是抗氧化活性的强弱是不同的。从酶的筛选实验结果得出中性蛋白酶是制备水牛奶酪蛋白抗氧化活性肽最适合蛋白酶,其酶解物具有最强的抗氧化活性,这与前人研究结果不同。根据研究表明[15],水牛酪蛋白αs1、β和κ均没有多态性,这一点与普通牛不同,就κ酪蛋白氨基酸组成而言,N-乙酰基半乳糖胺和唾液酸的比例在两个物种中也存在差异,前者在水牛和普通牛中分别为每摩尔蛋白0~4.3和0~6.7mol,后者在水牛和普通牛中为每摩尔蛋白5.5~8.5和3.5~4.3mol,或许是这两种蛋白存在差异导致了酶解物也有所差异;另一个可能原因是本研究使用的蛋白酶来源于solarbio厂家,而 Suetsuna[13]等研究采用的是 Merck厂家,二者之间的酶解特性可能存在一定的差异。具体情况尚需进一步地研究。
3 结论
利用蛋白含量丰富水牛奶作为原料,通过等电点沉淀法分离得到酪蛋白,利用酶解方法制备抗氧化活性多肽。发现选用来源于动植物的五种蛋白酶对水牛奶酪蛋白进行酶解,五种蛋白酶酶解物均具有抗氧化活性,其中,中性蛋白酶酶解水牛奶酪蛋白得到的酶解物的抗氧化活性明显高于其他蛋白酶酶解物。通过单因素和响应面分析结果获得中性蛋白酶酶解水牛奶酪蛋白制备抗氧化活性多肽酶解的最佳工艺参数为:pH为6.90,温度为46℃,酶与底物浓度比为4.6%,酶解时间4h,此时10mg/m L酶解物的还原能力为0.457。
[1]付建平,靳烨.乳蛋白生物活性肽的来源及其生理重要性[J].农产品加工学报,2005,10(9):91-93.
[2]周俊清.酪蛋白肽及其苦味肽功能特性的研究[D].北京:中国农业科学院,2008:6-9.
[3]任娇艳,赵谋明,崔春,等.草鱼源抗氧化肽的响应面法优化制备及活性评价[J].食品工业科技,2009,30(7):69-73.
[4]Simo Laakso,Esa Matti Lilius.Milk casein:inhibitor of lipoxygenase-catalyzed lipid peroxidation[J].J Agric Food Chem,1982,30:913.
[5]Rival S G,Boeriu C G,Wichers H J.Caseins and casein hydrolysate.1.Lipoxygenase inhibitory properties[J].JAgric Food Chem,2001,49(1):287-294.
[6] Diaz M,Decker EA.Antioxidant Mechanisms of caseinophosphopeptides and casein hydrolysates and their application in ground beef[J].JAgric Food Chem,2004,52:8208-8213.
[7]M Miguel,A Aleixandre,M M.Contreras,etal.ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J].Food Chemistry,2009,112:211-214.
[8]高婷,沈浥,卢蓉蓉.酪蛋白抗氧化肽制备工艺及酶解物特性研究[J].食品工业科技,2010,31(6):192-195,198.
[9]Liu Li-jun,Zhu Chuan-he,Zhao Zheng.Analyzingmolecular weight distribution of wheyprotein hydrolysates[J].Food and Bioproducts,2008,86:1-6.
[10]Rong-Rong Lu,Zhen Sun,Ping Qian,et al.Hempseed protein derived antioxidative peptides:Purification,identification and protection from hydrogen peroxide-induced apoptosis in PC12 cells[J].Food Chemistry,2010,123:1210-1218.
[11]K H Sabeena Farvin,Caroline P Baron,Nina Skall Nielsen,et al.Antioxidant activity of yoghurt peptides:Part 1-in vitro assays and evaluationin x-3 enriched milk[J].Food Chemistry,2010,123:1080-1089.
[12]Yan Liu,Rong Guo.Aggregation properties of aqueous casein hydrolysate solutions at different pH[J].International Dairy Journal,2008,123:1022-1027.
[13]Suetsuna K,Ukeda H,Ochi H.Isolation and characterization of free radical scavenging activities peptides derived from casein[J].Journal of Nutritional Biochemistry,2000(11):128-131.
[14]吴丹,赵新淮.高活性酪蛋白抗氧化肽的制备方法研究[J].食品科学,2009,30(21):283-287.
[15]王艳阳.水牛奶的特性、产量及莫兹瑞拉奶酪[J].世界农业,2004,344(12):56-59.
Study on preparation of antioxidant peptides derived from buffalo casein by enzyme hydrolysis technology
BIQiu-hua1,GONG Xia2,BAIWen-juan1,CHENWen-shuo1,LIQuan-yang1,*
(1.College of Light Industry and Food Engineering,Guangxi University,Nanning 530004,China; 2.Department of Tourism and Food Science,Shanghai Business School,Shanghai200235,China)
Alcalase,neutrase,papain,trypsin and pepsinto hyd rolyze buffalo m ilk casein were com pared to p repare antioxidant pep tide on the basis of hyd rolysis degree,DPPH rad ical-scavenging capacity and reducing power as detec tion ind icators,and the neutrase was selected to be the most suitab le one.The technology for p reparing p rotein hyd rolysates from casein was op tim ized w ith one-fac tor-at-at-a-tim e experiments and response surface methodology(RSM).The op tim um technological parameter for p reparing antioxidant pep tide w ith neutrase was obtained as:pH 6.9 at46℃,enzyme/substrate ratio 4.6%and the hyd rolysis time 4.0h,and the reducing ab ility of 10mg/m L hyd rolysates was 0.457.The experimental resultwas good ag reementw ith the p redicted value.
buffalo m ilk;casein hyd rolysates;antioxidant pep tide;response surface methodology
TS252.1
B
1002-0306(2012)12-0309-05
2011-09-27 *通讯联系人
闭秋华(1983-),女,硕士研究生,研究方向:乳制品科学与技术。
广西科学研究与技术开发计划项目(桂科攻11107005-1D);国家自然科学基金资助项目(1071576);上海市教育委员会科研创新项目(09YZ470)。

