马克斯克鲁维酵母乳糖酶水解和转移性质比较
李海方,张 涛,江 波,缪 铭,沐万孟,吴保承,杨春霞,侯传林
(江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
马克斯克鲁维酵母乳糖酶水解和转移性质比较
李海方,张 涛,江 波*,缪 铭,沐万孟,吴保承,杨春霞,侯传林
(江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
主要对马克斯克鲁维酵母(Kluyveromycesmarxianus)产β-D-半乳糖苷酶的水解性质和转移酶学性质进行了比较。对比发现温度、pH、金属离子以及葡萄糖和半乳糖浓度对该酶的两种性质有不同影响,同时还研究了酶的动力学特性,以ONPG为底物,测得马克斯克鲁维酵母β-D-半乳糖苷酶的Km为0.51mmol/L,Vmax为0.532μmol/(mg protein·min)。以乳糖为底物,Km为0.56mmol/L,Vmax为0.31μmol/(mg protein·min)。这对研究生产低聚半乳糖有重要作用。
马克斯克鲁维酵母,β-D-半乳糖苷酶,水解性质,转移性质
低聚半乳糖(GOS)是由2~10个半乳糖基和葡萄糖基通过糖苷键连接而成的功能性低聚糖[1],作为母乳组成成分之一,它能够选择性促进人体肠道内益生菌的增殖[2],有抑制腐败菌生长[3]、减少有害代谢产物形成、防止便秘等功效,同时它还具有低甜度、低能量[4]、抗龋齿、对热和酸稳定等特性[5]。β-D-半乳糖苷酶属于水解酶(EC3.2.1.23),能够催化乳糖水解生成葡萄糖和半乳糖,该酶还可以催化半乳糖基转移反应,生成低聚半乳糖[6]。目前生产低聚半乳糖的方法,主要是通过微生物发酵产β-D-半乳糖苷酶,以乳糖为底物利用酶的转移活性来合成产物[7-8]。不同微生物产的酶在水解和转移方面有不同的性质[9-12],本实验研究了马克斯克鲁维酵母β-D-半乳糖苷酶的水解和转移活性,并进行了比较,从而为下一步合成低聚半乳糖反应提供可靠的依据。
1 材料与方法
1.1 材料与仪器
酵母膏、蛋白胨、葡萄糖、乳糖、半乳糖、邻硝基苯-β-D-吡喃半乳糖苷(ONPG)、磷酸氢二钠、磷酸二氢钠、氯化钠、EDTA 国药集团化学试剂有限公司。
Agilent1200高效液相色谱仪 配有Shodex RI-101示差折光检测器和 M740数据处理器,美国Agilent公司;高压细胞破碎仪 英国Constant System公司;恒温水浴锅 华利达实验设备公司;722E型分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 酵母培养及酶的提取 种子培养基:酵母膏10g/L,蛋白胨20g/L,葡萄糖40g/L,pH6.5。发酵培养基:酵母膏10g/L,蛋白胨20g/L,乳糖20 g/L,pH6.5。
将马克斯克鲁维酵母接入种子培养基在30℃,200 r/m in条件下培养15h后接入发酵培养基,接种量为1%,同样条件下培养15h发酵产酶。发酵结束后6000r/min离心得到菌体,将菌体用pH7.0 0.1mol/L的磷酸氢二钠/磷酸二氢钠缓冲液重悬后用高压细胞破碎仪在4℃30KPSI条件下破碎菌体;8000 r/m in下离心20m in取上清液即得到粗酶液。向粗酶液中加入30%硫酸铵静置4h后,8000r/min离心除去杂蛋白,再向体系中继续添加硫酸铵至浓度为80%,4℃静置10h后离心得到酶蛋白沉淀。沉淀用少量缓冲液溶解后透析48h除掉其中的铵离子。透析好的酶液通过DEAE-Sepharose fast flow离子交换柱除掉一部分杂蛋白,再通过Superdex 75 Prep Grade凝胶柱分离得到酶蛋白。收集的酶蛋白在SDS-PAGE上显示为单一条带,即得到的是纯的β-D-半乳糖苷酶。将收集的纯酶液浓缩,用于研究酶学性质。
1.2.2 β-D-半乳糖苷酶水解活力测定方法 配制1mg/m L的ONPG溶液,取2m L溶液于35℃保温10m in后加入酶液0.5m L,在35℃下准确反应15m in,加入2.5m L浓度为0.15mol/L Na2CO3溶液终止反应,溶液静置2m in后,于420nm处测定吸光值,根据标准曲线算出酶活。1m L酶液1m in催化ONPG生成1μmol邻硝基酚(ONP)为一个单位酶活。
1.2.3 β-D-半乳糖苷酶转移酶活测定方法 用pH7.0的0.1mol/L的磷酸氢二钠/磷酸二氢钠缓冲溶液配制0.5mol/L的底物乳糖溶液,取400μL底物溶液加入100μL酶液在40℃条件下准确反应4h后于沸水中煮沸5min终止反应。每分钟产生1μmol低聚半乳三糖为一个酶活力单位。
1.2.4 低聚半乳三糖检测方法 高效液相色谱法(HPLC):Agilent1200系列,配有Shodex RI-101示差折光检测器和 M740数据处理器;色谱柱,Shodex Asahipak NH2P-50;流动相,乙睛∶水=68∶32,流速1m L/m in;柱温30℃;进样量10μL。
1.2.5 酶学性质测定方法
1.2.5.1 温度对酶水解和转移酶活及稳定性的影响
将酶在不同温度下与ONPG和乳糖反应,测定酶活力,以最高的酶活力为100%,其他条件下的酶活与其比较换算成相对酶活力。考察不同温度对酶水解酶活和转移酶活的影响。
将酶在不同温度(30~50℃)下保温10、20、30、60、120m in,测定酶活力,通过相对酶活的比较,考察温度对酶稳定性的影响。
1.2.5.2 pH对酶水解和转移酶活及稳定性的影响
将酶在不同pH下与ONPG和乳糖反应,测定酶活力,以最高的酶活力为100%,其他条件下的酶活与其比较换算成相对酶活力。考察不同pH对酶水解活力和转移酶活的影响。
将酶置于不同pH得磷酸缓冲液中,35℃保温30m in,测定酶活力,以最高的酶活力为100%,其他条件下的酶活与其比较换算成相对酶活力。考察不同pH对酶水解酶活和转移酶活的影响。
1.2.5.3 金属离子对β-D-半乳糖苷酶水解和转移酶活的影响 酶液先经含有10mmol/L EDTA的Tris-HCl缓冲液于4℃透析12h以去除溶液中带有的金属离子;然后再经不含EDTA的Tris-HCl缓冲液于4℃透析48h以去除残留EDTA;最后在处理过的酶液中分别加入不同的二价金属离子及化合物(K+、Na+、Ca2+、Cu2+、Mn2+、Ni2+、Zn2+、Co2+、Mg2+、Fe2+、EDTA)使得其终浓度为10mmol/L。分别测定水解酶活和转移酶活,以未加金属离子或化合物的酶液活力为100%。
1.2.5.4 葡萄糖和半乳糖对酶水解和转移酶活的影响 向底物中分别加入浓度为 0.05、0.1、0.2和0.4mol/L的葡萄糖和半乳糖,以不添加测得的酶活力为100%,其他条件下的酶活力与其比较换算成相对酶活。考察葡萄糖和半乳糖对酶水解酶活和转移酶活的影响。
1.2.5.5 乳糖酶动力学参数测定 以ONPG为底物,分别配制1~8.33mmol/L不同浓度的溶液,在35℃测定酶活,按双倒数作图法(Lineweaver-Burk法)求米氏常数Km和最大反应速度Vmax。
2 结果与分析
2.1 温度对乳糖酶水解和转移酶活及稳定性的影响
由图1可知,马克斯克鲁维酵母β-D-半乳糖苷酶水解活力在35℃时最大,而转移酶活力在40℃时最大,当温度>45℃时,酶的转移活力迅速降低。生产低聚半乳糖的酶反应过程主要依靠酶的转移性质,酶的转移活力高时,低聚半乳糖转化率会明显提高,而水解酶活高时会增加反应副产物葡萄糖和半乳糖的产量,低聚半乳糖转化率会降低。因此在生产低聚半乳糖的酶反应过程中,应该以转移酶活的最适条件为首要考虑因素。
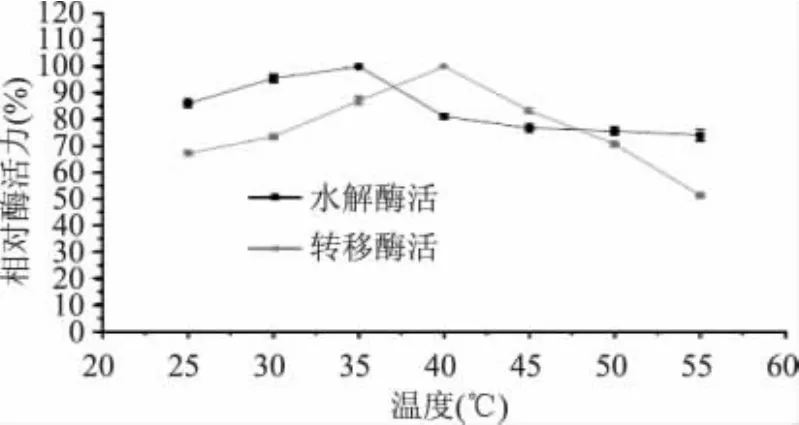
图1 温度对酶水解和转移酶活的影响Fig.1 Effect of temperature on hydrolysis and transgalactose activity ofβ-D-galactosidase
由图2可知,马克斯克鲁维酵母β-D-半乳糖苷酶在35~40℃之间保温1h,水解酶活力和转移酶活力能保持80%以上,随着温度升高时间延长,酶活力会持续降低。温度达到50℃时,酶水解活力损失较快,保温3h后残余水解酶活为37%,残余转移酶活为20%。
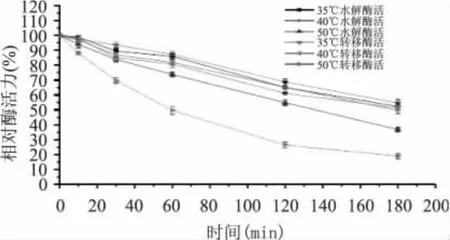
图2 温度对酶水解和转移酶活力稳定性的影响Fig.2 Curve of thermal stability on the enzyme
2.2 pH对酶水解和转移活性及稳定性的影响
由图3可以看出,马克斯克鲁维酵母β-D-半乳糖苷酶在pH7.0的条件下酶水解和转移酶活最高,转移酶活对pH敏感性比水解酶活弱一些,在6.5~7.0的范围内能保持较高活性。低聚半乳糖pH呈酸性,在合成反应中,pH会不断下降,因此pH要控制在保持酶活力的范围内。
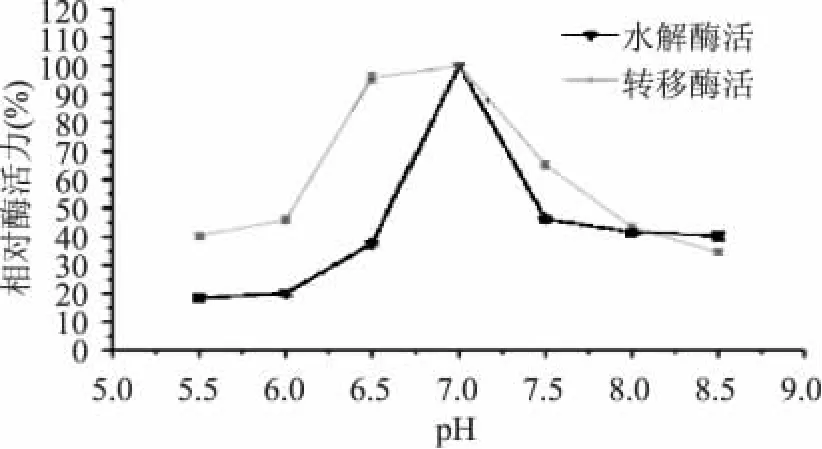
图3 pH对酶水解和转移酶活的影响Fig.3 Effect of pH on hydrolysis and transgalactose activity ofβ-D-galactosidase
由图4可以看出,马克斯克鲁维酵母β-D-半乳糖苷酶转移酶活在pH6.0~7.0之间稳定性比水解酶活高,而当pH>7.0时转移酶活迅速降低,而水解酶活降低较缓慢。在合成低聚半乳糖的反应中,要保持较高的转移活性,因此酶在处理过程中pH要控制在6.5~7.0之间,防止酶转移活性降低。
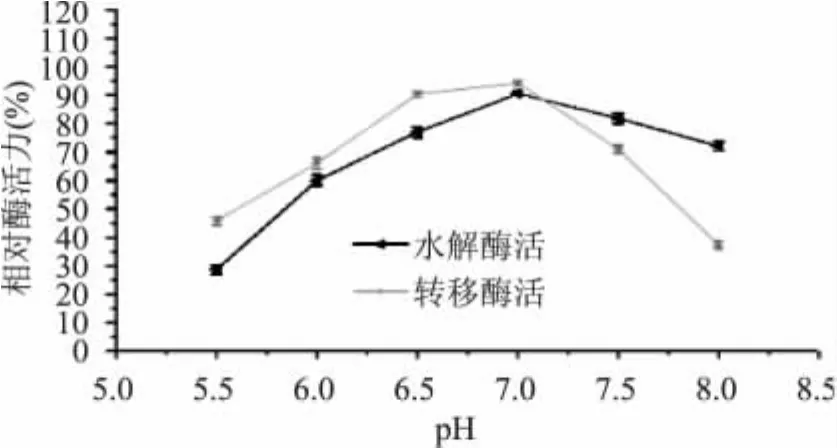
图4 pH对酶水解和转移酶活力稳定性的影响Fig.4 Effect of pH on hydrolysis and transgalactose activity ofβ-D-galactosidase’s stability
2.3 金属离子对β-D-半乳糖苷酶水解和转移活性的影响
由图5可知 Ni2+、Cu2+、Ca2+、Fe2+、Zn2+、EDTA在酶反应体系中使马克斯克鲁维酵母β-D-半乳糖苷酶的转移活性完全失去;Mn2+、K+使得酶转移活力降低了50%以上,Co2+使酶转移活力降低了20%,Na+使酶转移活力降低了10%。Mg2+对酶转移活力有激活作用,相对酶活为125%。EDTA、Cu2+能够使酶活力完全丧失;Na+、Ni2+、Ca2+、Fe2+、Zn2+、Mn2+、Co2+使水解酶活降低了50%以上,K+对酶水解活力没有影响,Mg2+对酶水解活力有激活作用。在合成低聚半乳糖的反应中,需要酶有较高的转移活力,Ni2+、Cu2+、Ca2+、Fe2+、Zn2+、EDTA会是反应的强烈抑制剂,而向体系中加入适当浓度的Mg2+可以减少酶用量。实验结果表明Na+能够抑制酶的水解活力,而对转移酶活影响较小,在合成低聚半乳糖的反应中,可以利用这一性质进行研究,减少水解反应副产物含量提高低聚半乳糖转化率。
2.4 葡萄糖和半乳糖对酶水解和转移活性的影响
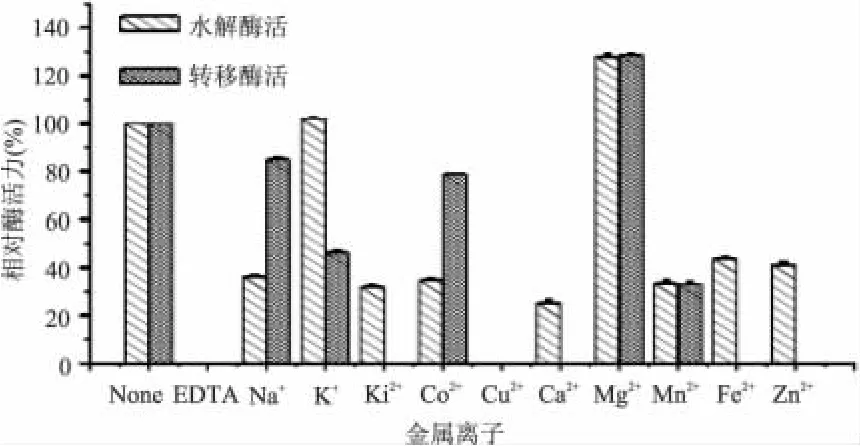
图5 金属离子对酶活性的影响Fig.5 Effect ofmetal ions on enzyme activity
由图6可以看出,当添加葡萄糖量大于0.1mol/L时可以促进乳糖酶的水解活性,而添加半乳糖则会抑制β-D-半乳糖苷酶水解活性,且浓度越大抑制力越强。这样可以看出在合成低聚半乳糖的反应中,反应产物半乳糖会抑制反应向水解方向进行。
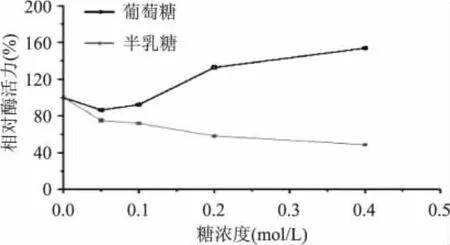
图6 葡萄糖和半乳糖对乳糖酶水解酶活的影响Fig.6 Effect of glucose and galactose on hydrolysis activity
由图7可以看出,添加葡萄糖会抑制乳糖酶的转移酶活,且添加量越大抑制力越强。添加半乳糖对转移酶活影响较小,添加量为0.05mol/L时乳糖酶转移酶活增加。反应前期,未添加半乳糖的反应,需要利用β-D-半乳糖苷酶的水解活性先将乳糖水解,得到半乳糖后再进行转移反应得到低聚半乳糖。而在反应体系中添加半乳糖,半乳糖作为反应的底物,可以通过酶的转移活力迅速反应合成低聚半乳糖。
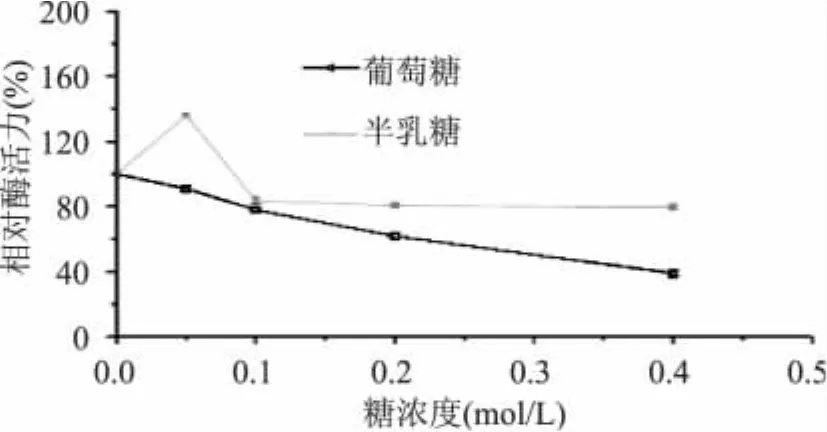
图7 葡萄糖和半乳糖对乳糖酶转移酶活的影响Fig.7 Effect of glucose and galactose on transgalactose activity
2.5 β-D-半乳糖苷酶的动力学参数
根据图8显示的线性回归方程,可以求得马克斯克鲁维酵母β-D-半乳糖苷酶在以ONPG为底物时,Vmax为 0.532μmol/(mg protein·m in)、Km为0.51mmol/L。
根据图9显示的线性回归方程,可以求得马克斯克鲁维酵母β-D-半乳糖苷酶在以乳糖为底物时,Vmax为 0.31μmol/(mg protein·m in)、Km为 0.56 mmol/L。
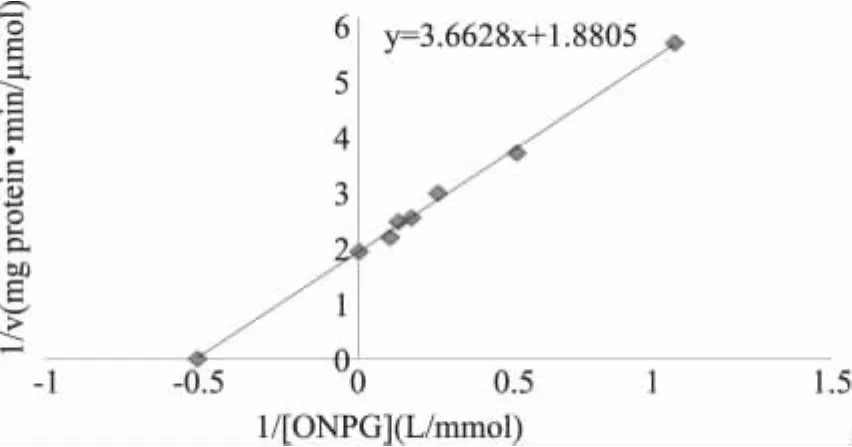
图8 以ONPG为底物乳糖酶的Lineweaver-Burk图Fig.8 Lineweaver-Burk plots of the enzyme using ONPG as substrate
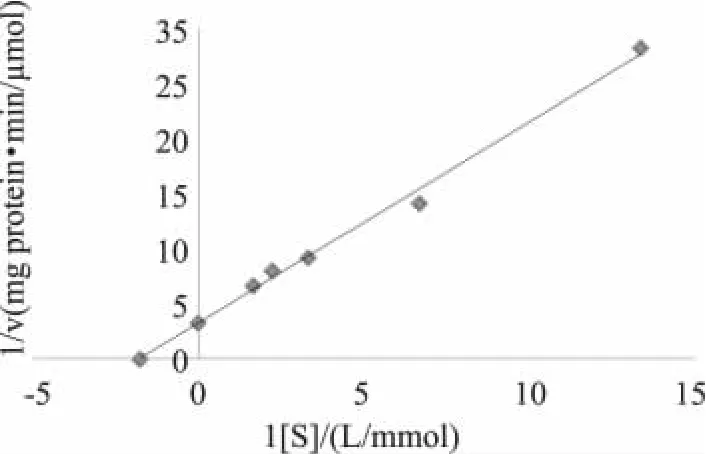
图9 以乳糖为底物乳糖酶的Lineweaver-Burk图Fig.9 Lineweaver-Burk plots of the enzyme using lactose as substrate
3 结论
3.1 马克斯克鲁维酵母β-D-半乳糖苷酶水解酶活最适温度为35℃,转移酶活最适温度为40℃,温度大于45℃时酶转移活力损失较快。该酶的水解和转移酶活力最适pH相同,均为7.0,但pH稳定性略有不同,水解酶活在pH6.5~8.0范围内较稳定,转移酶活在6.5~7.0范围内较稳定。
3.2 Mg2+对马克斯克鲁维酵母β-D-半乳糖苷酶水解酶活和转移酶活均有激活作用,Na+能够抑制酶的水解活力,而对酶转移活力影响较小。
3.3 葡萄糖对马克斯克鲁维酵母β-D-半乳糖苷酶的水解活力有促进作用,对酶转移活性有抑制作用。半乳糖抑制酶的水解作用,低浓度(0.05mol/L)的半乳糖能够促进酶的转移活性而浓度继续增加对酶转移活性几乎没有影响。
3.4 以ONPG为底物,测得马克斯克鲁维酵母β-D-半 乳 糖 苷 酶 的 Km为 0.51mmol/L,Vmax为0.532μmol/(mg protein·m in)。以乳糖为底物,Km为0.56mmol/L,Vmax为0.31μmol/(mg protein·min)。
[1]Van Loo J,Cummings J,Delzenne N,et al.Functional food properties of non-digestible oligosaccharides:A consensus report from the ENDO project(DGXIIAIRII-CT94-1095)[J].British Journal of Nutrition,1999,81(2),121-132.
[2]Roberfroid M.Prebiotics:The concept revisited[J].Journal of Nutrition,2007,137(3),830-837.
[3]Macfarlane G T,Steed H,Macfarlane S.Bacterialmetabolism and health-related effects of galacto-oligosaccharides and other prebiotics[J].Journal of Applied Microbiology,2008,104(2): 305-344.
[4]Valli C,Traill W B.Culture and food:A model of yoghurt consumption in the EU[J].Food Quality and Preference,2005,16 (4):291-304.
[5]Crittenden R G,Playne M J.Properties and applications of food-grade oligosaccharide trends[J].Food Science &Technology,1996(6):126-130.
[6]Nakakuki T.Oligosaccharide production,properties and applications[M].Gorden and Breach Science Publisher,1993.
[7]Tomomatsu H.Health effects of oligosaccharides[J].Food Technology,1994(13):205-260.
[8]Wallenfels K.Enzymatische synthese von oligosacchariden aus disacchariden[J].Naturwissenschaften,1951,38(13):306.
[9]Bruins M E,Strubel M,Van Lieshout J F T,et al. Oligosaccharide synthesis by the hyperthermostableβ-glucosidase from Pyrococcus furiosus:Kinetics and modeling[J].Enzyme and Microbial Technology,2003,33(1):3-11.
[10]Boon M A,Janssen A E M,Van der Padt A.Modelling and parameter estimation of the enzymatic synthesis of oligosaccharides byβ-galactosidase from Bacillus circulans[J]. Biotechnology and Bioengineering,1999,64(5):558-567.
[11]Iwasaki K I,Nakajima M,Nakao S I.Galactooligosaccharide production from lactose by an enzymic batch reaction usingβ-galactosidase[J].Process Biochemistry,1996,31 (1):69-76.
[12]Kim C S,Ji E S,Oh D K.A new kinetic model of recombinantβ-galactosidase from Kluyveromyces lactis for both hydrolysis and transgalactosylation reactions[J].Biochemical and Biophysical Research Communications,2004,316(3):738-743.
Com parison ofβ-D-galactosidase hydrolysis and transgalacosidation properties from Kluyverom yces marxianus
LIHai-fang,ZHANG Tao,JIANG Bo*,M IAO M ing,MU W an-meng,WU Bao-cheng,YANG Chun-xia,HOU Chuan-lin
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi214122,China)
This research comparedβ-D-galactosidase’s hyd rolytic and transg lucosidation p roperties fromKluyveromycesmarxianus.The com parison ind icated d ifferent tem perature,pH,metal ions g lucose and galactose concentration had d ifferent effec t onβ-D-galac tosidase’s hyd rolysis and transgalac tose ac tivity.This paper also studied the dynam ics of the enzyme.Taking ONPG as substrate,the Kmwas 0.51mmol/L,and the Vmaxwas 0.532μmol/(mg p rotein·m in).Taking lac tose as substrate,the Kmwas 0.56mmol/L,and the Vmaxwas 0.31μmol/ (mg p rotein·m in).All these studies can p lay an im portant role in p roducing GOS.
Kluyveromycesmarxianus;β-D-galactosidase;hyd rolysis;transgalactosidation
TS201.2
A
1002-0306(2012)12-0243-04
2011-09-26 *通讯联系人
李海方(1986-),女,硕士,研究方向:应用酶技术。
科技型中小企业技术创新基金(10C26213201021)。

