浓缩石榴汁中熊果苷的超高效液相-串联质谱检测方法研究
何 强,孔祥虹,李建华,乐爱山,吴双民
(陕西出入境检验检疫局检验检疫技术中心,陕西西安710068)
浓缩石榴汁中熊果苷的超高效液相-串联质谱检测方法研究
何 强,孔祥虹,李建华,乐爱山,吴双民
(陕西出入境检验检疫局检验检疫技术中心,陕西西安710068)
建立了浓缩石榴汁样品中熊果苷含量测定的固相萃取-超高效液相-串联质谱测定方法。样品用水稀释,HLB和氨基固相萃取柱净化,采用BEH Amide色谱柱(100mm×2.1mm,1.7μm)分离,以乙腈和水梯度洗脱,多反应监测模式测定,定量离子对为m/z 271.2>108.0,定性离子对为m/z 271.2>160.9,外标法定量。熊果苷的检测限为0.006mg/kg,在0.004~0.2mg/L浓度范围内,熊果苷的线性相关系数为0.9994,熊果苷的加标回收率均在80.6%~108.1%范围内,相对标准偏差均低于8.3%。该方法样品净化效果良好,检测简便、快速、准确,能够满足浓缩石榴汁中熊果苷含量测定和定性确证的要求。
浓缩石榴汁,熊果苷,固相萃取,超高效液相-串联质谱
果汁掺假是果汁生产行业的一种不法行为,利用价格较低的水果或果汁掺入到价格高的水果原料果或果汁中是一种已被曝光的违法行为,在鉴伪技术方面已有较多的研究[1],但对浓缩石榴汁的掺伪鉴别研究较少,由于石榴汁的价格远高于梨汁,如何鉴别石榴汁中掺入梨汁对于辨别石榴汁的纯正性,维护消费者的合法权益具有重要意义。熊果苷是梨果实中的一种特征成分[2],而石榴中尚未见有关于熊果苷的文献报道,本实验室的前期研究中也未从石榴中检出熊果苷成分,所以利用检测熊果苷这一特征成分来鉴别石榴汁中是否掺入梨汁是一种可行的方法。目前浓缩石榴汁中熊果苷的检测方法研究较少,相关方法主要是化妆品和中草药中熊果苷的检测,主流方法是高效液相色谱法[3-7]及液相色谱质谱法[8-10],另外薄层色谱法[11]、毛细管电泳法[12]、气相色谱-质谱法[13]、电化学法[14-15]等也有相关报道,文献报道的高效液相色谱法及液相色谱-质谱法均采用反向色谱柱分离熊果苷,而由于熊果苷极性较大,流动相需要高比例的水相,抑制熊果苷质谱检测时的电离,而且分离效果不佳。本研究利用HLB柱和氨基柱组合固相萃取的方法提高样品净化效果,选择新型BEH Amide色谱柱进行样品分离以提高分离效果及灵敏度,选择超高效液相-串联质谱法检测以实现定量分析与定性确证同时进行。
1 材料与方法
1.1 材料与仪器
浓缩石榴汁 均为送检样品;熊果苷标准品美国Sigma公司;乙腈、甲醇(HPLC级) 德国MERCK公司;无水硫酸钠 分析纯,天津市津北精细化工有限公司(使用前于650℃灼烧4h);水为超纯水 美国Millipore公司,Milli-Q超纯水净化系统制备。
Oasis HLB固相萃取柱(200mg,6cc)、Sep-Pak Vac NH2固相萃取柱(200mg,6cc) 美国Waters公司;AcquityTM超高效液相色谱仪 配Quattro Premier XE串联质谱仪、电喷雾电离(ESI)接口,美国Waters公司。
1.2 实验方法
1.2.1 标准溶液的制备 将熊果苷标准品用甲醇溶解配制成1.0mg/mL的标准储备液,置于4℃冰箱保存,标准使用溶液用乙腈逐级稀释。
1.2.2 供试品溶液的制备 称取5g(精确至0.01g)试样置于50mL离心管中,加入约20mL水,振摇混匀,定容至25.0mL。将HLB固相萃取柱依次用5mL甲醇、10mL水活化,准确移取5mL试样溶液上样,控制流速2~3mL/min,待样品溶液流完后,减压抽干20min,在NH2固相萃取柱上端装填约2cm高的无水硫酸钠,并用5mL乙腈活化后串接在抽干的HLB柱下方,用12mL乙腈淋洗,控制流速约2mL/min,弃去流出液,去掉HLB固相萃取柱,将NH2柱再用15mL乙腈-甲醇(1∶1,v/v)洗脱,洗脱液于40℃水浴中减压浓缩至干,用5.00mL乙腈溶解定容,过0.2μm有机微孔滤膜,供液相色谱-串联质谱测定和确证。
1.2.3 测定条件 ACQUITY UPLC BEH Amide色谱柱(100mm×2.1mm,1.7μm);柱温35℃;流动相采用乙腈-水梯度洗脱,首先在1.0min时间内,乙腈保持95%,然后在1.0~5.0min乙腈由95%线性递减至50%,水则由5%线性递增至50%,最后在0.2min内恢复到流动相的初始比例,保持2min;流速0.2mL/min;进样量2μL。
离子源:电喷雾离子源;扫描方式:负离子扫描;检测方式:多反应监测(MRM),定量离子对为m/z 271.2>108.0,定性离子对为m/z 271.2>160.9;毛细管电压3kV;萃取电压3V;锥孔电压30V;定量离子和定性离子的碰撞能量分别为25、10eV;离子源温度110℃;脱溶剂温度400℃;脱溶剂气流量:500L/h;锥孔气流量50L/h;碰撞室氩气流量0.2mL/min(真空度约3×10-5MPa);四级杆分辨率为15.0。
1.2.4 方法适用性实验 对线性关系、检出限、仪器精密度、方法重现性、加标回收率等进行了实验考察。
1.2.4.1 线性关系 配制浓度为0.004、0.01、0.02、0.05、0.1、0.2mg/L熊果苷系列标准溶液,按1.2.3规定的色谱-质谱条件进样检测,并以标准浓度(X, mg/L)为横坐标,定量离子离子流图的峰面积(Y)为纵坐标作图,同时用最小二乘法进行线性回归,考察方法的线性关系。
1.2.4.2 检出限 取含有熊果苷的浓缩石榴汁样品溶液稀释进样,采用标准曲线法定量,按3倍信噪比计算检出限,按10倍信噪比计算最低定量限。
1.2.4.3 仪器精密度、方法重现性 取浓度为0.02mg/L的熊果苷标准溶液,连续进样6次,记录定量离子对离子流图的峰面积,计算峰面积相对标准偏差,考察仪器的精密度。取含有熊果苷的浓缩石榴汁样品按照1.2.2的方法平行处理6份,进样检测,计算测定结果相对标准偏差,考察方法的重现性。
1.2.4.4 加标回收率实验 取不含熊果苷的浓缩石榴汁样品进行,每个样品添加0.1、0.2、0.4mg/kg三个水平的熊果苷,每个添加水平重复10次,计算回收率及回收率相对标准偏差。
2 结果与讨论
2.1 净化条件的考察
由于熊果苷的极性较大,而且不具有离子化的特性,复杂样品中微量熊果苷的提取净化一直是个难题,相关研究也较少。本实验将浓缩石榴汁用水稀释后过固相萃取柱,熊果苷在C18、NH2、PSA、MCX、MAX等固相萃取柱上基本都没有保留,在活性炭固相萃取柱上也仅有较少的保留,而HLB柱(200mg,6cc)对熊果苷有较好的吸附作用,但对浓缩石榴汁中的主成分糖类物质基本没有吸附,所以选择HLB柱可以有效去除糖类等物质。实验中发现不同规格的HLB柱对果汁中熊果苷的吸附作用差别较大,60mg、3cc的HLB柱对果汁中的熊果苷的回收率仅约30%左右,可能是由于60mg的HLB柱吸附量较小,容易超载而造成回收率差。
接着考察了HLB柱、HLB柱串联NH2柱、HLB柱串联PSA柱等几种情况,仅用HLB柱净化不完全,在质谱检测时容易产生基质效应,HLB柱串联PSA柱对一些低极性杂质的去除效果不理想,而HLB柱串联NH2柱可以通过改变淋洗及洗脱条件,有效去掉果汁中的干扰杂质,所以最终选择HLB柱串联NH2柱进行样品净化。
利用净化后的空白浓缩石榴汁样品溶液配制熊果苷的基质标准溶液,并与相同浓度的熊果苷标准溶液相比较,分别重复进样3次、6次测定质谱响应值的相对标准偏差为4.8%,可判断经样品净化及色谱分离后,浓缩石榴汁样品对熊果苷基本不存在质谱基质效应。
2.2 测定条件的优化
首先采用毛细管进样模式对熊果苷标准溶液的质谱检测条件进行了考察,由于熊果苷化学结构中含有多个羟基,适合采用负离子模式进行检测,首先比较了电喷雾负离子模式(ESI-)和大气压化学电离负离子模式(APCI-),发现熊果苷在ESI-模式下的响应值较高,所以选用ESI-模式进行测定,然后在毛细管连续进样模式下对熊果苷的质谱参数进行优化,以获取最高的灵敏度,最终确定了1.2.3中的质谱条件。
接着对色谱条件进行了考察,比较了BEH C18、HSS T3、BEH Amide、BEH HILIC等色谱柱。其中BEH C18、HSS T3属于反相色谱柱,熊果苷极性大,分离时需要高比例的水相,不利于熊果苷的质谱电离,而且色谱出峰早,分离不够理想;而BEH HILIC色谱柱对熊果苷基本没有吸附;BEH Amide色谱柱对熊果苷的保留效果良好,而且流动相采用高比例的有机相,便于质谱电离及提高响应值的稳定性,流动相中乙腈为90%时熊果苷的质谱响应值比流动相中水为90%时提高20倍以上。
流动相选择时,考察了乙腈-水、乙腈-甲醇系统,由于乙腈-水系统的色谱峰形及保留特性优于乙腈-甲醇系统,所以选择乙腈-水系统作为流动相,而采用1.2.3的梯度洗脱条件,可以提高色谱分离效果,有效地降低样品基质效应,熊果苷选择离子对离子流图如图1所示,熊果苷定性离子对与定量离子对的丰度比约为82%。
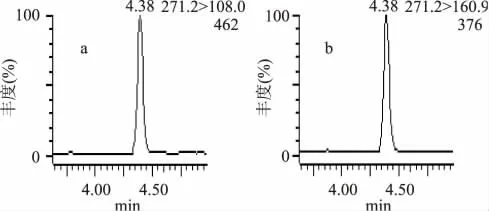
图1 标准溶液定量离子对(a)及定性离子对(b)的离子流图Fig.1 MRM chromatograms of quantitative ion pair(a) and qualitative ion pair(b)
2.3 线性关系与检出限
熊果苷的标准曲线回归方程为Y=401.382X+ 5.08717,线性相关系数r为0.9994,线性关系良好。
浓缩石榴汁中熊果苷的最低检出浓度为0.0012mg/L,最低定量浓度为0.004mg/L,根据样品前处理方法换算,本方法的最低检出限为0.006mg/kg,最低定量限为0.02mg/kg。
2.4 仪器精密度与方法重现性
浓度为0.02mg/L的熊果苷标准溶液6次测定峰面积的相对标准偏差为2.2%,仪器精密度良好。
平行处理的6份浓缩石榴汁样品中熊果苷的测得量分别为1.85、1.76、1.92、1.69、1.81、1.75mg/kg,测定结果的相对标准偏差为4.5%,重现性良好。
2.5 加标回收率实验
加标回收率及精密度数据如表1所示,回收率均在80.6%~108.1%范围内,相对标准偏差在6.9%~8.3%范围内,满足检测要求。
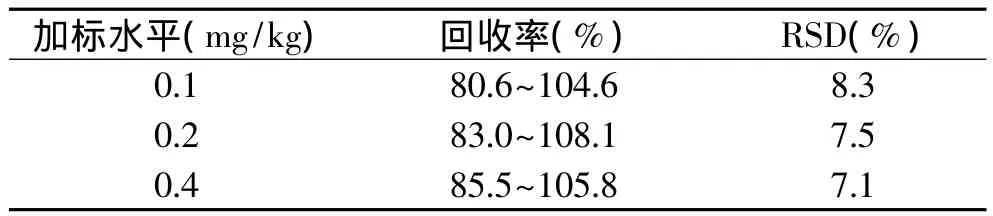
表1 回收率及精密度测定结果(n=10)Table 1 Results of recoveries and precisions(n=10)
2.6 样品测定
利用本方法检测了7批浓缩石榴汁样品,仅1批浓缩石榴汁中未检出熊果苷,其余样品中检出熊果苷含量在0.05~3.4mg/kg范围内,说明熊果苷在浓缩石榴汁中微量存在具有一定的普遍性,这些微量熊果苷可能来源于原料果中掺入的少量梨或果汁生产过程中的污染,由于本方法的灵敏度比已有方法提高10倍以上,也不能排除浓缩石榴汁中本身含有极微量的熊果苷,但在已有研究中未被检测出来,需要进一步的研究确认。
3 结论
本方法采用HLB固相萃取柱结合氨基固相萃取柱提取净化浓缩石榴汁中的熊果苷,并采用新型BEH Amide色谱柱分离熊果苷,取得了良好的效果。该方法样品净化过程采用两种不同净化机理的固相萃取柱相结合,净化效果好,能够有效地去除干扰组分,利用BEH Amide色谱柱的分离效果良好,而且可以保证熊果苷在高比例有机相条件下电离,与已有的检测方法[9]比较,在进样量减少2.5倍的情况下,仍可以提高熊果苷的检测灵敏度10倍以上。
[1]苏光明,胡小松,廖小军,等.果汁鉴伪技术研究新进展[J].食品与发酵工业,2009,35(6):151-156.
[2]TanrIöven D,Eksi A.Phenolic compounds in pear juice from different cultivars[J].Food Chemistry,2005,93(1):89-93.
[3]林彩,刘松青,贺红军,等.复方维生素E霜中熊果苷和维生素E的含量测定[J].中国药业,2010,19(9):29-30.
[4]程鹏,陈梅兰,朱岩.高效液相色谱法测定化妆品中α-、β-熊果苷及烟酰胺[J].色谱,2010,28(1):89-92.
[5]孙素珍.超高压液相色谱法测定鸡矢藤熊果苷含量[J].江苏农业科学,2010(3):387-388.
[6]Nisit K,Aueporn C,Umaporn P,et al.High-performance liquid chromatographic method for separation and quantitative analysis of arbutin in plant tissue cultures[J].Chiang Mai University Journal of Natural Sciences,2007,6(1):65-74.
[7]Thongchai W,Liawruangrath B,Liawruanggrath S.High performance liquid chromatographic determination of arbutin in skin-whitening creams and medicinal plant extracts[J].Journal of Cosmetic Science,2007,58(1):35-44.
[8]Carmen P,Laurian V,Mircea T.Determination of arbutin in the leaves of Bergenia crassifolia(L.)fritsch acclimated in Romania[J].Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2009,37(1):129-132.
[9]孔祥虹,何强,乐爱山,等.超高效液相色谱-串联质谱法测定浓缩苹果汁中的熊果苷[J].色谱,2010,28(6):632-634.[10]赵洁,何强,孔祥虹,等.固相萃取-超高效液相色谱-电喷雾串联质谱法检测梨树叶中熊果苷[J].分析实验室,2011,30(2):58-61.
[11]唐新雯,刘廷江.薄层色谱法测定毛大丁草中熊果苷含量[J].中国药业,2009,18(3):29.
[12]Lin Y H,Yang Y H,Wu S M.Experimental design and capillary electrophoresis for simultaneous analysis of arbutin,kojic acid and hydroquinone in cosmetics[J].Journal of Pharmaceutical and Biomedical Analysis,2007,44(1):279-282.
[13]ChisvertA,SisternesJ,Balaguerá,etal.A gas chromatography-mass spectrometric method to determine skinwhitening agents in cosmetic products[J].Talanta,2010,81 (1-2):530-536.
[14]刘心同,汪庆祥,高宏伟.伏安法测定化妆品中熊果苷[J].理化检验-化学分册,2008,44(3):209-211.
[15]Miki K,Hayashi T,Kinoshita H.Determination of arbutin using glucosidase-immobilized electrode[J].Nippon kagakkai koen yokoshu,2006,86(1):644-648.
Study on detection method of arbutin in pomegranate juice concentrates by ultra performance liquid chromatography-tandem mass spectrometry
HE Qiang,KONG Xiang-hong,LI Jian-hua,YUE Ai-shan,WU Shuang-min
(Technical Center,Shaanxi Entry-exit Inspection and Quarantine Bureau,Xi’an 710068,China)
A method was developed for the determination of arbutin in pomegranate juice concentrate by solid phase extraction(SPE)and ultra performance liquid chromatography-tandem mass spectrometry(UPLC-MS/ MS).Samples were diluted by water and then cleanup with HLB and aminopropyl SPE columns.UPLC was performed on a BEH Amide column(100mm×2.1mm,1.7μm)using a gradient acetonitrile-water system as mobile phase,and MS/MS was performed with multiple reation monitoring(MRM)mode using m/z 271.2>108.0 as quantitative ion pair and m/z 271.2>160.9 as qualitative ion pair.Quantitation was carried out using an external standard method.The detection limit of arbutin was 0.006mg/kg and the calibration curves were linear at the range of 0.004~0.2mg/L with linear correlation coefficient as 0.9994.The recoveries ranged from 80.6%to 108.1%with relative standard deviations less than 8.3%.The results of sample cleanup were well,and the determination method was simple,fast and sufficient.It was suitable for quantitative and qualitative analysis of arbutin in pomegranate juice concentrate.
pomegranate juice concentrate;arbutin;solid phase extraction;ultra performance liquid chromatography-tandem mass spectrometry
TS255.7
A
1002-0306(2012)10-0062-04
2011-08-16
何强(1980-),男,硕士,高级工程师,主要从事食品检测技术方面的研究。
陕西省农业攻关项目(2010K01-19-4);国家质检总局科研项目(2009IK285);陕西出入境检验检疫局科研项目(2010IK001)。

