萝卜红色素的酯化修饰及性质研究
张媛媛,韦庆益,袁尔东,宁正祥
(华南理工大学轻工与食品学院,广东广州510640)
萝卜红色素的酯化修饰及性质研究
张媛媛,韦庆益,袁尔东,宁正祥*
(华南理工大学轻工与食品学院,广东广州510640)
萝卜红色素是安全、无毒副作用的天然食用色素,具有抗氧化能力。但是它的稳定性不高,限制了其在食品工业中的广泛应用。通过乙酰水杨酸酯化修饰色素,测定色素的稳定性,并采用ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)法和邻二氮菲法测定色素的抗氧化活性。结果显示,修饰后的萝卜红色素稳定性明显提高,而且仍然保持较高的抗氧化活性。
萝卜红色素,乙酰水杨酸,稳定性,抗氧化活性
1 材料与方法
1.1 材料与仪器
萝卜红色素E40 云南通海杨氏天然产物有限公司,50℃干燥2h;ABTS 上海阿拉丁;乙酰水杨酸广州化学试剂厂,60℃干燥4h;吡啶、二氯甲烷广州化学试剂厂,按文献[12]中的方法干燥;磷酸氢二钠、磷酸二氢钠、柠檬酸、磷酸、氢氧化钠、氯化亚砜、氯化钙、氯化铁、邻二氮菲、双氧水、硫酸亚铁 分析纯,广州化学试剂厂。
725S型分光光度计 上海棱光技术有限公司; RE-52型旋转蒸发仪 上海亚荣生化仪器厂; SevenEasy实验pH计 梅特勒-托利多仪器上海有限公司;Brucker Tensor 27红外光谱仪 波数范围为4000~500cm-1,美国Nicolet公司。
1.2 实验方法
1.2.1 乙酰水杨酸酰氯的制备 由于萝卜红色素和乙酰水杨酸酯化的空间位阻很大,而乙酰水杨酸的酰氯形式很活泼,所以先制备酰氯再酯化[13]。圆底烧瓶中加0.18g乙酰水杨酸和2mL氯化亚砜,连接回流冷凝管,冷凝管接装有CaCl2的干燥管,用10% NaOH溶液吸收尾气。加热至70℃,磁力搅拌至无气体产生。0.08~0.09MPa下70℃旋转蒸发,蒸出多余氯化亚砜,酰氯产物加5mL二氯甲烷保护。
1.2.2 乙酰水杨酸对萝卜红色素的酯化修饰 0.5g色素和5mL吡啶加入三口瓶,连接温度计、回流冷凝管和滴液漏斗,滴液漏斗中加入酰氯乙酰水杨酸。控制在50℃时逐滴加入酰氯乙酰水杨酸,反应5h。反应后油泵50℃旋转蒸发除去吡啶和二氯甲烷,加水溶解,离心除去不溶物,得水溶性色素。0.08~0.09MPa下50℃旋转蒸发得到红色粉末。
1.2.3 红外光谱结构表征 分别取萝卜红色素和酯化修饰的萝卜红色素粉末,与KBr混合研磨,均匀后压片,用红外光谱仪在4000~400cm-1范围内进行测定。
1.2.4 稳定性的测定
1.2.4.1 pH对色素稳定性的影响 用0.10mol/L的柠檬酸溶液、0.10mol/L的磷酸氢二钠溶液和0.10mol/L的磷酸二氢钠溶液,配制pH 3、4、5、6、7、8的磷酸盐缓冲溶液。分别用缓冲液配制不同pH的色素溶液,放置15min后观察颜色变化并测定最大吸收波长。
1.2.4.2 温度对色素稳定性的影响 用pH 3的磷酸盐缓冲溶液配制合适吸光值色素溶液,分别在室温、50、60、70、80、100℃加热1h后,分别在512nm下测定吸光值。
1.2.4.3 光对色素稳定性的影响 用pH 3的磷酸盐缓冲液配制合适吸光值的色素溶液,每天放在室内散射光(180Lux)和室外自然光(54500Lux)下照射8h,在512nm下测定吸光值。
1.2.5 抗氧化性的测定
1.2.5.1 ABTS法测定色素总抗氧化能力 用8mmol/LABTS与3mmol/L过硫酸钾,在去离子水中室温反应16h。然后用pH 7.40的磷酸盐缓冲液稀释至734nm处的吸光值为0.70±0.02,得到ABTS+自由基溶液,该溶液要现配现用。样品与ABTS+自由基溶液混合,黑暗反应30min,734nm测吸光值,记为样品A。同时做样品参比(用PBS代替ABTS+)和对照(用PBS代替样品),分别记为样参A和对照A[14]。以VC作为阳性对照。清除率用以下公式计算:
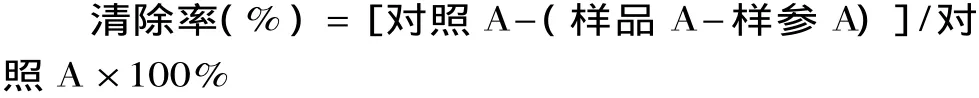
1.2.5.2 色素对羟自由基清除能力的测定 取0.40mL PBS、蒸馏水0.80mL于1.50mL离心管中,作为空白参比管;取0.40mL PBS、0.20mL邻二氮菲(1.50mmol/L)、0.20mLFeSO4(1.50mmol/L)和0.40mL蒸馏水,作为未损伤管;取 0.40mL PBS、0.20mL邻二氮菲(1.50mmol/L)、0.20mLFeSO4(1.50mmol/L)、0.20mL蒸馏水和 0.20mLH2O2(0.02%),作为损伤管;取0.40mL PBS、0.20mL待测样和0.20mL蒸馏水,作为样品参比管;取0.40mL PBS、0.20mL邻二氮菲(1.50mmol/L)、0.20mL FeSO4(1.50mmol/L)、0.20mL待测样和0.20mL H2O2,作为样品管[15]。
将上述管置恒温水浴锅中,37℃保温1h后,在536nm处测定吸光值。以VC作为阳性对照。清除率按下式计算:
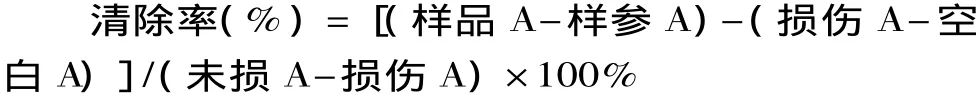
2 结果与讨论
2.1 酯化修饰结果
酯化修饰后的萝卜红色素具有很好的稳定性,其色价为30.2,损失率为9.8%。萝卜红色素苯并吡喃环上的C-7、C-4’位和糖环C上的羟基,都可能是酯化的位置。
2.2 红外光谱结构表征
图1的图谱a为修饰前萝卜红色素的红外光谱图,a、b图中,3400cm-1附近有一个宽而强的吸收峰,为芳环与糖基上羟基的伸缩振动吸收峰。2925.80cm-1的吸收峰是由糖环中亚甲基的C-H键伸缩振动引起的。1701.09cm-1为羰基的伸缩振动,1604.66cm-1为C-O的对称与不对称伸缩振动,说明萝卜红色素具有酰基化结构。1514.01、1448.44cm-1为芳环和杂环骨架振动。1342.36、1269.07、1174.56和1074.27cm-1为糖环中 C-O-C的伸缩振动吸收峰。
图1中的图谱b为乙酰水杨酸酯化修饰后萝卜红色素的红外光谱图,图中除了具有萝卜红色素原有吸收峰外,还有1720.38cm-1处的酯C=O的特征吸收;1604.66cm-1处C-O的伸缩振动明显增强; 1249.78cm-1的强峰为乙酸酯C-O-C的伸缩振动吸收峰,初步判定可能生成了酯键。在757.97cm-1处出现的强吸收峰,为苯环的邻位取代,是乙酰水杨酸区别于萝卜红色素的结构特征。
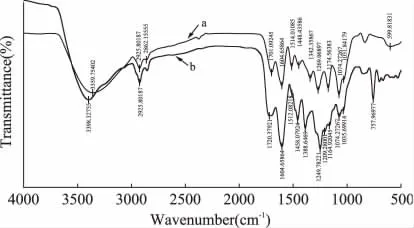
图1 修饰前后萝卜红色素的红外光谱图Fig.1 FTIR spectra of red radish pigment and esterfied pigment
2.3 色素稳定性
2.3.1 pH对色素稳定性的影响 萝卜红色素的颜色随着pH的变化而变化。如表1所示,修饰前的色素颜色及最大吸收波长在不同pH下有很大差异。颜色及最大吸收波长变化的原因是花色苷在不同的pH下以不同的化学结构存在的。强酸性介质(pH 1)中,红色的2-苯并吡喃盐占主导地位;pH增加,2-苯并吡喃盐被水亲和攻击变为无色的甲醇假碱,甲醇假碱失去A环和B环之间的共轭双键,不能吸收可见光。同时随着pH增加中性的紫色醌式碱增加。当pH继续增加,生成的无色甲醇假碱通过开环生成查耳酮形式,同时中性的醌式碱转化为离子化的蓝色醌式碱酯化修饰后的色素在pH 3~5都为鲜红色,最大吸收波长保持在514nm左右。虽然pH大于5后颜色仍然变化很大,但相对于修饰前的色素,其对pH的稳定性有了很大提高,在很大程度上提高了色素的应用范围。
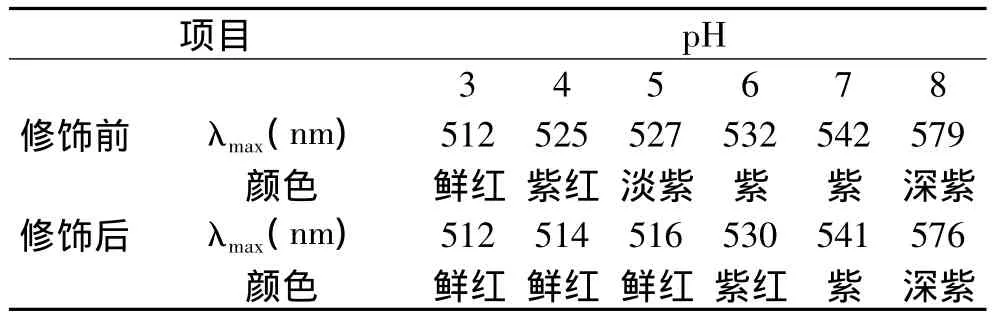
表1 修饰前后萝卜红色素在不同pH下的最大吸收波长(λmax)及颜色变化Table 1 Maximum absorption wavelength(λmax)and color of red radish pigment and esterfied pigment
2.3.2 温度对色素稳定性的影响 由图2可以看出,修饰前色素在50℃以下较稳定,而50℃以上吸光值下降很快。加热前,萝卜红色素的吸光值为1.154,100℃加热1h后为0.953,损失率达17.42%。
修饰后色素对温度很稳定。加热前吸光值为0.651,100℃加热1h后为0.593,损失率仅为8.91%。所以乙酰水杨酸修饰色素可以很好地提高萝卜红色素对温度的稳定性。
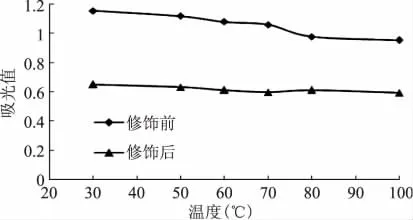
图2 温度对色素稳定性的影响Fig.2 Effect of temperature on stability of pigment
2.3.3 光对色素稳定性的影响 从图3可知,在室内散射光下照射时,酯化修饰前后的萝卜红色素都较稳定,色调没有变化。放置5d后修饰前的色素损失率为13.73%,修饰后的色素几乎没有损失。
在室外自然光照射下,色素的稳定性差异很大。照射时间在3d内,修饰前后萝卜红色素的损失率都不大。但是随着时间继续增加,修饰前的色素开始出现较大损失,照射5d后,修饰前的色素损失率达48.59%。其原因可能是光照条件下酰基脱落,导致萝卜红色素稳定性下降。修饰后的色素也有损失,照射5d后,损失率为21.69%。所以乙酰水杨酸酯化修饰萝卜红色素可以明显提高其对光的稳定性。
2.4 抗氧化性结果
2.4.1 ABTS法结果 色素对ABTS+自由基的清除能力可以用来衡量色素总的抗氧化能力。从萝卜红色素对ABTS+自由基的清除能力可以看出,萝卜红色素比VC清除自由基的能力强,且清除率随浓度的增加而增大。色素浓度在0.01mg/mL时清除率就达到了98.49%,而VC浓度为0.01mg/mL时清除率为79.50%。乙酰水杨酸修饰后色素清除自由基的能力略有降低,但仍比VC的清除效果好。色素浓度为0.01mg/mL时清除率为84.42%。清除率也随浓度的增大而增大,当浓度增大到一定值时,清除率增加缓慢,这可能是由于羟基被新的取代基取代而降低了色素的抗氧化能力。
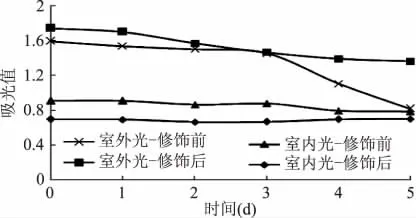
图3 光对色素稳定性的影响Fig.3 Effect of light on stability of pigment
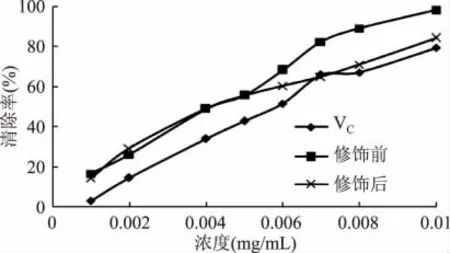
图4 色素清除ABTS+自由基的能力Fig.4 Scavenging ability of pigment on ABTS+radical
2.4.2 羟自由基的清除能力 邻二氮菲法是检测抗氧化剂清除羟自由基能力的一种简单便捷的方法。由于Fenton反应产生羟自由基能够氧化反应体系中的Fe2+,从而能够评价抗氧化剂清除羟自由基的能力。浓度低时,萝卜红色素比VC清除羟自由基的能力弱,而清除能力随浓度的增加而增大,浓度达到0.18mg/mL时,色素对羟自由基的清除率达到98.04%。乙酰水杨酸修饰后,由于乙酰水杨酸的羧基与色素苯环上的羟基发生了酯化,使苯环上羟基数量减少,明显降低了色素清除羟自由基的能力。但是色素对羟自由基的清除率仍随浓度增加而迅速增大,所以修饰后的色素保持了对羟自由基良好的清除能力。
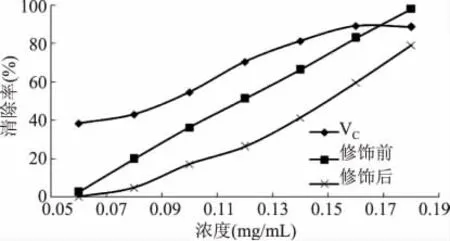
图5 色素清除羟自由基的能力Fig.5 Scavenging ability of pigment on hydroxyl radical
3 结论
本研究通过对萝卜红色素进行乙酰水杨酸酯化修饰,得到的色素对pH、温度和光的稳定性明显提高。修饰前色素只在pH 3为鲜红色,修饰后色素在pH3~5范围内都能维持鲜红色。修饰前色素只是在50℃以下较稳定,50℃以上加热后吸光值则下降很快。而修饰后的色素在100℃都可表现出较强的稳定性。修饰后色素在室外自然光照射5d后,损失率仅为21.69%,其耐光性明显优于修饰前。修饰后色素稳定性的提高,可能是由于乙酰水杨酸和萝卜红色素形成的酯键。抗氧化活性实验表明,修饰后的色素仍然保持了色素原有的抗氧化活性。因而修饰后的色素有着更广泛的应用前景和利用价值,为萝卜红色素在食品工业中的广泛应用提供了可行性。
[1]李成琼,司军,宋洪元.重庆市胭脂萝卜生产问题探讨[J].长江蔬菜,2003(9):48-49.
[2]赵芳,王自军,边丽.萝卜红色素抗自由基活性研究[J].食品科技,2008,34(3):185-187.
[3]凌关庭.可供开发食品添加剂(Ⅶ)脱臭红萝卜色素及其抗氧化作用[J].粮食与油脂,2003(4):48-50.
[4]武彦文,吕晓玲,张泽生,等.一种优质的食用天然色素-萝卜红花色苷的性质研究[J].天津轻工业学院学报,2001 (1):24-27.
[5]张志红,陈清轩.萝卜色素的提取及其性质[J].食品科学,1992(7):12-16.
[6]孙建,彭子模,彭宏祥,等.提高蜀葵天然色素稳定性方法的研究[J].食品工业科技,2009,30(1):275-279.
[7]Anna Bakowska,Alicja Z Kucharska,Jan Oszmianski.The effects of heating,UV irradiation,and storage on stability of the anthocyanin-polyphenol copigment complex[J].Food Chemistry,2003,81(3):349-355.
[8]赵佳丽,欧阳杰,王建中,等.萝卜红色素金属络合化学修饰后的稳定性研究[J].食品工业科技,2006,27(7):153-158.
[9]Renata V Tonon,Catherine Brabet,Miriam D Hubinger. Anthocyanin stability and antioxidant activity of spray-dried acai (Euterpe oleracea Mart.)juice produced with different carrier agents[J].Food Research International,2010,43(3):907-914.
[10]Keiko Yonekura-Sakakibara,Toru Nakayama,Mami Yamazaki,et al.Modification and stabilization of anthocyanins// Kevin Gould,Kevin Davies,Chris Winefield,ed.Anthocyanins,biosynthesis,functions,and applications[M].New York:Springer,2009:169-190.
[11]李颖畅,齐凤元,樊严.提高花色苷稳定性的研究进展[J].中国调味品,2009,34(11):88-111.
[12]张毓凡,曹玉荣,冯霄,等.有机化学实验[M].南京:南开大学出版社,1999.
[13]王庆华,陈敏丽,王晶,等.水杨酸酰胺化衍生物的合成[J].合成化学,2008,16(2):200-202.
[14]Joseph M Awika,Lloyd W Rooney,Ralph D Waniska. Anthocyanin from black sorghum and their antioxidant properties[J].Food Chemistry,2004,90(1-2):293-301.
[15]吴建芳,薛梅,李炳奇,等.天山堇菜总黄酮的提取工艺及抗氧化活性研究[J].食品科技,2010,35(10):214-217.
Research of esterified modification and characterization of red radish pigment
ZHANG Yuan-yuan,WEI Qing-yi,YUAN Er-dong,NING Zheng-xiang*
(College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China)
The red radish pigment is a natural edible pigment with the characteristics of safety,free of side effect and antioxidant activity.However,the instability of this pigment limits its use in food industry.In this paper,the red radish pigment was modified by acetyl salicylic and the stability of the modified pigment was compared with natural pigment.Antioxidant activity was determined by ABTS(2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate))and phenanthroline methods.The result indicated that stability of modified pigment was improved significantly,while antioxidant activity kept high levels.
red radish pigment;acetyl salicylic;stability;antioxidant activity
TS202.3
A
1002-0306(2012)10-0313-04
胭脂萝卜又称红心萝卜,皮肉深紫,肉质酥脆。重庆的涪陵、武隆、南川等县是胭脂萝卜的主要产区[1]。它的蛋白质、脂肪、钙、铁、维生素B1、维生素B2含量比白萝卜高,有消食、顺气、化痰、止咳、利尿、补虚等作用。从胭脂萝卜中提取的萝卜红色素安全、无毒,具有抗氧化等多种生物活性[2],可广泛应用于食品、饮料、化妆品等领域。萝卜红色素属于花色苷类天然色素[3],是天竺葵素的葡萄糖苷衍生物,为天竺葵素-3-槐二糖-5-葡萄糖的双酰基结构,并可结合(酰化)有阿魏酸(Fer)、对羟基苯丙酸(ρ-cou)、咖啡酸(caf)等有机酸。由于花色苷性质不稳定,光、pH、温度和金属离子等都会引起其性质变化[4-5]。因此提高萝卜红色素的稳定性,对于它在食品工业中的应用和推广具有重要的意义。一般可通过添加保护剂[6]、辅助色素[7]、金属络合[8]、微胶囊化[9]以及酰基化[10]等方法来提高花色苷类色素的稳定性。文中拟采用酯化修饰的方法,使乙酰水杨酸和萝卜红色素形成稳定的化学结构,形成空间位阻防止水化作用产生[11],从而达到提高色素稳定性的目的。并且对萝卜红色素清除ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)自由基和羟自由基的能力进行测定,评价其抗氧化能力,为进一步的开发应用提供科学依据。
2011-09-20 *通讯联系人
张媛媛(1986-),女,研究生,研究方向:食品化学。
国家自然科学基金(21002034)。

