贮藏“海沃德”猕猴桃中霉菌的分子鉴定及生物学特性的研究
段爱莉,雷玉山,高贵田,*,孙翔宇,梁 俊
(1.陕西师范大学食品工程与营养科学学院,陕西西安710062; 2.陕西伯瑞猕猴桃研究院,陕西西安710062)
贮藏“海沃德”猕猴桃中霉菌的分子鉴定及生物学特性的研究
段爱莉1,雷玉山2,高贵田1,*,孙翔宇1,梁 俊1
(1.陕西师范大学食品工程与营养科学学院,陕西西安710062; 2.陕西伯瑞猕猴桃研究院,陕西西安710062)
目的:分离与鉴定陕西省周至县贮藏期腐烂“海沃德”猕猴桃果实中的霉菌,并对其生物学特性进行研究,为今后猕猴桃贮藏保鲜的研究提供理论依据;方法:通过形态观察并结合分子鉴定,确定猕猴桃病原菌的种类;通过对其生长培养基、光照、温度、pH、致死温度和抗紫外能力等生物学特性研究,分析不同病原菌之间的生物学特性的差异。结果:从腐烂猕猴桃中共分离出 5株致病菌,鉴定为:Penicillium sp.CLF-S、Penicillium purpurogenum、Penicillium chrysogenum、Penicillium paneum和Trichoderma longibrachiatum。生物学特性结果表明:在豆芽汁培养基上产孢量最大;连续光照条件下孢子产量最高,并且在温度为30℃、pH为6.0~7.0时为产孢量最佳;致死温度80℃以上且抗紫外能力在72.73%~92.45%之间。结论:陕西省周至县“海沃德”猕猴桃贮藏期致病菌主要为青霉菌属和木霉菌属,生长pH和温度范围宽、致死温度高、抗紫外能力较强。
猕猴桃;海沃德;霉菌;ITS;生物学特性
猕猴桃属于猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)植物,系呼吸跃变性果实,且为皮薄多汁的浆果,采后在常温贮藏下极易软化腐烂,损失率高。贮藏后期腐烂主要是由霉菌侵染而引起的,是影响猕猴桃果实生产的重要病害之一[1-2]。王雅等[3]通过对微生物的形态、培养特征及生物学特性的研究,鉴定出苹果中的霉菌分别为青霉属(Penicillium)、黑曲霉属(Aspergillus)。多种水果病原真菌最初的鉴定分类都是从形态学上依据Rifai和Bissett的分类方法来进行,但随着生物技术的进一步发展,分子生物学的鉴定方法被越来越多地应用于真菌的鉴定分类中[4-6]。大多数水果与蔬菜的致病菌在多种环境条件下生存能力极强,甚至同种菌的不同菌株在不同环境下所表现出来的性状都存在很大的差异,这主要表现在对培养基的利用、对生长环境温度及光照的适应性等方面[7]。因此,致病霉菌的生物学特性的详细研究有其现实的意义。本文通过形态学和分子生物学对分离出的治病霉菌进行鉴定,同时进行生物学特性的测定,为今后研究猕猴桃生物保鲜奠定基础。
1 材料与方法
1.1 材料与仪器
猕猴桃 陕西省周至县霉烂“海沃德”猕猴桃;豆芽 陕西省华润万家超市;马丁氏培养基、马铃薯葡萄糖培养基PDA、察氏琼脂培养基CA、蔗糖、葡萄糖 中国进出口商品检验技术研究所;真菌DNA提取试剂盒、UNIQ-10柱式PCR产物纯化试剂盒、100bp plus DNA ladder buffer、2×Taq PCR Master Mix、MgCl2、ITS1、ITS4 上海生工生物工程有限公司。
超净工作台,数码生物显微镜下电子显微镜,电泳仪,凝胶成像仪,梯度PCR仪(美国伯乐)。
1.2 实验方法
1.2.1 分离与纯化
1.2.1.1 富集培养 将猕猴桃腐烂部位用无菌水清洗干净,用灭菌后的镊子,对于每个品种,分别取不同腐烂部位各5g,总共25g,置于装有225mL无菌水的500mL三角瓶中摇匀,振荡20min,放于含有链霉素的马铃薯液体培养基中再振荡摇匀,然后置于28℃的恒温培养箱中培养3d,再进行分离与纯化。
1.2.1.2 分离与纯化[8-11]稀释平板法:进行10倍梯度稀释,依次稀释成10-2、10-3、10-4、10-5、10-6mL稀释液。在28℃,相对湿度90%恒温恒湿下倒置培养,3d后观察菌株的生长状况。划线分离法:观察菌落形态,用无菌接种环挑取不同形态霉菌菌株的孢子,在菌种纯化培养基上作平板划线,培养条件同上。经一系列的分离、纯化、筛选步骤后得到霉菌,然后在4℃冰箱保存。
1.2.1.3 属的鉴定 将纯化后的菌株再次接种培养3d后,用苯酚乳酸染液染色,然后进行镜检观察,结合菌落形态特征,依据鉴定手册确定属。
1.2.1.4 种的鉴定 将所纯化的青霉菌和木霉菌点接种到PDA、马丁氏和察氏培养基,在相同条件下培养,记录不同菌株在不同培养基上的生长速度、菌落颜色、大小以及质地等特征。对纯化培养菌株进行产孢结构的观察,记录其主要形态、分生孢子的大小以及形状等特征。
1.2.2 霉菌的ITS序列测定[12-14]
1.2.2.1 总DNA的提取 参照FungalDNAkit真菌基因组DNA提取试剂盒说明操作。
1.2.2.2 ITS区扩增 引物用真菌通用引物正向引物:
ITS1:5'-TCC GTA GGT GAACCT GCG G-3';
ITS4:5'-TCC TCC GCT TA TTGA TA T GC-3'。
PCR反应的总体积为25μL,含有 DNA模板1μg、10μmol·L-1的正向引物和反向引物各1μL,12.5μL的2×Master Mix。
PCR扩增程序:94℃预变性5min,94℃变性50s,50℃退火1min,72℃延伸90s,共34个循环,最后72℃延伸10min。PCR产物经琼脂糖凝胶电泳,并用UVP凝胶成像分析系统分析扩增后出现的条带。
DNA纯化:采用小量DNA快速回收试剂盒法。1.2.2.3 霉菌的ITS序列分析 将纯化后的DNA由上海生工生物工程技术服务有限公司测序,将测得的 ITS区序列通过国际连接直接载入 GenBank (http://www.ncbi.nlm.nih.gov)进行同源性搜索,与已报道真菌菌株的ITS区序列进行同源性比较。
1.2.3 霉菌的生物学特性的测定
1.2.3.1 不同培养基对病原菌产孢量的影响 将PDA培养基、豆芽汁蔗糖培养基、豆芽汁葡萄糖培养基、查氏培养基分别调节pH=7.0,然后制好平板,将5mm灭菌滤纸片蘸取一定浓度的孢子悬浮液接于平板上,在28℃恒温条件下黑暗中培养,培养7d后用血球计数板测定孢子产生数量。
1.2.3.2 不同光照处理对病原菌产孢量的影响 分别设置24h连续光照、24h连续黑暗、光照/黑暗各12h交替3个处理。其中培养基为PDA(pH=7.0)、培养温度为28℃、培养时间为7d。
1.2.3.3 不同培养温度对病原菌产孢量的影响 分别设置0、15、20、25、30、35、40℃7个处理,其中培养基为PDA(pH=7.0)、黑暗中培养、培养时间为7d。
1.2.3.4 不同pH对病原菌产孢量的影响 将PDA培养基灭菌后,无菌条件下用1mol/L的 HCl和1mol/L的NaOH调节pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0。然后在培养温度为28℃恒温条件下黑暗中培养7d。
1.2.3.5 分生孢子致死温度的测定 分别设置40、45、50、55、60、65、70、75、80、85℃恒温水浴锅中处理20min,后迅速冷却,之后用移液枪移取200μL到PDA培养基(pH=7.0)上,然后在培养温度为28℃恒温条件下黑暗中培养7d。
1.2.3.6 抗紫外线能力的测定 分别设置在紫外线(15W,灯管与培养皿间距52cm)下照射1、3、5、7、9min,以不处理作为对照,然后在培养温度为28℃恒温条件下黑暗中培养7d。计算致死率。
致死率(%)=(对照单菌落个数-处理单菌落个数)/对照单菌落个数×100%
2 结果与讨论
2.1 形态学鉴定结果
2.1.1 青霉属的鉴定 青霉菌在28℃、黑暗条件下,PDA培养基上菌落生长局限,菌落为深绿色,质地细腻,中央稍凸起菌落,边缘为白色、稠密,背面为黄绿色,见图1-a。在察氏培养基上菌落颜色为乳白色,质地细腻,中央稍凸起有灰色斑点,菌落边缘为白色或者绿色,背面无色,见图1-b。在查氏培养基上在数码显微镜下观察到的帚状枝对称或者不对称、紧密,有两轮分枝,分生孢子呈卵形、椭圆形或近球形,光滑,呈绿色见图1-c。
2.1.2 木霉属的鉴定 菌株在PDA培养基平板上,28℃、黑暗条件下菌落生长速度很快,颜色为深绿色,气生菌丝体绒状至粉状,菌丝为白色,随着菌落的不断扩大,从中心开始出现轮状的产孢区,并逐渐向外扩展;孢子颜色也由白变绿,呈粉末状,整个菌落整齐而扁平。培养7d后,菌落老熟,正面变为暗绿色,背面无色稀疏(图2-a)。在查氏培养基上菌落颜色为绿色,在培养皿中分布疏散,背面无色(图2-b)。在数码显微镜下观察到的树枝状,疏散,分生孢子呈卵形、椭圆形或近球形,光滑,呈绿色。在PDA培养基和查氏培养基上菌落形态和显微镜下的图片见图2。
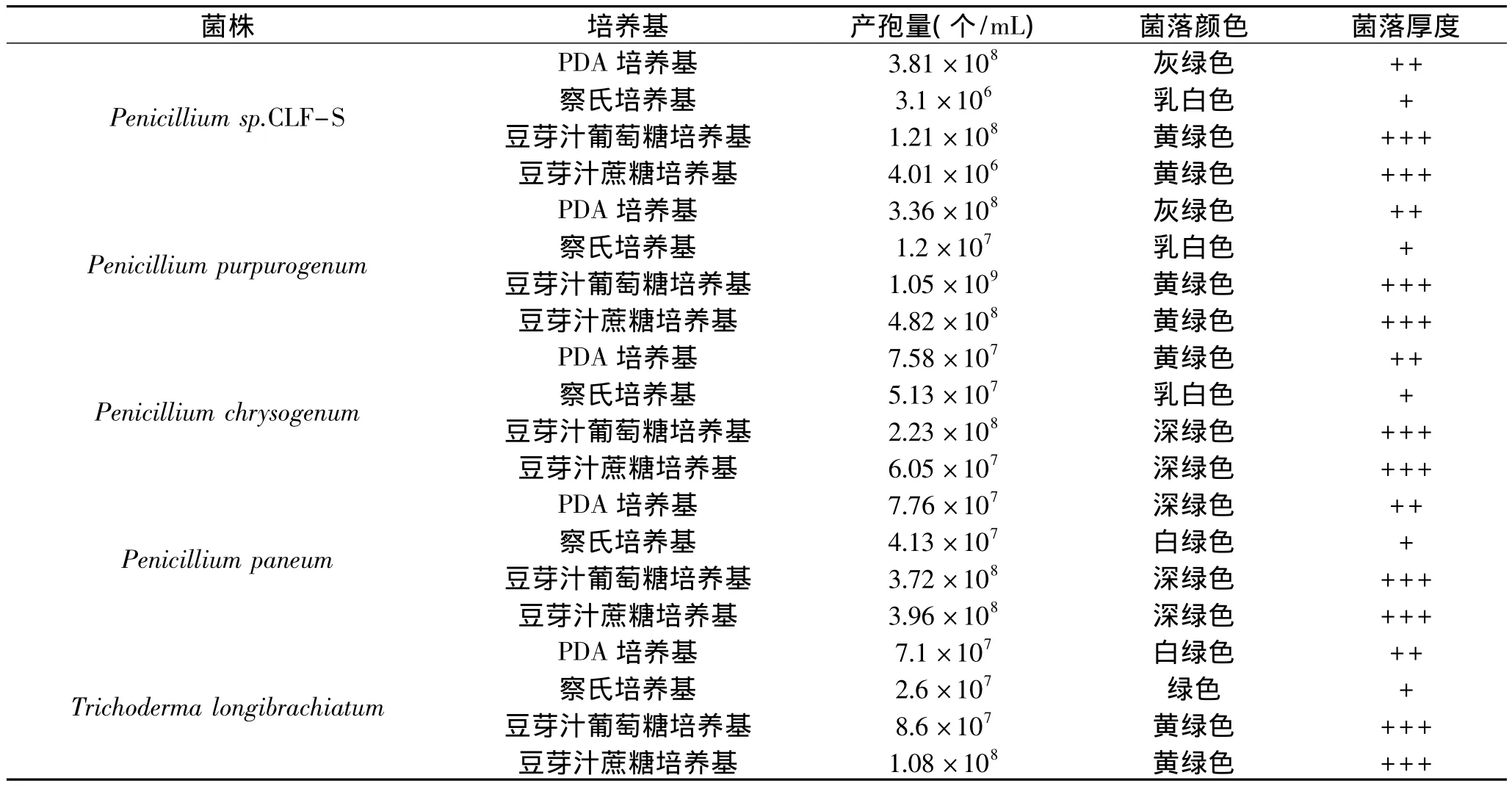
表1 五种病原菌在不同培养基上生长特性Table 1 Growth characteristicsofive pathogens in different medium
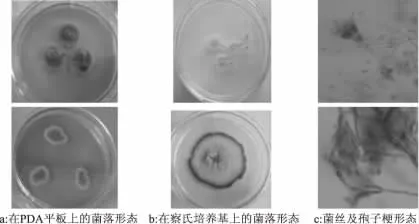
图1 青霉菌的形态特征Fig.1 Morphology of Penicillium
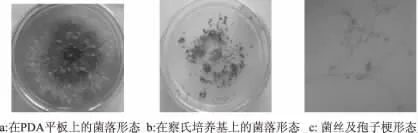
图2 木霉菌的形态特征Fig.2 Morphology of Trichoderma
2.2 分子生物学鉴定结果
2.2.1 菌株ITS PCR电泳结果 将5株霉菌基因组DNA稀释做模板,用引物ITS1和ITS4进行PCR扩增,得到霉菌的ITS1-5.8S rDNA-ITS4片段,通过琼脂糖凝胶电泳检测。测序表明:该霉菌的ITSDNA序列长度大小为500~750bp。
2.2.2 ITS区序列测定 测定基因序列结果显示,序列长度为579~608bp不等,序列中包含部分18S rRNA、ITS1、5.8S rRNA、ITS2及部份28S rRNA,在GenBank中比对结果表明相似度在99%~100%,从而鉴定出这5株致病菌为:Penicillium sp.CLF-S、Penicillium purpurogenum、Penicillium chrysogenum、Penicillium paneum 和 Trichoderma longibrachiatum。并且在 GenBank数据库中登录号分别为: AB505424.1、GU566251.1、AY373902.1、AB479335.1、EU401572.1。
2.3 生物学特性测定结果
2.3.1 不同培养基对病原菌产孢量的影响 如表1所示,在豆芽汁培养基上菌丝生长量较大,菌落最厚,其次为PDA培养基,在察氏培养基上生长量最小。产孢情况:Penicillium purpurogenum、Penicillium chrysogenum和Penicillium paneum三株青霉菌在豆芽汁葡萄糖培养基上产孢量最大,察氏培养基产孢量明显最小;Penicillium sp.CLF-S菌株在PDA培养基上产孢量最大,察氏培养基产孢量明显最小; Trichoderma longibrachiatum菌株在豆芽汁蔗糖培养基上产孢量最大,察氏培养基产孢量明显最小。菌落颜色:四株青霉菌在PDA培养基上生长颜色为灰绿色或黄绿色,在察氏培养基上基本为乳白色或白绿色,而在豆芽汁葡萄糖和豆芽汁蔗糖培养基上生长颜色为深绿色或黄绿色;木霉菌株在PDA培养基上生长颜色为白绿色,在察氏培养基上基本为绿色,而在豆芽汁葡萄糖和豆芽汁蔗糖培养基上生长颜色为深绿色。
2.3.2 不同光照处理对病原菌产孢量的影响 如图3所示,光照、黑暗及光暗交替对五种菌产孢量有明显影响,其中光照处理产孢量显著高于其他两者(P≤0.05)。
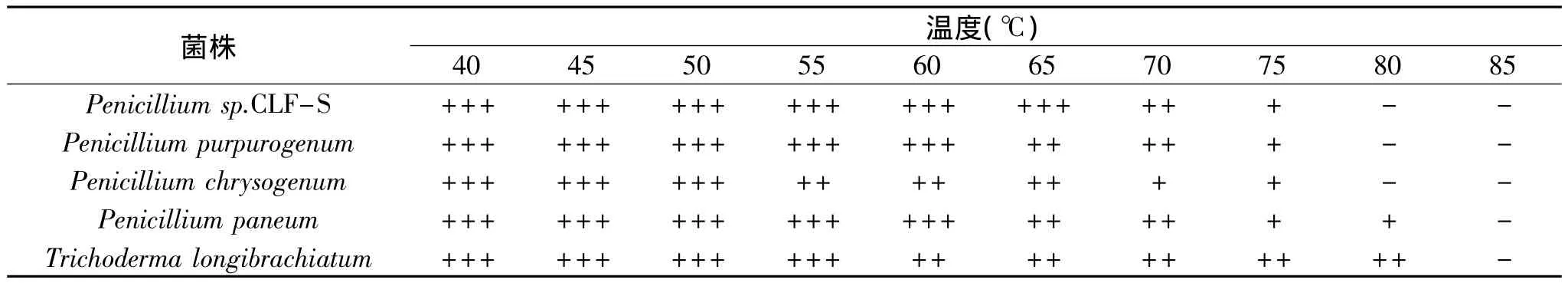
表2 孢子致死温度的测定Table 2 Determination of spore lethal temperature
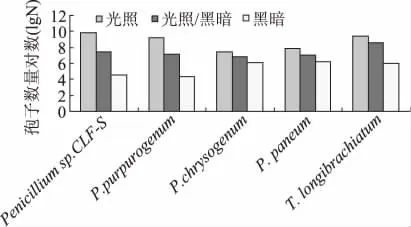
图3 光照处理对产孢的影响Fig.3 Effect of illumination on the spore number
2.3.3 不同培养温度对病原菌产孢量的影响 如图4所示,木霉在15~40℃之间均能产孢,但在25~35℃之间产孢量较高。其中30℃产孢量最多,明显高于20℃时的产孢量。其它四株青霉菌也在25~35℃产孢量较高,但产孢量明显低于木霉菌。
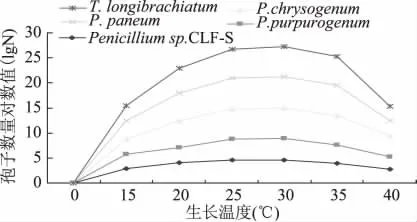
图4 培养温度对产孢量的影响Fig.4 Effect of incubation temperature on the Spore number
2.3.4 不同pH对病原菌产孢量的影响 如图5所示,五种霉变微生物都有其相适应的生长pH范围,并且对pH的适应范围都比较广,在pH 2~8范围内均可产孢值,在pH为6~7时产孢量为最佳,pH<2及pH>8时菌株产孢量明显下降,且各pH间没有明显差异。
2.3.5 五种病原菌分生孢子致死温度的测定 如表2所示,五种病原菌的致死温度较高,其中Penicillium sp.CLF-S、Penicillium purpurogenum、Penicillium chrysogenum 致 死 温 度 为 80℃,时 间 20min; Penicillium paneum和 Trichoderma longibrachiatum致死温度为 85℃,时间 20min,这表明 Penicillium paneum和Trichoderma longibrachiatum最耐热。
2.3.6 抗紫外线能力的测定 实验结果见图6,从图6中可知,对5株菌株分别进行1、3、5、7、9min的紫外线辐照处理,不同霉菌致病菌之间的抗紫外能力存在一定的差异。相同时间的紫外辐照条件下,五种霉菌孢子致死率差异显著。随着紫外辐照时间的延长,不同病原菌株的致死率逐渐增加,当增加到一定程度,病原菌必将完全死亡。其中 Penicillium purpurogenum紫外能力最弱,辐照9min时致死率为92.45%,而Penicillium chrysogenum抗紫外能力最强,辐照9min的致死率为72.73%。因紫外灯的功率和照射距离固定,所以其杀菌效果只与照射时间的长短有关,呈线性相关,即照射时间越长,其照射范围内霉菌细胞所接受的辐射剂量越高,杀菌率也越高。
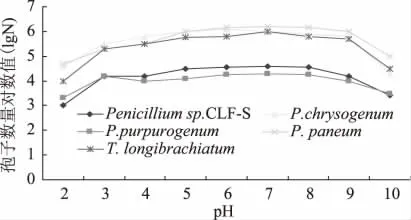
图5 pH对产孢量的影响Fig.5 Effect of pH on the spore number
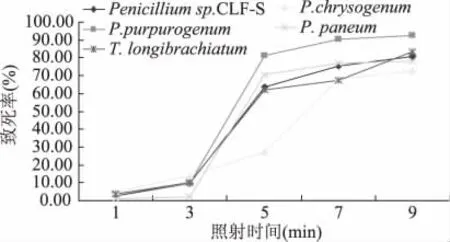
图6 紫外线照射时间对致死率的影响Fig.6 Effect of UV irradiation time on death rate
3 结论
本研究从腐烂的“海沃德”猕猴桃中分离得到5株致病菌,通过形态鉴定确定该5株菌株为木霉属和青霉属,并结合分子生物学鉴定,确定为: Penicillium sp.CLF-S、Penicillium purpurogenum、Penicillium chrysogenum、Penicillium paneum 和Trichoderma longibrachiatum。然后对其生长培养基、光照、温度、pH、致死温度和抗紫外能力等生物学特性进行研究,为今后进一步研究猕猴桃贮藏生物防治提供依据。从生物学特性测定结果可以看出,适于菌株产孢的条件范围较宽,这与已报道的霉菌特点一致[15-17]。5株菌株在多种培养基上都能正常生长并产孢,这与报道的其它青霉与木霉菌相似。可见光和近紫外光照射可以促进很多真菌的孢子产生,实验结果表明持续光照处理时,5株菌株的孢子产生数量比黑暗处理明显高。温度生长适应范围较宽,在40℃的较高温度下也能保持一定的生长存活能力,且能够产生少量的分生孢子,这说明这5株致病菌有很强的适应性。菌株在30℃时有较大产孢量,而与已报道的多数菌株在30℃时生长最快、产孢量高相一致[18-20]。而致死温度也有所差异,其中Penicillium sp.CLF-S、Penicillium purpurogenum 和Penicillium chrysogenum的致死温度为80℃,与已报道的产黄青霉致死温度低相一致。而 Penicillium paneum和 Trichoderma longibrachiatum致死温度为85℃,这表明 Penicillium paneum 和 Trichoderma longibrachiatum最耐热。相同时间的紫外辐照条件下,五种致病菌的致死率差异显著。随着紫外辐照时间的延长,不同病原菌株的致死率逐渐增加,当增加到一定程度,病原菌必将完全死亡。其中产紫青霉抗紫外能力最弱,辐照9min的致死率为92.45%,而长枝木霉抗紫外能力最强,辐照9min时致死率高达72.73%。结论表明这5株致病菌之间的生物学特性相比较存在一定差异,因此有必要进一步对其生防效果与作用机理进行研究,为更好研究提高猕猴桃贮藏期提供理论依据。
[1]唐艳.1-MCP对猕猴桃采后生理生化变化及贮藏品质的影响[D].咸阳:西北农林科技大学,2004.
[2]丁爱冬,于梁,石蕴莲.猕猴桃采后病害鉴定和侵染规律研究[J].植物病理学报,1993,25(2):149-153.
[3]王雅,樊明涛,赵萍,等.苹果中霉菌的分离与初步鉴定[J].食品工业科技,2009,30(10):164-166.
[4]Hoyos-Carvajal L,Orduz S,Bissett J.Genetic and metabolic biodiversity of trichoderma from colombia and adjacent neotropic regions[J].Fungal Genet Biol,2009,46:615-631.
[5]刘盼红.贮藏苹果中展青霉素产生菌的分离鉴定和生长代谢特征研究[D].咸阳:西北农林科技大学,2008.
[6]王斌,Ali Khatib Bakar,刘金亮,等.长枝木霉TlCC鉴定及其生物学特性研究[J].中国农学通报,2011,27(5):338-345.
[7]朱茂山,关天舒,蔡大旺,等.生防木霉菌T41菌株生物学特性研究[J].沈阳农业大学学报,2008,39(1):19-23.
[8]周德庆.微生物学教程[M].北京:高等教育出版社,1993:5.
[9]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999:6.
[10]江汉湖.食品微生物学[M].北京:中国农业出版社,2000.
[11]吴晓彬,胡文忠,刘程惠,等.鲜切苹果致病霉菌的分离鉴定[J].食品工业科技,2010,31(10):78-82.
[12]李平兰.PCR技术及其在食品微生物检测中的应用[J].食品科学,1998,19(7):3-5.
[13]刘军,刘维达.聚合酶链反应检测深部致病真菌的实验研究[J].中华皮肤科杂志,2005,38(8):503-505.
[14]Faggi E,Pini G,Campisi E,et al.Application of PCR to distinguish common speciesofdermatophytes[J].JClin Microbiol,2001,39(9):3382-3385.
[15]迪芬巴赫C W,德维克斯G S.PCR技术实验指南[M].北京:科学出版社,2000.
[16]方呈祥.中国高等学校菌种目录[M].北京:化学工业出版社,2009(4):170-185.
[17]史凤玉,朱英波,杨文兰.长枝木霉T8对水稻纹枯病菌拮抗的作用研究[J].中国农学通报,2005,21(2):264-265.
[18]王春红.柿饼霉变及其防霉技术[D].西安:陕西师范大学,2010.
[19]MARTIN O’BRIEN,KRISTIAN F NIELSEN,PADRAIG O’KIELY,etal.Mycotoxinsand othersecondary metabolites produced in vitro by penicillium paneum frisvad and penicillium roqueforti thomIsolated from baled grass silage in ireland[J].Agric Food Chem,2006,54:9268-9276.
[20]孔华忠.中国真菌志:第三十五卷(青霉属及其相关有性型属)[M].北京:科学出版社,2007.
Molecular identification and biological characteristics of mould in storage of“Haiwode”kiwi fruit
DUAN Ai-li1,LEI Yu-shan2,GAO Gui-tian1,*,SUN Xiang-yu1,LIANG Jun1
(1.College of Food Engineering and Nutritional Science,Shannxi Normal University,Xi’an 710062,China; 2.Shaanxi Bairui Kiwi Research Institue Co.,Ltd.,Xi’an 710062,China)
Objective:The mould from storage of“Haiwode”kiwi fruit of Zhouzhi country in Shannxi province were isolated and identified,so as to provide a theoretical basis of fresh kiwi fruit for future research.Method:With the molecular identification and morphological characteristic,the species of pathogens were distinguished.By means of the biological characteristics,the differences of pathogens were analysised.Results:Five strains were identified,such as Penicillium sp.CLF-S,Penicillium purpurogenum,Penicillium chrysogenum,Penicillium paneum and Trichoderma longibrachiatum.The biological characteristics of mould were screened and investigated.Bean sprouts medium was the most favorable medium for the spore.It could produced high spore for the continuous light conditions and 30℃,optimal pH 6.0~7.0.The lethal temperature was 80℃and UV capability was from 72.73%to 92. 45%.Conclusion:The mould from storage of“Haiwode”kiwi fruit of Zhouzhi country in Shannxi province were Penicillium and Trichoderma.While the results revealed that the pH and temperature for spore production ranged,the lethal temperature was high,and the UV resistance ability was strength.
kiwi fruit;Haiwode;mould;ITS;biological characteristics
TS255.3
A
1002-0306(2012)10-0321-05
2011-07-13 *通讯联系人
段爱莉(1986-),女,在读研究生,研究方向:食品生物技术、食品安全。
陕西省“13115”科技创新工程重大科技专项(2009ZDKG-05);猕猴桃质量安全技术研究与示范(771845);陕西师范大学自然科学基金优秀项目(995828)。

