传统生理生化鉴定技术结合PCR法分析复合保鲜剂对冷藏带鱼贮藏期间菌相变化的影响
蓝蔚青,谢 晶
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海201306)
传统生理生化鉴定技术结合PCR法分析复合保鲜剂对冷藏带鱼贮藏期间菌相变化的影响
蓝蔚青,谢 晶*
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海201306)
将微生物传统生理生化鉴定技术与PCR法相结合,研究了复合保鲜剂对冷藏带鱼贮藏期间菌相变化的影响。通过对冷藏对照组与保鲜剂处理组样品贮藏期间的主要微生物进行分离纯化、16S rDNA序列分析与生理生化鉴定,并作系统发育树分析,最终鉴定出13株具有典型特征的纯菌株。对照组样品在货架期终点时,其主要微生物的种类与所占比例依次为:腐败希瓦氏菌(34.7%)、荧光假单胞菌(14.5%)、松鼠葡萄球菌(10.2%)、嗜水气单胞菌(8.2%)、弧菌(6.1%)、恶臭假单胞菌(6.1%)、绿色气球菌(4.1%)、金黄色葡萄球菌(4.1%)、蜡样芽孢杆菌(4.0%)、铜绿假单胞菌(2.0%)、嗜冷杆菌(2.0%)、成团肠杆菌(2.0%)、约氏不动杆菌(2.0%)。其中,腐败希瓦氏菌为特定优势腐败微生物。假单胞菌属在带鱼冷藏过程中所占比例大小依次为荧光假单胞菌>恶臭假单胞菌>铜绿假单胞菌。经复合保鲜剂处理后,能够使冷藏带鱼的二级鲜度货架期延长9d,并使其贮藏期间的细菌菌相组成比例发生变化,细菌种类减少到9种。主要优势菌的比例明显减少,表明复合保鲜剂对带鱼体内腐败菌具有不同程度的抑制作用。
带鱼,复合生物保鲜剂,聚合酶链反应(PCR),生理生化鉴定,菌相变化
水产品的腐败变质主要由微生物的作用影响造成,微生物的生长活动决定了水产品质量的变化,因此对水产品贮藏过程中细菌菌相变化的研究将有助于对水产品货架期进行预测,为水产品保藏技术的发展提供理论基础[1-2]。带鱼(Trichiurus haumela)又称裙带鱼、海刀鱼、白带鱼等,属暖温性近底层鱼类,为我国四大经济鱼类,具有较高的商业价值。然而,其常温下易腐败,冷藏是目前应用最广泛、最有效的水产品保鲜方法之一,可有效抑制细菌的增殖速度。鲜鱼在贮藏期间细菌种群不断变化,某些细菌适应此贮藏条件逐渐占据优势地位,并产生腐败臭味和异味等代谢产物,这些细菌就是该产品的特定腐败菌(Specific Spoilage Organism)[3]。由于各种细菌的腐败能力及产生的代谢产物不同,造成对产品不同的腐败作用,因此研究其腐败过程不仅需要研究细菌数量的变化,而且还要了解细菌种类的变化[4]。过去几十年里,国外学者对新鲜、冷藏过程和腐败鱼类的细菌学开展过部分研究工作[5-7]。近年来,国内也有少部分相关报道。裘迪红[8]等通过生理生化鉴定法对梭子蟹冷藏期间体内的腐败菌菌相变化进行了初步分析。刘寿春[9]等人分析了刚捕获淡水养殖罗非鱼体表不同部位和养殖池水的细菌菌相。郭全友[10]等从菌落和细胞形态、生理生化特征、细胞脂肪酸组成及同源性分析等方面确定了冷藏养殖大黄鱼的优势腐败菌。杨宪时[11]等对罗非鱼冷藏过程中的细菌种群变化进行了实验研究,而对于复合保鲜剂对水产品贮藏期间的菌相变化研究还未见报道。本研究利用传统的微生物分离纯化技术与16S rDNA分子鉴定方法相结合,分别对复合保鲜剂处理组与冷藏对照组的带鱼样品贮藏过程中的主要腐败微生物进行分离与快速鉴定,以揭示在低温下水产品中主导腐败微生物的菌相组成。研究结果将为进一步阐明复合保鲜剂的抑菌机理和实现靶向抑制产品腐败打下良好的基础,也为开发水产品微生物快速鉴定方法提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
鲜带鱼(Trichiurus haumela) 上海市浦东新区芦潮港码头水产市场,0.25~0.50kg/条,捕获后立即在冰藏条件下当日运送至实验室进行实验;胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤(TSB)、NaCl上海市疾病预防控制中心;革兰氏染液、芽孢染色液、微生物生理生化微量鉴定管 杭州天和生物制剂有限公司;dNTP Mixture、10×PCR Buffer、TaqDNA酶 日本TaKaRa BIO株式会社;引物27f、1492r、TAE电泳缓冲液(50×TAE)、Biospin细菌基因组DNA提取盒 生工生物工程(上海)有限公司;DNA纯化试剂盒 北京天根生物工程有限公司;溴化已锭染色液(EB),6×Loading Buffer,Marker:λDNA/Hind III,100bp DNA Ladder,琼脂糖等。
THZ-82A型气浴恒温振荡器 江苏金坛市环宇科学仪器厂;隔水式恒温培养箱、DHG-9053A型电热鼓风干燥箱、DK-8D型电热恒温水槽 上海一恒科技有限公司;LDZX-75KBS立式压力蒸汽灭菌器上海申安医疗器械厂;VS-1300L-U型标准超净工作台 苏净集团苏州安泰空气技术有限公司; MiniSpan Plue微型高速离心机 杭州奥盛仪器有限公司;TC-24/H(b)型基因扩增仪 杭州博日科技有限公司;DYY-6C型电泳仪 北京市六一仪器厂; BagMixer VW 拍打式均质器 France;电子显微镜ZEISS Scope A1.AXIO 上海永傲精密仪器有限公司;Disrupter genie(DNA混匀器),UVP BioImaging Systems(凝胶成像系统),SANYO MLS-3750高压灭菌锅等。
1.2 实验方法
1.2.1 复合生物保鲜剂的配制与原料处理
1.2.1.1 复合生物保鲜剂的配制 壳聚糖用1.0%乙酸溶液溶解,依次加入溶菌酶和茶多酚,使其最终配比为壳聚糖10.0g/L、溶菌酶0.3g/L与茶多酚3.0g/L,提前30min配好后立即放入(4±1)℃的冰箱中备用。
1.2.1.2 原料处理 将带鱼洗净,经“三去”处理(去头、去尾、去内脏),无菌操作切成6~7cm长的鱼段,随机分组,作保鲜或对照使用。处理时,将复合保鲜液涂膜于样品表面,沥干后依次放入PE保鲜袋,在(4±1)℃的冰箱中贮藏,以蒸馏水处理的带鱼段作为对照组。
1.2.1.3 菌落总数测定 采用有氧平板菌落计数法,按GBT 4789.2-2008国标[12]规定,分别将对照组第1、3、5、8d与复合保鲜剂处理组第1、3、5、8、10、12、16d冷藏带鱼的样品进行处理。
1.2.2 菌株分离鉴定 通过纯培养方法得到多个不同形态的单菌菌落,根据菌落外观与菌体镜检形态对细菌进行初步分类,计算同一种菌落的个数。
1.2.2.1 菌落与细胞形态观察 对分离纯化得到的单菌菌落进行形态观察记录与菌落计数,主要包括菌落大小、形态、颜色、质地、菌落隆起度、边缘结构、表面形态、光泽度与透明度等,并结合革兰氏染色与芽孢染色,观察菌株个体形态,包括细胞形状与细胞间的排列方式等,对细菌种类进行初步分类,计算不同处理方式(即对照组与复合生物保鲜剂处理组)在不同贮藏时间的同一类菌落个数。挑选菌落数合适(30~300个菌落)的计数平板,随机挑取包含不同种类的50个典型单一菌落,平板划线法反复进行分离纯化3次,得到的纯化菌株保存于试管斜面培养基上,以备鉴定。
1.2.2.2 分类保存 根据菌落特征和形态学特征,首先将两种处理方式在不同贮藏时间挑选出来的菌株依次作好标记,进行分组归类,再将各组菌株进行纯培养,重复以上比较。将菌落特征和形态学特征有差异的重新标记分类,再进行纯培养,重复以上操作3次,分离得到纯菌株,每一种纯菌株作2组平行,记录细菌的形态特征。
1.2.3 单细菌DNA提取与纯化 将经过反复分离纯化,进行初步生理生化鉴定得到的纯菌株接种到TSB中。在37℃,170r/min的摇床中培养17h,取10mL处于对数生长期的细菌培养液,在4℃,10000r/min下离心15min,弃上清,将细菌-20℃保存,用于下一步提取DNA[13]。
采用细菌基因组DNA提取试剂盒提取纯化菌株的DNA,同时增加了溶菌酶破壁,提取出的DNA编号后,置于-20℃冰箱中保存备用。
1.2.4 16S rDNA片段的PCR扩增 以提取的细菌基因组DNA为模板,选用细菌通用引物,正向引物为27f,反向引物为1492r。

表1 冷藏带鱼贮藏期间的细菌特征分析Table 1 Analysis of the properties of bacteria on T.haumela during cold storage
正向引物 27f:5'-GAGAGTTTGATCCTGGC TCAG-3'
反向引物 1492r:5'-CTACGGCTACCTTG TTACGA-3'
PCR扩增采用25.0μL体系,反应条件为2.5μL 10×PCR buffer;2.5μL dNTP(含 Mg2+);0.3μL TaqDNA酶;1.0μL正向引物;1.0μL反向引物;1.0μL DNA模板;16.7μL ddH2O。PCR反应步骤为:a.94℃热启动5min;b.94℃预变性5min;c.94℃变性1min; d.57℃退火 1min;e.72℃ 复性 2min;f.72℃ 延伸10min;重复步骤c、d、e 25次。使用1.0%的琼脂糖凝胶电泳检验PCR扩增产物,产物约为1500bp。采用DNA纯化试剂盒对PCR产物进行纯化,获得的纯化产物送生工生物工程(上海)有限公司测序。
1.2.5 16S rDNA测序结果与生理生化鉴定比对 参照《伯杰手册》[14]和东秀珠、蔡妙英编著的《常见细菌系统鉴定手册》[15]对分类得到的纯菌株进行生理生化鉴定,主要包括:氧化酶、接触酶、淀粉酶、O/F、尿素利用、丙二酸盐利用、明胶液化、H2S实验与糖、醇类发酵实验等。
1.2.6 系统发育树分析 测序得到菌株部分长度的16S rDNA序列(约1460bp),将测序结果登陆NCBI网站(http://www.ncbi.nlm.nih.gov/blast/),通过Blast程序与GenBank中的核酸序列进行比对,从中选出相似性较高的序列,应用Chromas version1.62和DNAMAN version6.0软件进行多重比较后构建系统发育树。
2 结果与讨论
2.1 复合保鲜剂处理后冷藏带鱼细菌总数的变化
参照鲜带鱼[16]与鲜海水鱼[17]国标规定,细菌总数≤4lgCFU/g为一级鲜度,4lgCFU/g<细菌总数≤6lgCFU/g为二级鲜度。由图1可知,在冷藏的第3d与第5d后,对照组冷藏带鱼的细菌总数已先后超过了一级与二级鲜度,在冷藏的第8d后,其细菌总数更达到8.75lgCFU/g,样品已完全腐败。而复合保鲜剂处理组在冷藏初期的细菌总数有所下降,其主要原因在于壳聚糖与溶菌酶本身具有抑菌与杀菌作用,到冷藏的第16d,细菌总数才超过二级鲜度标准。可见,壳聚糖复合保鲜剂涂膜处理能很好的抑制微生物生长繁殖,延缓带鱼的腐败变质。从菌落总数的数值变化程度和趋势来看,符合带鱼在冷藏条件下的腐败发展趋势,分离纯化所选的时间间隔具有代表性。
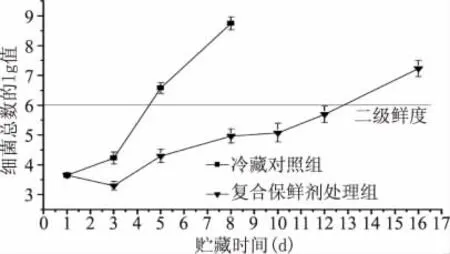
图1 复合保鲜剂对冷藏带鱼贮藏期间细菌总数变化的影响Fig.1 Effect of CBFA on total viable counts of T.haumela during cold storage
2.2 冷藏带鱼的细菌菌落特征
采用稀释平板分离法和划线分离法,经过3次以上的比较分组与归类计数,一共从不同贮藏时间的对照组与复合保鲜剂处理组冷藏带鱼样品中主要分离出13种典型菌,分别命名为X1、X2……X13,其菌落与细菌的基本特征见表1。
2.3 单菌落DNA的提取
对分离得到的13种未知菌株进行单细菌DNA提取,并利用1.0%的琼脂糖凝胶电泳检测,结果发现在23kb左右出现条带,表明已获得较为完整微生物基因组的DNA,图2为13种主要代表性菌株的DNA电泳图谱。
2.4 菌株的16S rDNA基因序列
通过引物27f和1492r对13株活化菌进行16S全长序列的PCR扩增,均得到重复性好且稳定、清晰的特异性条带,片段大小为1500bp左右,电泳图谱结果如图3所示。
2.5 16S rDNA测序结果与生理生化鉴定比对
带鱼冷藏货架期结束时,其菌相趋于简单,贮藏期间的主要优势菌为X1和X2两种,通过对冷藏带鱼贮藏期间6种主要优势菌株进行生理生化鉴定,其各项生理生化指标结果见表2。
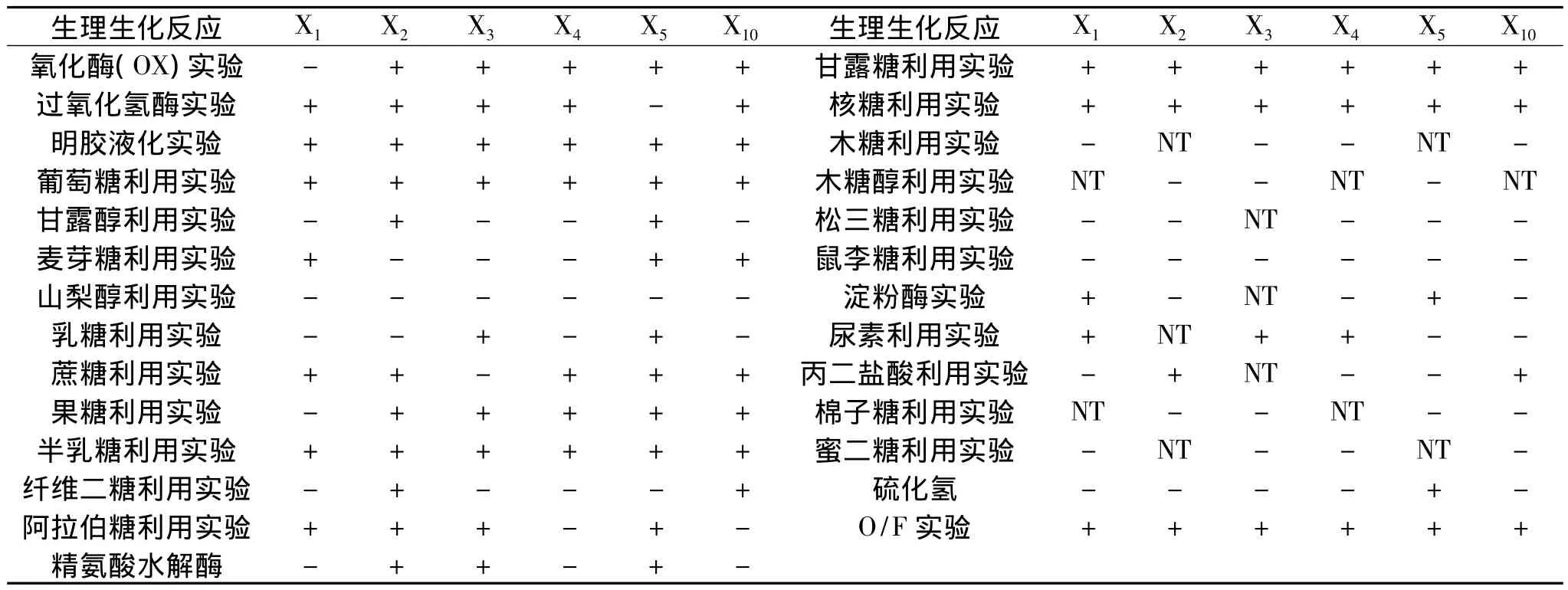
表2 冷藏带鱼贮藏期间主要优势菌的生理生化特征Table 2 The physiology and biological test of T.haumela during cold storage
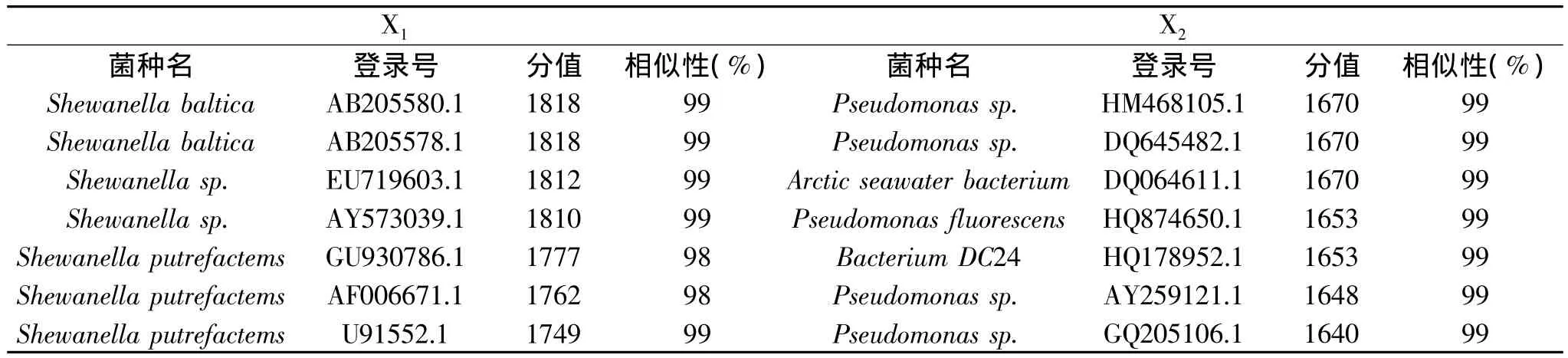
表3 主要优势菌X1与X2同源性较高的菌株分析Table 3 Analysis of high homologies of strains of X1and X2
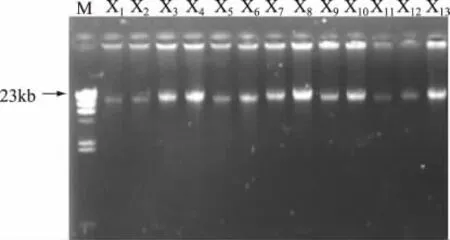
图213 种菌株的DNA电泳图谱Fig.2 Electrophoretic analysis of DNA from thirteen samples

图3 13种菌株的16S rDNA电泳图谱Fig.3 Electrophoretic analysis of PCR amplification products of the 16S rDNA gene fragments from thirteen samples
参照GenBank比对的结果作相应的生理生化实验(表2),并依据主要的生理生化反应和菌落特征,可判断出X1为希瓦氏菌属(Shewanella sp.)中的一种,X2与X3分别为假单胞菌属(Pseudomonas sp.)细菌,X4为嗜冷杆菌属(Psychrobacter sp.)中的一种,X5为气单胞菌属(Aeromonas sp.)中的细菌,X10为葡萄球菌属(Staphylococcus sp.)中的一种,其余7种菌均在PCR扩增测序结果比对的基础上,结合生理生化鉴定加以鉴别得出其各自属种。
2.6 系统发育树分析
将13株分离细菌所获得的16S rDNA序列提交NCBI,获得它们在GenBank数据库中的临时登录号。通过BLAST软件与GenBank中已发表的16S rDNA序列进行同源性比较分析,选取同源性多数在99%以上的7个菌株进行比较,并构建系统发育树,根据亲缘关系远近判断细菌种类。其中,分别对优势菌X1与X2作同源性搜索(见表3),并绘制系统发育树(见图4)。
由图4可见X1与希瓦氏菌(Shewanella sp.)的亲缘关系较近,且 X1与腐败希瓦氏菌(登录号: GU930786.1)在同一分支中,结合生理生化反应可证明X1为腐败希瓦氏菌。X2与假单胞菌属(Pseudomonas sp.)亲缘关系较近,且与荧光假单胞菌(登录号:HQ874650.1)在同一分支中,结合生理生化反应,可证明X2为假单胞菌属中的荧光假单胞菌。对其余11种菌株构建系统进化树并结合生理生化反应结果,可得X3为铜绿假单胞菌(Pseudomonas aeruginosa),X4为嗜冷杆菌(Psychrobacter sp.),X5为嗜水气单胞菌(Aeromonas hydrophila),X6为弧菌(Vibrio rumoiensis),X7为恶臭假单胞菌(Pseudomonas putida),X8为 成 团 肠 杆 菌 (Enterobacter agglomerans),X9为约氏不动杆菌(Acinetobacter johnsonii),X10为葡萄球菌属(Staphylococcus sp.),X11为蜡样芽孢杆菌(Bacillus cereus),X12为绿色气球菌(Aerococcusviridans),X13为金黄色葡萄球菌(Staphyloccocus aureus)。
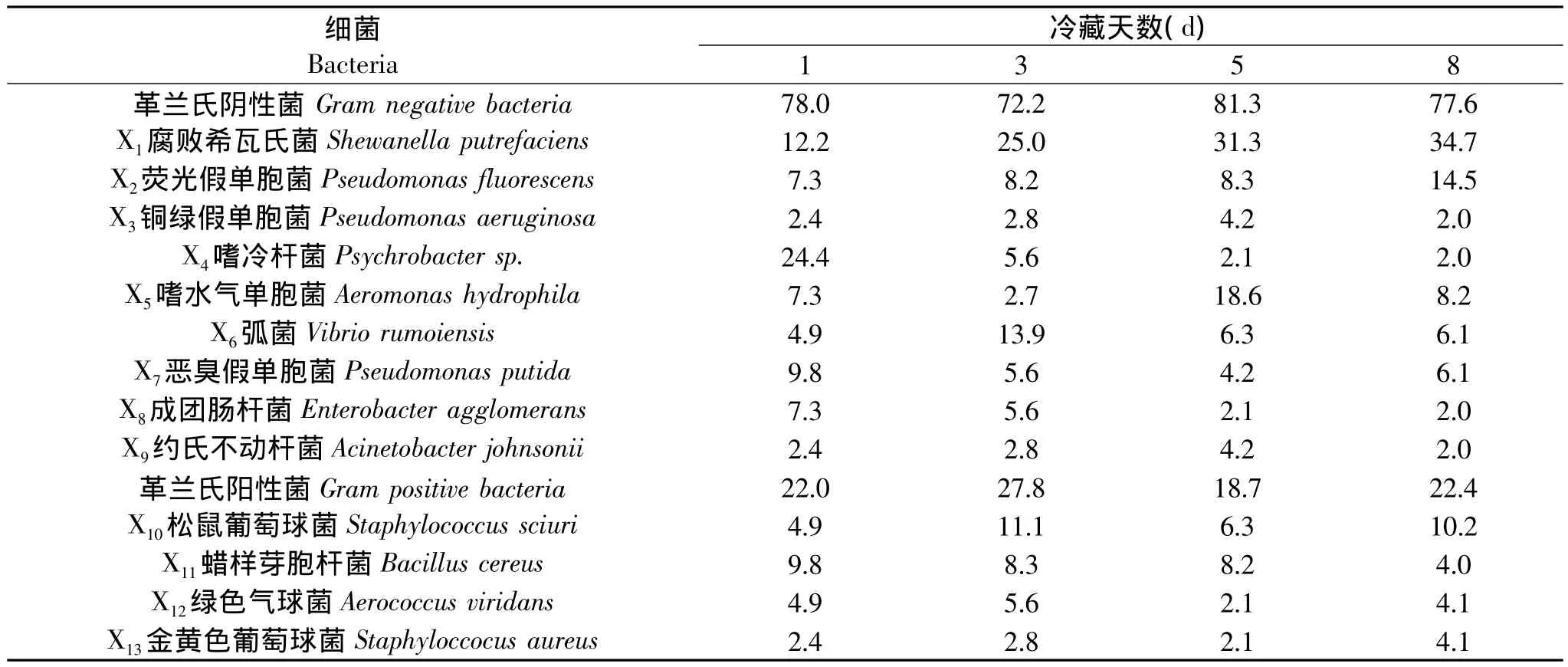
表4 带鱼冷藏过程中细菌的组成比例(%)Table 4 Proportion of bacteria changes and composition of T.haumela during cold storage(%)
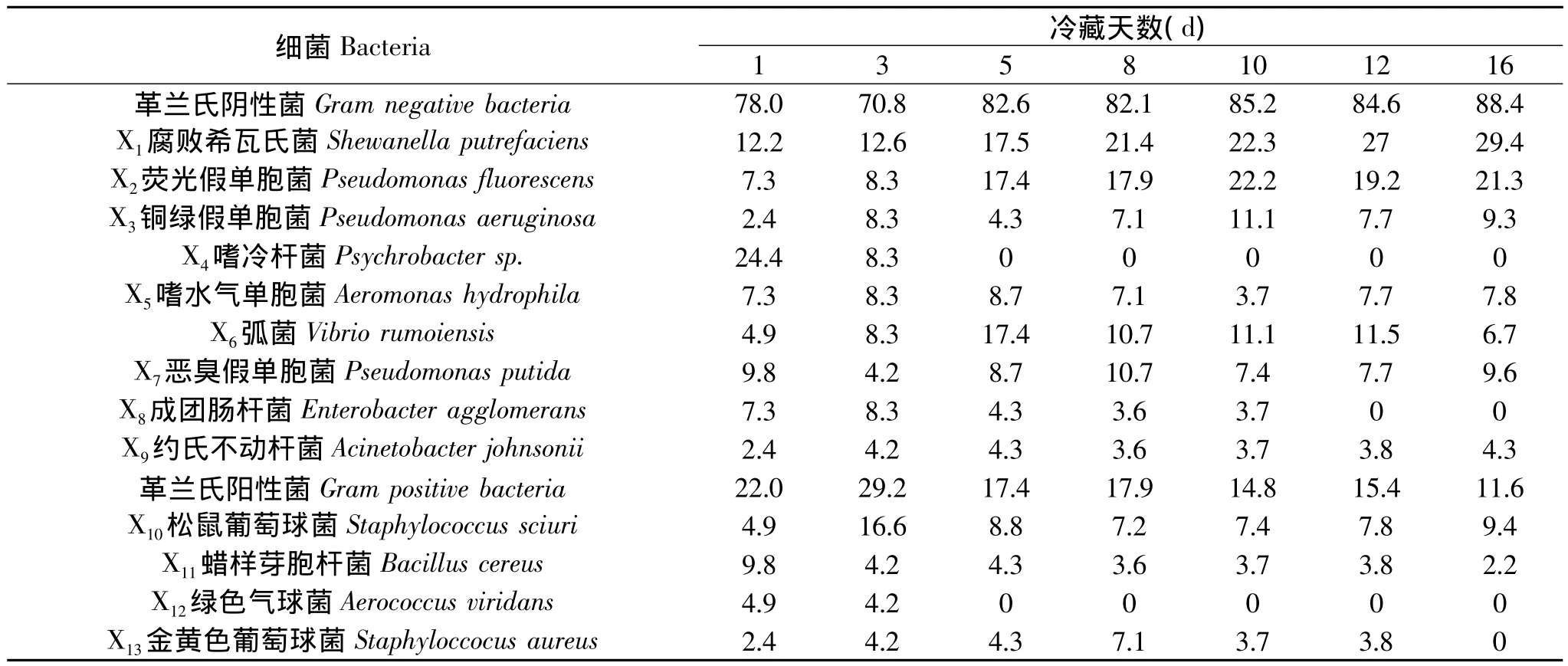
表5 复合保鲜剂处理组带鱼冷藏过程中细菌的组成比例(%)Table 5 Proportion of bacteria changes and composition of T.haumela with CBFA during cold storage(%)

图4 基于16S rDNA序列同源性的X1与X2菌株的系统发育树Fig.4 Phylogenetic tree of the X1and X2strains based on the16S rDNA sequences
2.7 带鱼冷藏过程中的菌相组成及变化情况
根据对13种菌株的PCR扩增测序与生理生化鉴定结果,分别对不同天次冷藏对照组与复合保鲜剂处理组的带鱼样品,经反复分离纯化与比较分类的典型菌株进行计数,计算其各自所占比例,带鱼冷藏过程中细菌组成及其变化情况见表4与表5。
由表4与表5可知,两组带鱼样品在货架期终点时均为革兰氏阴性菌占绝对优势,这一结果与Hubbs[18]的研究一致。与对照组相比,经复合保鲜剂处理后,冷藏带鱼的细菌菌相有明显变化:第一,细菌的种类数量有所减少,随着货架期的结束,复合保鲜剂处理组的主要腐败菌种类由原来的13种减少到9种,其中嗜冷杆菌(Psychrobacter sp.)、绿色气球菌(Aerococcus viridans)在贮藏的第5d未检出,成团肠杆菌(Enterobacter agglomerans)在冷藏的第12d未检出,金黄色葡萄球菌(Staphyloccocus aureus)在冷藏的第14d未检出;第二,革兰氏阴性菌的比例有所增加,在冷藏的第8d,处理组的82.1%高于对照组的77.6%,在冷藏的第16d时增加到88.4%;第三,优势腐败菌种类不变,仍为腐败希瓦氏菌与荧光假单胞菌,但冷藏带鱼经复合保鲜剂处理后,其所占比例明显减少。
3 结论
带鱼冷藏过程中,随着贮藏时间的延长,其细菌种类趋于稳定。基于16S rDNA的分子生物学方法对细菌种类进行鉴定与传统的生理生化反应鉴定方法有较好的一致性。在冷藏货架期结束时,带鱼的主要优势腐败菌为腐败希瓦氏菌(Shewanella putrefaciens)与 荧 光 假 单 胞 菌 (Pseudomonas fluorescens)。腐败希瓦氏菌大量存在于水和土壤中,水产品携带较多,此前也将希瓦氏菌属归类到假单胞菌属,被称为腐败交替假单胞菌。Gill[19-20]等人研究认为假单胞菌属(Pseudomonas sp.)和希瓦氏菌属(Shewanella sp.)是冷链流通中高水分蛋白食品的特定腐败菌SSO(Specific spoilage organisms)。贮藏过程中腐败希瓦氏菌会产生H2S和不良气味,同时导致肉变色、发粘,这可能是带鱼腐败的一个主要原因。荧光假单胞菌(Pseudomonas fluorescens)为假单胞菌科假单胞菌属杆菌,不产芽孢,革兰氏染色呈阴性,其广泛分布于自然界,如土壤、水、植物及动物活动环境中。假单胞菌也是水产动物常见的腐败菌,在带鱼冷藏过程中其数量变化不大,但仍占一定比例,其中冷藏带鱼中的假单胞菌所占比例大小依次为荧光假单胞菌(Pseudomonas fluorescens)>恶臭假单胞菌(Pseudomonas putida)>铜绿假单胞菌(Pseudomonas aeruginosa)。
本研究结合细菌的生理生化反应和16S rDNA序列比对的方法,初步鉴定了带鱼在冷藏过程中的细菌组成,并与对复合保鲜剂处理组的细菌组成比例进行比较,为今后研究复合保鲜剂的抑菌机理指明了方向。
[1]沈月新.水产食品学[M].北京:中国农业出版社,2001:11.
[2]徐丽敏,薛长湖,李兆杰,等.水溶性壳聚糖对南美白对虾品质及腐败菌相变化的影响[J].食品工业科技,2008,29(6): 107-110.
[3]Taoukis P S,Koutsoumanis K,Nychas G J E.Use of time temperature integrators and predictive modeling for shelf life control of chilled fish under dynamic storage conditions[J]. International Journal of Food Microbiology,1999,53:21-31.
[4]杨宪时,许钟,肖琳琳.水产食品特定腐败菌与货架期的预测和延长[J].水产学报,2004,28(1):106-111.
[5]Surendran P K,Jose J,Shenoy A V,et a1.Studies on spoilage of commercially important tropical fishes under iced storage[J]. Fish Resources,1989(7):l-9.
[6]Gram L,Huss H H.Microbiological spoilage of fish and fish product[J].International Journal of Food Microbiology,1996,33: 121-137.
[7]Gillespie N C,Maerae I C.The bacterial flora of some Queensland fish and its ability to cause spoilage[J].Journal of Applied Microbiology,1975,39:91-100.
[8]裘迪红,杨文鸽,薛长湖.梭子蟹腐败菌菌相的初步分析[J].食品科技,2005(8):33-35.
[9]刘寿春,周康,钟赛义,等.淡水养殖罗非鱼中病原菌和腐败菌的分离与鉴定初探[J].食品科学,2008,29(5):327-331.[10]郭全友,杨宪时,许钟.冷藏罗非鱼优势腐败菌的鉴定及其特征[J].食品与机械,2009,25(3):87-90.
[11]杨宪时,郭全有,许钟.罗非鱼冷藏过程细菌种群的变化[J].中国水产科学,2008,15(6):1050-1055.
[12]GBT 4789.2-2008,食品卫生微生物学检验—菌落总数测定[S].
[13]Miambi E,Guyot J P,Ampo F.Identification,isolation and quantification of representative bacteria from fermented cassava dough using an integrated approach of culture-dependent and culture-independent methods[J].International Journal of Food Microbiology,2003,82:111-120.
[14]希坎南R E.伯杰氏细菌鉴定手册[M].北京:科学出版社,1989.
[15]东秀珠,蔡妙英,王宝玲,等.常见的细菌鉴定手册[M].第一版.北京:科学出版社,2001.
[16]SC128-84,中华人民共和国农牧渔业部部标准——鲜带鱼[S].
[17]GB/T 18108-2008,中华人民共和国国家标准——鲜海水鱼[S].
[18]Hubbs.Fish:microbiological spoilage and safety[J].Food Science Technology Today,1991(5):166-173.
[19]Spanggaard B,Huber I,Nielsen J.The microflora of rainbow troutintestine:a comparison oftraditionaland molecular identification[J].Aquaculture,2000,182:1-15.
[20]Gill co,Badoni M,Jones T.Hygienic effects of trimming and washing operations in a beef carcass dressing process[J].Journal of Food Protection,1996,59:666-669.
Effect of complex biological fresh-keeping agents for the main bacteria composition on cutlassfish Trichiurus haumela under the cold storage by PCR and physiology-biochemistry technology
LAN Wei-qing,XIE Jing*
(College of Food Science and Technology,Shanghai Ocean University,Shanghai Engineering Research Center of Aqhatic-product Processing&Preservation,Shanghai 201306,China)
Microbial physiology-biochemistry technology in traditional method combined with PCR technology were used to study the effect of Complex Biological Fresh-keeping Agents(CBFA)on Trichiurus haumela.After the separation and purification of pre-dominate spoilage bacteria on Trichiurus haumela used by CBFA under the cold storage,16S rDNA sequence analysis,morphological and biochemical tests were used to identify the composition of spoilage microflora,and phylogenetic tree were analyzed.The result showed that there were mainly 13 typical bacterial strains of the controlled,and their proportions at the end of shelf life in control groups were:Shewanella putrefaciens 34.7%,Pseudomonas fluorescens 14.5%,Staphylococcus sciuri 10.2%,Aeromonas hydrophila 8.2%,Vibrio rumoiensis 6.1%,Pseudomonas putida 6.1%,Aerococcus viridans 4.1%,Staphyloccocus aureus 4.1%,Bacillus cereus 4.0%,Pseudomonas aeruginosa 2.0%,Psychrobacter sp.2.0% Enterobacter agglomerans 2.0% and Acinetobacter johnsonii 2.0%respectively.Among them,Shewanella putrefaciens(34.7%)was the Specific Spoilage Organism(SSO),the proportion of Pseudomonas sp.in descending order was Pseudomonas fluorescens>Pseudomonas putida>Pseudomonas aeruginosa.It was found that the dominant spoilage bacteria of Trichiurus haumela was extended 9d by CBFA,the spoilage microflora was also changed,and the species of bacteria decreased to 9 strains.CBFA showed different inhibitory activity on different spoilage bacteria.
Trichiurus haumela;complex biological fresh-keeping agents(CBFA);polymerase chain reaction (PCR);physiology-biochemistry technology;microflora changes
TS254.4
A
1002-0306(2012)10-0330-06
2011-07-01 *通讯联系人
蓝蔚青(1977-),男,工学博士,助理研究员,研究方向:食品冷冻冷藏工程。
“十二五”国家支撑计划项目(2012BAD38B09);上海市科委工程中心建设(11DZ2280300);上海海洋大学博士启动基金(A-2400-11-0202);上海市教育委员会重点学科建设项目资助(J50704)。

