法舒地尔对高糖培养的肾小管上皮细胞转分化的抑制作用
倪连松,高 倩,顾玲佳
(温州医学院附属第一医院内分泌科,浙江温州 325000)
法舒地尔是最早发现的Rho相关卷曲螺旋形成的蛋白丝氨酸/苏氨酸激酶(Rho-associated coiledcoil forming protein serine/threonine kinase,ROCK)选择性抑制剂之一[1]。已有研究表明,在糖尿病动物模型中法舒地尔可以减少尿蛋白、肾小球系膜外基质堆积以及减轻肾小球硬化[2-5]。近年来,越来越多的证据表明,糖尿病时肾小管间质病变的严重程度与蛋白尿排泄量和肾功能的进行性下降密切相关[6],然而法舒地尔对糖尿病性肾小管间质病变的保护作用尚未见报道。Rho家族蛋白是Ras超家族中小分子G蛋白的成员之一,具有GTP酶活性,故又称Rho GTP酶,其中对Rho A,Rac1和Cdc42研究得最为广泛。Rho A分子存在着与GTP结合激活态和与GDP结合失活态两种,在两种形式相互转换过程中转导信号,行使其生理功能。ROCK又称Rho激酶,是Rho A下游的主要效应因子。近来人们发现,肾中Rho A/ROCK信号通路具有重要的功能,Rho A/ROCK介导了肾小管细胞、系膜细胞及足细胞的细胞支架的重构;促成了上皮细胞间质转分化,因而在肾纤维化中起着重要的作用[7]。细胞在某些生理或病理情况下发生细胞形态、结构和功能的改变称为细胞表型转化,其中上皮细胞在某些条件下转分化为肌成纤维细胞的现象称为上皮细胞肌成纤维细胞转分化(epithelial-myofibroblast transition,EMT)[8],表现为丢失上皮细胞标志物上皮钙黏素[9],以及表达肌成纤维细胞标志物α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)。已有研究显示,糖尿病性肾病时肾小管上皮细胞可发生转分化,并且该转分化过程在糖尿病性肾病的发生发展中起重要作用[10],寻找新的干预措施逆转该转分化过程将是治疗糖尿病性肾病的新策略。
为进一步探究法舒地尔对糖尿病性肾病的保护作用机制,根据前期实验结果,选择在安全浓度范围内的最大浓度20μmol·L-1作为法舒地尔的实验浓度,探讨其对高糖培养肾小管上皮细胞转分化影响,同时检测其对转化生长因子β1(transforming growth factor,TGF-β1)的影响,以探讨其作用机制并为其进一步的临床应用提供理论依据。
1 材料与方法
1.1 细胞、试剂及仪器
人肾小管上皮细胞(HK-2)购自武汉大学中国典型培养物保藏中心,CCTCC编号:GDC152。法舒地尔购自天津红日药业股份有限公司产品,批号:091114。DMEM培养液和胎牛血清为Gibco公司产品。Rho A配体结合沉淀试剂盒购自Millipore公司。鼠抗人Rho A一抗,鼠抗人上皮钙黏素一抗和鼠抗人α-SMA购自Sant Cruz公司,FITC标记羊抗鼠IgG抗体购自联科生物公司。HRP标记羊抗鼠IgG抗体和碘化丙啶(propidium iodide,PI)购于碧云天公司。激光共聚焦仪器为Olympus公司,酶标仪为Thermo公司,Imaglab凝胶成像系统为Bio-Rad公司,ELISA试剂盒购自上海西唐公司。
1.2 HK-2细胞培养及分组处理
HK-2细胞常规培养在含10%胎牛血清和葡萄糖5.5 mmol·L-1的 DMEM 培养液中,置 37℃、5%CO2孵箱中培养,2~3 d换液1次。细胞依次分别加入葡萄糖 5.5 mmol·L-1、葡萄糖 5.5 mmol·L-1+甘露醇 54.5 mmol·L-1、葡萄糖 60 mmol·L-1及葡萄糖 60 mmol·L-1+ 法舒地尔 20 μmol·L-1。
1.3 配体结合沉淀法检测Rho A活性
HK-2细胞接种在10 cm细胞培养皿中,细胞培养贴壁生长至100%融合后,无血清培养液静止培养24 h后用葡萄糖60 mmol·L-1的高糖培养液干预,分别于0,0.5,1,3,7,12 和24 h收集细胞,裂解细胞后,收集的细胞,于4℃时,17949×g离心30 min,取50μl上清用于Total-RhoA检测,余上清加入10μl Rhotekin Rho结合域琼脂糖 (Rhotekin Rho binding domain agarose,Rhotekin RBD-agarose),4℃振摇过夜以沉淀GTP-Rho A,变性后取50μl样本行12%SDS-PAGE电泳,Western印迹法检测 GTPRhoA的表达,同时取50μl总蛋白样品检测总Rho A的表达。Imagelab软件分析结果,以所测得的各条带的积分吸光度(integrated absorbance,IA)与相应总Rho A的IA比值作为Rho A活性值。
1.4 免疫荧光细胞化学技术检测上皮钙黏素表达
收集培养72 h的各分组细胞爬片,4%多聚甲醛溶液固定和0.1%TritonX-100溶液穿孔细胞后用10%正常羊血清37℃封闭1 h,滴加上皮钙黏素一抗(1∶100),4℃孵育过夜,次日清洗后滴加FITC标记的二抗(1∶200)避光37℃孵育30 min,后行PI染色30 min,清洗后用抗荧光淬灭封片剂封片,立即用激光共聚焦显微镜观察并拍片,每组随机选3个视野用图像分析软件进行分析,IA与视野总面积的比值表示上皮钙黏素表达量。
1.5 Western印迹法检测α-SMA的表达
1.5.1 细胞培养及分组
HK-2细胞接种于10 cm细胞培养皿中,细胞培养贴壁生长至70%融合后,更换为无血清培养液静止24 h,按实验分组换为不同的培养液,分别于72 h提取细胞蛋白。
1.5.2 细胞总蛋白提取与定量
收集细胞后,冰上裂解细胞30 min,收集裂解液5 min,4℃,17 949×g离心后收集上清用BCA蛋白浓度测定法测定蛋白浓度,操作按说明书。5×上样缓冲液变性蛋白后-20℃保存。
1.5.3 细胞内α-SMA蛋白量的检测
取60μg总蛋白上样,用10%浓度的SDS-PAGE胶进行电泳。恒流将蛋白转至PVDF膜,5%脱脂奶粉室温摇床封闭2 h,分别加入 α-SMA(1∶200),GAPDH(1∶1000)一抗,4℃过夜。清洗后分别加入相应的HRP标记的Ig G(1∶1000)二抗,室温摇床孵育1 h,洗膜后分别取等量ECL试剂盒溶液A和B液混合后加于PVDF膜,避光反应1 min,Molecular Imager ChemiDocTMXRS和成像系统自动曝光扫描并用Imagelab软件分析结果,以所测得的各条带的A与内参照GAPDH A的比值作为α-SMA的半定量值。
1.6 ELISA法检测细胞培养上清TGF-β1含量
收集培养24 h和48 h细胞上清液4℃,4142×g离心3 min后ELISA法检测TGF-β1,具体操作按试剂盒说明书。收集细胞冰上裂解后离心,收集上清用BCA蛋白浓度测定法测定蛋白浓度,操作按说明书,以矫正ELISA结果。
1.7 统计学分析
2 结果
2.1 高糖对HK-2细胞Rho A活性的影响
图1结果显示,与未刺激前(0 min)比较,高糖60 mmol·L-1培养3 ~24 h后 HK-2 细胞 Rho A 活性明显升高,差异有统计学意义(P<0.01),其中3 h为最高,是为刺激前的4.5倍,提示在一定时间范围内,高糖可以刺激HK-2细胞Rho A分子活化。
2.2 法舒地尔对高糖培养HK-2细胞上皮钙黏素表达的影响
如表1和图2结果显示,与正常对照组比较,高糖60 mmol·L-1培养72 h后HK-2细胞内上皮钙黏素蛋白表达明显减少(P<0.01),高张组区别不具统计学意义,提示高糖可成功诱导HK-2细胞表型转换,高张并不能引起HK-2细胞表型转换。与高糖组比较,法舒地尔20μmol·L-1同步干预72 h后上皮钙黏素蛋白表达量增多,但仍低于正常对照组,提示法舒地尔20μmol·L-1不能完全抑制高糖诱导的HK-2细胞转分化。
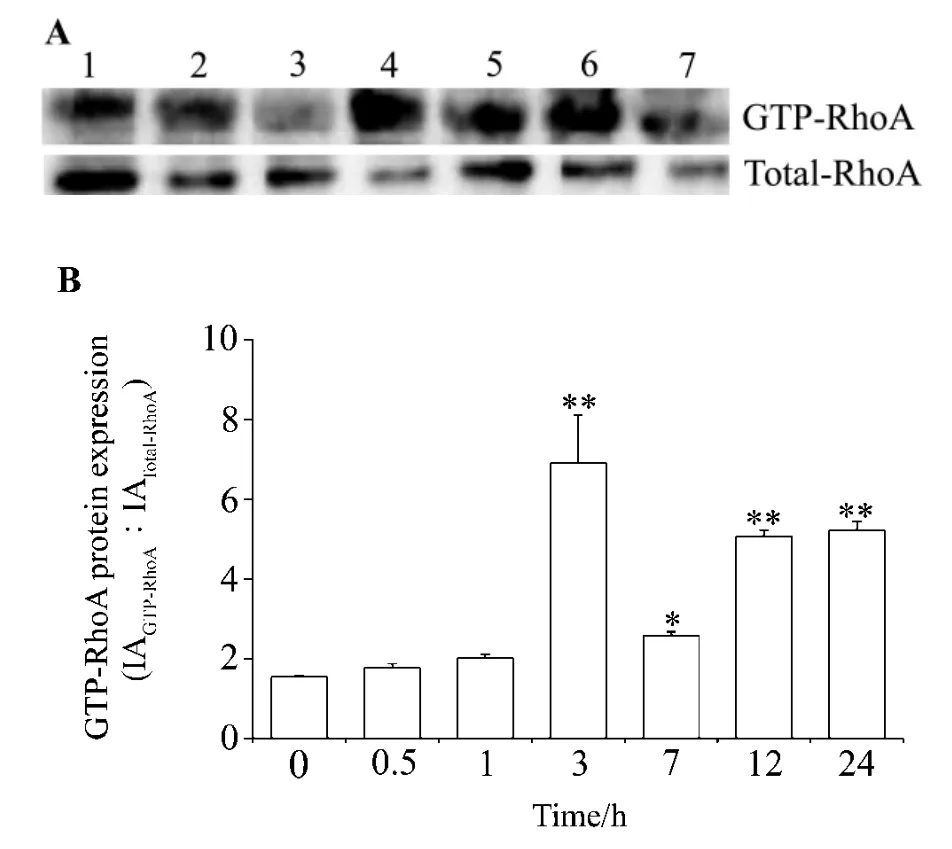
Fig.1 Effect of high glucose on Rho A activity of HK-2 cells.B was the semiquantitative result of A.Lanes 1-7 were HK-2 cells cultivated with glucose60 mmol·L-1 for 0,0.5,1 ,3 ,7 ,12 and 24 h,respectively.±s,n=3.*P<0.05,**P<0.01,compared with 0 min group.
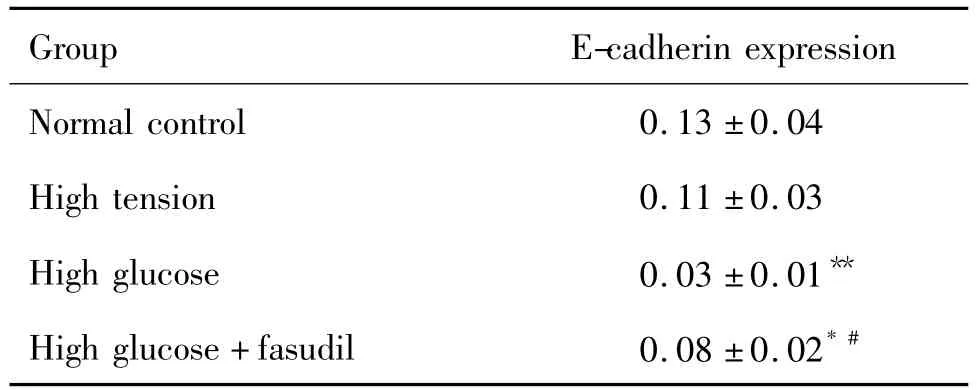
Tab.1 Effect of fasudil on E-cadherin expression of HK-2 cells cultivated in high glucose
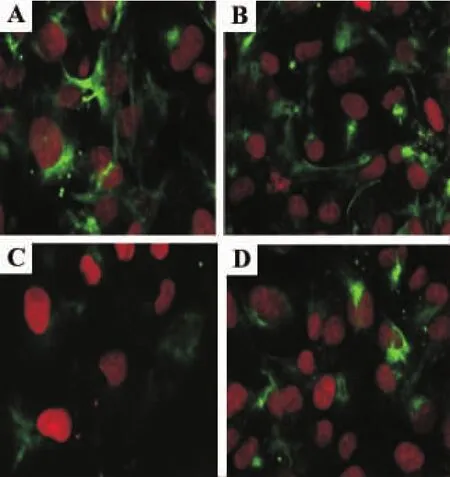
Fig.2 Effect of fasudil on E-cadherin expression of HK-2 cells cultivated in high glucose detected by confocal laser scanning microscopy(PI×400).See Tab 1 for the treatment.A:normal control group;B:high tension group;C:high glucose group;D:high glucose+fasudil group.
2.3 法舒地尔对高糖培养HK-2细胞α-SMA表达的影响
如图3结果显示,与正常对照组比较,高糖60 mmol·L-1培养HK-2 细胞72 h 后,细胞 α-SMA 蛋白表达量明显增加,差异有统计学意义(P<0.01),高张组差异不具有统计学意义,提示是高糖可以诱导HK-2细胞向肌成纤维细胞转化,而高张培养不能诱导其转化。与高糖组比较,法舒地尔20μmol·L-1同步干预72 h后HK-2细胞α-SMA表达量明显减少,差异具有统计学意义(P<0.05),提示高糖诱导HK-2细胞向肌成纤维细胞转化作用能被法舒地尔抑制。
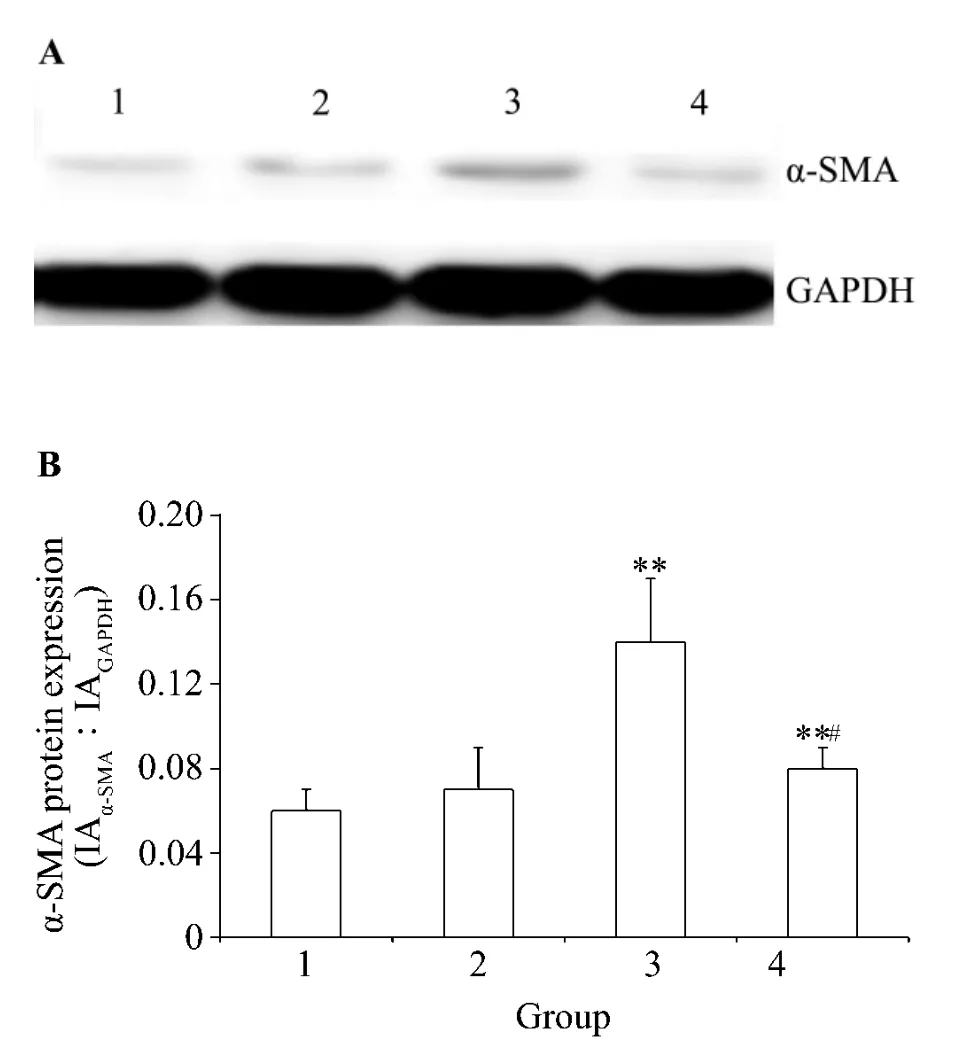
Fig.3 Effect of fasudil on α-smooth muscle actin(α-SMA)expression of HK-2 cells cultivated in high glucose detected by Western blotting.See Tab.1 for the treatment.B was the semiquantitative result of A.1-4 were normal control group,high tension group,high glucose group and high glucose+fasudil group,respectively.±s,n=3.**P<0.01,compared with normal control group;#P <0.05,compared with high glucose group.
2.4 法舒地尔对高糖培养HK-2细胞TGF-β1分泌的影响
表2结果显示,与正常对照组比较,高糖60 mmol·L-1培养24或48 h可增加HK-2细胞上清液中TGF-β1的合成,且随着时间的延长而增加(P <0.01)。法舒地尔20 μmol·L-1同步干预24 或48 h后,对高糖刺激HK-2细胞TGF-β1的合成作用具有明显抑制作用,但法舒地尔同步干预24 h不能完全抑制高糖的刺激作用。

Tab.2 Effect of fasudil on transforming growth factor-β1(TGF-β1)secretion of HK-2 cells cultivated in high glucose
3 讨论
本实验发现,HK-2细胞在高糖60 mmol·L-1条件下培养72 h后,上皮钙黏素表达下降,α-SMA表达升高,发生EMT,与 Zhou等[11]的研究结果一致。本实验首次发现高糖60 mmol·L-1能激活HK-2细胞Rho A活性,表现为GTP-Rho A与总Rho A的比值增加,进一步补充了Massey等[12]关于糖尿病实验动物肾皮质存在Rho A的活化的研究结果,为研究法舒地尔对高糖培养的肾小管上皮细胞转分化的作用提供了理论依据。
本研究结果发现,高糖 60 mmol·L-1诱导的HK-2细胞转分化,能部分被法舒地尔抑制,表现为经法舒地尔同步干预后,细胞上皮钙黏素表达增加,α-SMA表达下降,证实了法舒地尔对糖尿病性肾小管间质病变的保护作用,也进一步阐明了法舒地尔的糖尿病性肾病保护作用机制,但是本研究还发现,法舒地尔不能完全抑制EMT,法舒地尔干预组与正常糖浓度培养组表型标志物表达量存在的差异具有统计学意义,提示高糖可能还通过Rho A/ROCK通路以外的信号通路诱导EMT。Lee等[13]就曾报道PI3K/Akt在高糖诱导的肾小管上皮细胞EMT中起重要作用。
TGF-β1是公认致纤维化的细胞因子,在糖尿病性肾病的发生和发展中起重要作用。有研究显示TGF-β1可以导致肾小管上皮细胞发生 EMT[14]。本研究显示HK-2细胞在高糖60 mmol·L-1培养条件下培养24和48 h,HK-2细胞上清液中TGF-β1明显增多,且随着刺激时间的延长而增多,因此高糖刺激HK-2细胞发生EMT可能与TGF-β1介导有关。本研究发现,经法舒地尔同步干预后,HK-2细胞上清中的TGF-β1明显减少,表明法舒地尔抑制肾小管上皮转分化可能部分是通过抑制TGF-β1的产生而介导的。法舒地尔对正常糖浓度培养的HK-2细胞TGF-β1分泌的影响尚有待研究。
总之,本研究结果显示,高糖能诱导培养HK-2细胞发生EMT,并能激活Rho A分子;Rho A/ROCK通路抑制剂法舒地尔能明显抑制该转分化过程;法舒地尔抑制肾小管上皮转分化的作用可能部分是通过抑制TGF-β1生成而介导的。
[1]Liao JK,Seto M,Noma K.Rho kinase(ROCK)inhibitors[J].J Cardiovasc Pharmacol,2007,50(1):17-24.
[2]Gojo A,Utsunomiya K,Taniguchi K,Yokota T,Ishizawa S,Kanazawa Y,et al.The Rho-kinase inhibitor,fasudil,attenuates diabetic nephropathy in streptozotocin-induced diabetic rats[J].Eur J Pharmacol,2007,568(1-3):242-247.
[3]Peng F,Wu D,Gao B,Ingram AJ,Zhang B,Chorneyko K,et al.RhoA/Rho-kinase contribute to the pathogenesis of diabetic renal disease[J].Diabetes,2008,57(6):1683-1692.
[4]Kikuchi Y, Yamada M, Imakiire T, Kushiyama T,Higashi K,Hyodo N,et al.A Rho-kinase inhibitor,fasudil,prevents development of diabetes and nephropathy in insulin-resistant diabetic rats[J].J Endocrinol,2007,192(3):595-603.
[5]Kolavennu V,Zeng L,Peng H,Wang Y,Danesh FR.Targeting of RhoA/ROCK signaling ameliorates progression of diabetic nephropathy independent of glucose control[J].Diabetes,2008,57(3):714-723.
[6]Gilbert RE,Cooper ME.The tubulointerstitium in progressive diabetic kidney disease:more than an aftermath of glomerular injury[J]?Kidney Int,1999,56(5):1627-1637.
[7]Hayashi K,Wakino S,Kanda T,Homma K,Sugano N,Saruta T.Molecular mechanisms and therapeutic strategies of chronic renal injury:role of rho-kinase in the development of renal injury[J].J Pharmacol Sci,2006,100(1):29-33.
[8]Yang J,Liu Y.Blockage of tubular epithelial to myofibroblast transition by hepatocyte growth factor prevents renal interstitial fibrosis[J].J Am Soc Nephrol,2002,13(1):96-107.
[9]Cheng HX,Yang XP,Zhao J.E-cadherin and renal interstitial fibrosis[J].J Clin Exp Med(临床和实验医学杂志),2010,15(9):1184-1187.
[10]Li J,Qu X,Bertram JF.Endothelial-myofibroblast transition contributes to the early development of diabetic renal interstitial fibrosis in streptozotocin-induced diabetic mice[J].Am J Pathol,2009,175(4):1380-1388.
[11]Zhou L,Xue H,Yuan P,Ni J,Yu C,Huang Y,et al.Angiotensin AT1 receptor activation mediates high glucose-induced epithelial-mesenchymal transition in renal proximal tubular cells[J].Clin Exp Pharmacol Physiol,2010,37(9):e152-e157.
[12]Massey AR, Miao L, Smith BN, Liu J,Kusaka I,Zhang JH,et al.Increased RhoA translocation in renal cortex of diabetic rats[J].Life Sci,2003,72(26):2943-2952.
[13]Lee YJ,Han HJ.Troglitazone ameliorates high glucoseinduced EMT and dysfunction of SGLTs through PI3K/Akt,GSK-3β,Snail1,and β-catenin in renal proximal tubule cells[J].Am J Physiol Renal Physiol,2010,298(5):1263-1275.
[14]Lan HY.Tubular epithelial-myofibroblast transdifferentiation mechanisms in proximal tubule cells[J].Curr Opin Nephrol Hypertens,2003,12(1):25-29.

