地西他滨联合丙戊酸增强HL-60细胞hPer3基因的表达
李翊卫,王晔恺,周吉航,周世权,曾 芳,刘晓光
(舟山医院1.检验科,2.细胞分子生物学实验室,浙江舟山 316004)
地西他滨(decitabine,DCA)主要用于治疗中高危骨髓增生异常综合征(myelodysplastic syndromes,MDS)。前期研究发现急性髓系白血病(acute myeloid leukemia,AML)患者疾病进程和时钟基因human period3(hPer3)的表达及启动子甲基化程度存在相关性,体外AML细胞株HL-60中利用DCA恢复了hPer3的部分表达并减弱了其启动子的高甲基化程度[1]。
在国外临床试验中,DCA对原发性AML的疗效不佳,单用效果往往不如与某些组蛋白去乙酰化酶抑制剂药物如丙戊酸(valproic acid,VPA)等联合使用[2]。因此,通过观察DCA和VPA联用对原发性AML细胞株HL-60中hPer3基因的表达调控,初步探讨DCA和VPA联用治疗原发性AML的可能机制。
1 材料与方法
1.1 药品、试剂和仪器
对苯二酚、亚硫酸氢钠、氯仿和氢氧化钠购自上海晶纯试剂有限公司,注射用地西他滨购自西安杨森制药有限公司,注射用丙戊酸钠购自赛诺菲-安万特公司,FITC标记的膜联蛋白-碘化丙啶(FITC-AnnexinⅤ/PI)凋亡试剂盒和CD14-FITC均购自美国BD公司,DNA提取纯化试剂盒和普通PCR扩增试剂盒购自美国Promega公司,DNA标志物购自广州东盛生物科技有限公司,Trizol购自美国Invitrogen公司,CpG甲基转移酶(CpG methyltransferase,M.SssI)购自北京New England Biolabs(NEB)有限公司,pMD18载体试剂盒和荧光定量PCR试剂盒(Syber GreenⅠ)购自大连TaKaRa生物工程有限公司,MTT试剂盒、小牛血清和1640培养液购自碧云天生物技术研究所。MS-PCR引物:甲基化甲基化条带引物:MSF-S:5'-CGGGAGTTTTGGGTATTCGC-3',MSF-A:5'-CGACCCGACTAACTAAAACG-3',甲基化产物 182 bp;非甲基化条带引物:USF-S:5'-TGGGTGGTTGGGTGGGAGTTTTGGGTATTTGT-3',USF-A:5'-AATCCAA-CACCAACAACCCAACTAACTAAAACA-3',非 甲 基 化产物207 bp;荧光定量 PCR引物:hPer3-S:5'-ACAAACAGAACCACAAGGCA-3',hPer3-A:5'-CGTCCATTTGTTGGCATTT-3',扩增产物94 bp;GAPDH-S:5'-GACCTGACCTGCCGTCTA-3',GAPDH-A:5'-AGGAGTGGGTGTCGCTGT-3',扩增产物148 bp;均由上海生工生物工程公司合成。凝胶成像系统为美国Bio-Rad公司Universal HoodⅡ型,凝胶成像分析软件为美国Bio-Rad公司Quantity One,普通PCR仪为Roche Mycycle,荧光 PCR 仪为 Roche Lightcycle,CO2培养箱为德国Jouan IG150,酶标仪为美国Bio-Rad公司680型,流式细胞仪为美国BD FACSCalibur,获取软件为 CellQuest,冰冻离心机为 Eppendorf 5714R,荧光显微镜为日本Olympus BX51。
1.2 生物信息学分析
从MethDB数据库中选取hPer3启动子中富含CpG岛的-465~-269位点区域利用ABI MethPrimer软件设计甲基化引物:MSF-S:(-453~-444),MSF-A:(-281~-301);非甲基化引物:USF-S:(-465~ -444),USF-A:(-269~ -301)。
1.3 细胞培养及药物处理
AML细胞株HL-60购自中科院上海细胞库。用含10%小牛血清的RPMI 1640培养液在37℃、5%CO2的培养箱中培养,取对数期细胞备用。配制密度为1×108L-1的细胞悬液接种于6孔培养板,每孔2 ml,置于37℃,5%CO2和饱和湿度的培养箱中培养过夜,按照分组分别加入终浓度为 DCA 1.0 和 4.0 μmol·L-1,VPA 2.0 mmol·L-1,DCA 1.0 μmol·L-1+VPA 2.0 mmol·L-1,DCA 4.0 μmol·L-1+VPA 2.0 mmo·L-1,每组设 6 复孔,作用48 h后各孔吸出培养液,PBS洗1次,吸弃PBS后进行实验。
1.4 MTT法检测细胞存活
1.3中细胞加培养液180μl,实验终止前加20 μl MTT 5 g·L-1,继续培养4h;控干液体,每孔加150 μl DMSO,96孔震荡板低速混匀10 min。酶标仪选择波长490 nm,测定各组各孔吸光度(A)值。生长抑制率(inhibitory rate,IR)(%)=(1 - A实验组/A对照组)×100%。另取细胞沉淀涂片,在倒置荧光显微镜下观察各实验组细胞的变化。
1.5 FITC-AnnexinⅤ/PI标记法观察细胞凋亡
1.3步骤中细胞用预冷PBS洗涤弃上清,残渣细胞收集至流式管。每管加5μl AnnexinⅤ-FITC和10 μl PI,避光静置 15 min,加 300 μl预冷的PBS,振荡混匀上机检测其早期凋亡率。
1.6 实时荧光定量PCR检测hPer3 mRNA表达
用Trizol提取细胞总RNA,鉴定完整性和纯度,取5μg总RNA冰上逆转录成cDNA进行逆转录PCR,反应体系 25 μl:其中 DNA 模板 2 μl,10 μmol·L-1的hPer3或GAPDH荧光定量PCR引物各1μl,5×PCR缓冲液5μl,加去RNA酶水补至25μl,反应条件:95℃ 10 min;95℃ 20 s,60℃ 30 s,72℃ 30 s,30 循环;72℃ 10 min。PCR反应产物经纯化后,加入5μl连接缓冲液、4.5 μl纯化的目的片段、pMD18-T 载体0.5 μl,低速离心后于16℃连接过夜,将连接液转化大肠杆菌DH5α后涂氨苄西林平板,挑取单菌落培养过夜,抽提其质粒通过PCR鉴定阳性重组子,送上海生工公司测序确证。将重组质粒倍比梯度稀释做为标准品,而样本cDNA用Syber GreenⅠ荧光染料嵌合法进行检测,反应体系参照试剂说明书,反应条件:95℃ 5 min;94℃30 s,60℃ 30 s,72℃ 30 循环;72℃ 10 min,利用各自的标准曲线分别对样品中的目的基因和内参基因进行定量,以hPer3基因拷贝数与GAPDH基因拷贝数比值表示细胞中hPer3 mRNA的相对表达量。
1.7 MS-PCR检测hPer3基因启动子甲基化
采用苯酚氯仿法抽提白血病细胞株基因组DNA,采用紫外分光光度计测量测定吸光度,确定其纯度。吸取4μl基因组DNA至40μl去离子水中,加10 μl氢氧化钠3 mol·L-1,37℃孵育20 min,加入30 μl的对苯二酚 10 mmol·L-1和 520 μl亚硫酸氢钠 1.5 mol·L-1,50℃孵育16 h,应用 DNA 纯化试剂盒纯化回收,加入 50 μl氢氧化钠1 mol·L-1,室温放置5 min终止修饰,无水乙醇沉淀离心回收,室温干燥后加入20μl去RNA酶水重悬,-20℃保存备用。
以ddH2O为空白对照,用经M.SssⅠ处理后的基因组 DNA为阳性对照。反应体系25μl,其中DNA模板2μl,甲基化或非甲基化正反向引物10 μmol·L-1各1 μl,5 × PCR 缓冲液 5 μl,加去离子水补至 25μl。95℃预变性 15 min;94℃ 50 s,56℃ 40 s,72℃ 60 s,35 个循环;72℃ 5 min,完成扩增反应,产物用2%琼脂糖电泳,凝胶成像仪紫外下观察结果。完全和部分甲基化判定为甲基化阳性,无甲基化为甲基化阴性。
1.8 流式细胞仪检测CD14表达
1.3步骤中细胞用预冷PBS洗涤弃上清,残渣细胞收集至流式管。加10μl CD14,放置15 min孵育后PBS洗涤去除未结合荧光抗体,上机检测CD14阳性率。CD14阳性率(%)=CD14阳性细胞数/总细胞数×100%。
1.9 统计学分析
2 结果
2.1 地西他滨联合丙戊酸对HL-60细胞存活的影响
表 1 结果显示,VPA 2.0 mmol·L-1+DCA 1.0 mmol·L-1联合用药组生长抑制率高于 DCA 1.0 μmol·L-1组和 VPA 2.0 mmol·L-1组,差异具有显著统计学意义(P <0.01);VPA 2.0+DCA 4.0 联合用药组生长抑制率高于 DCA 4.0 μmol·L-1组和 VPA 2.0 mmol·L-1组,差异具有显著统计学意义(P <0.01)。
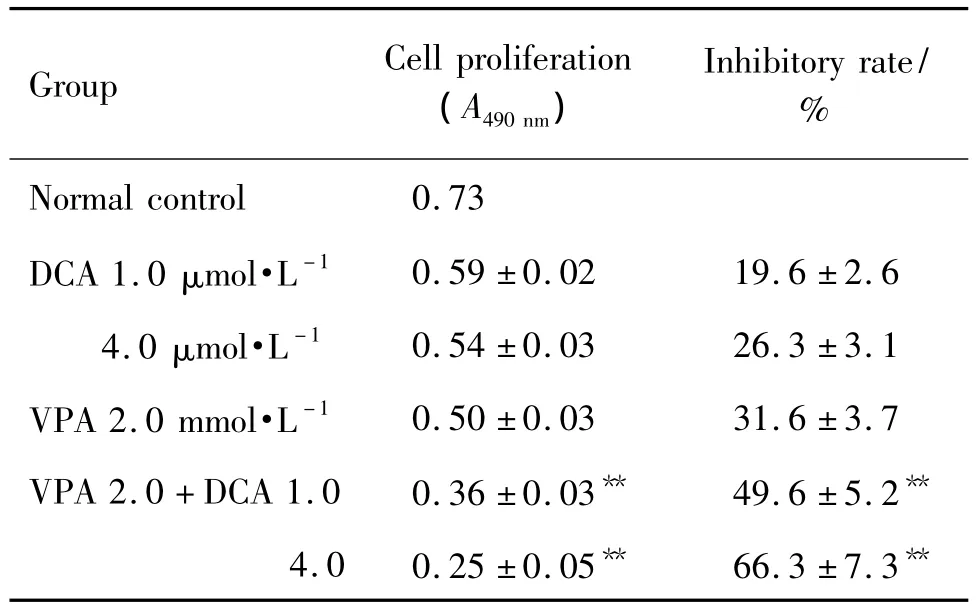
Tab.1 Synergistic effect of decitabine(DCA)and valproic acid(VPA)on HL-60 survival
2.2 地西他滨联合丙戊酸对HL-60细胞凋亡的影响
2.2.1 形态学改变
如图1所示,DCA和VPA处理HL-60细胞后,细胞生长均受到抑制,细胞体积缩小变圆,可见不同形态的凋亡细胞(图1B,C,D,E,F)。细胞膜皱缩,边缘浓染致密,膜发泡成芽,形成凋亡小体脱落等(如箭头所示)。并且,联合用药组的作用明显强于单药组。
2.2.2 AnnexinⅤ/PI双染观察细胞凋亡
所有给药组早期和晚期凋亡率均高于对照组,差异具有显著统计学意义(P<0.01);VPA 2.0+DCA 1.0 联合用药组高于 DCA 1.0 μmol·L-1组和VPA 2.0 mmol·L-1组,差异具有显著统计学意义(P <0.01);VPA 2.0+DCA 4.0 联合用药组高于DCA 4.0 μmol·L-1组和 VPA 2.0 mmol·L-1组,差异具有显著统计学意义(P<0.01)(图2和表2)。
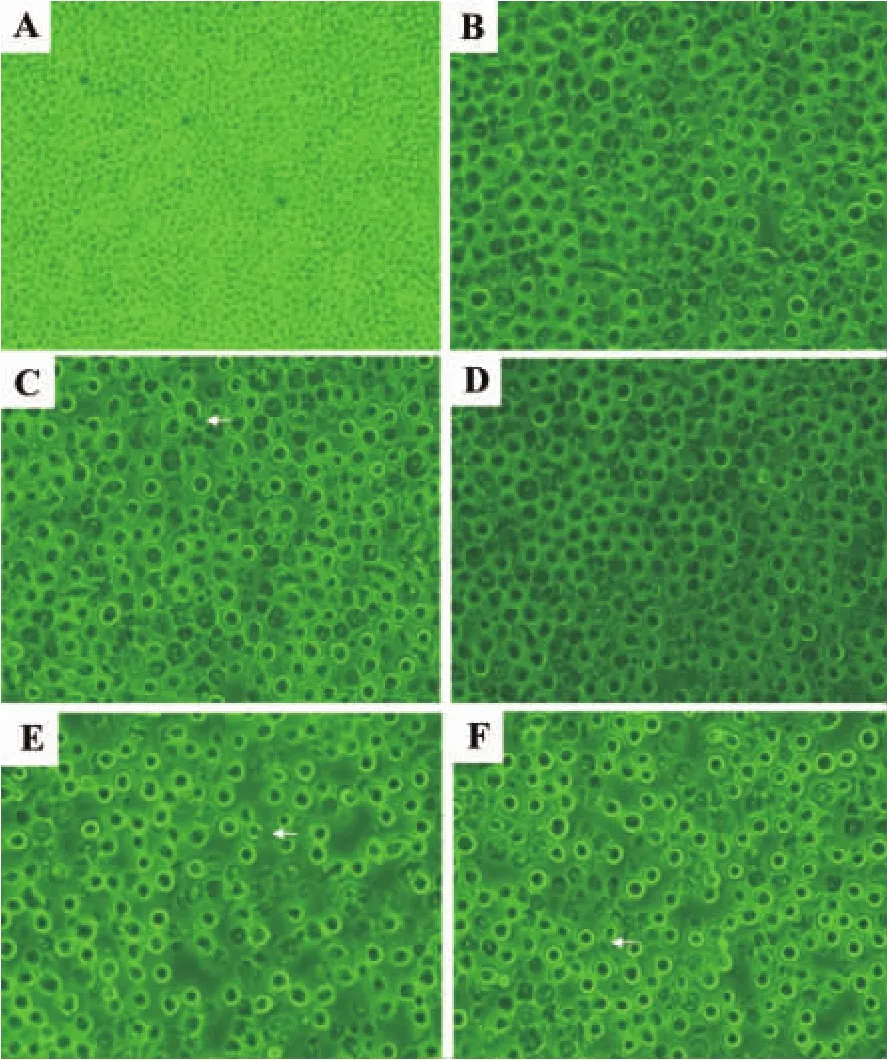
Fig.1 Synergistic effect of DCA and VPA on HL-60 morphological changes(×400).See Tab 1 for the legend.A:normal control;B:DCA 1.0 μmol·L -1;C:DCA 4.0 μmol·L -1;D:VPA 2.0 mmol·L -1;E:VPA 2.0+DCA 1.0;F:VPA 2.0+DCA 4.0.Arrow shows apoptosis body.
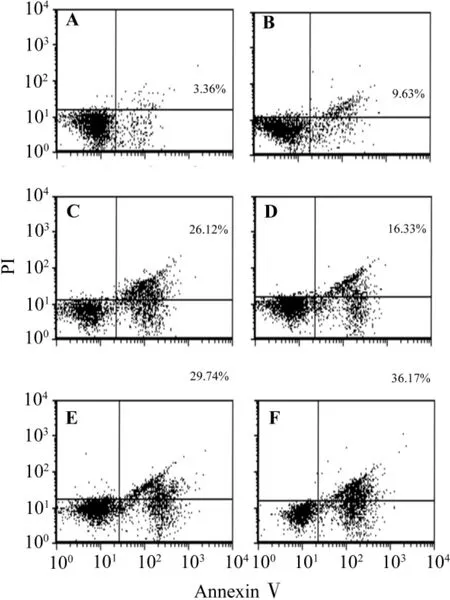
Fig.2 Synergistic effect of DCA and VPA on HL-60 apoptosis detected by AnnexinⅤ/PI staining.A:normal control;B:DCA 1.0 μmol·L -1;C:DCA 4.0 μmol·L -1;D:VPA 2.0 mmol·L -1;E:VPA 2.0+DCA 1.0;F:VPA 2.0+DCA 4.0.
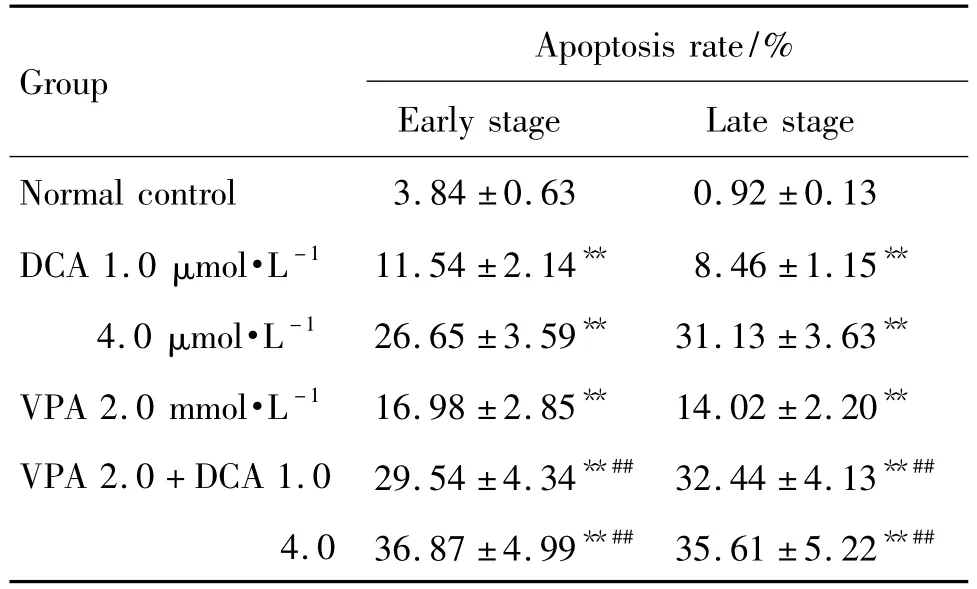
Tab.2 Synergistic effect of DCA and VPA on HL-60 apoptosis
2.3 地西他滨联合丙戊酸钠对 HL-60细胞中hPer3 mRNA表达的影响
与正常对照组相比,所有给药组hPer3 mRNA表达均显著增高(P <0.01);VPA 2.0+DCA 1.0 联合用药组显著高于 DCA 1.0 μmol·L-1组和 VPA 2.0 mmol·L-1组(P <0.01);VPA 2.0+DCA 4.0 联合用药组显著高于 DCA 4.0 μmol·L-1组和 VPA 2.0 mmol·L-1组(P <0.01)(表 3)。
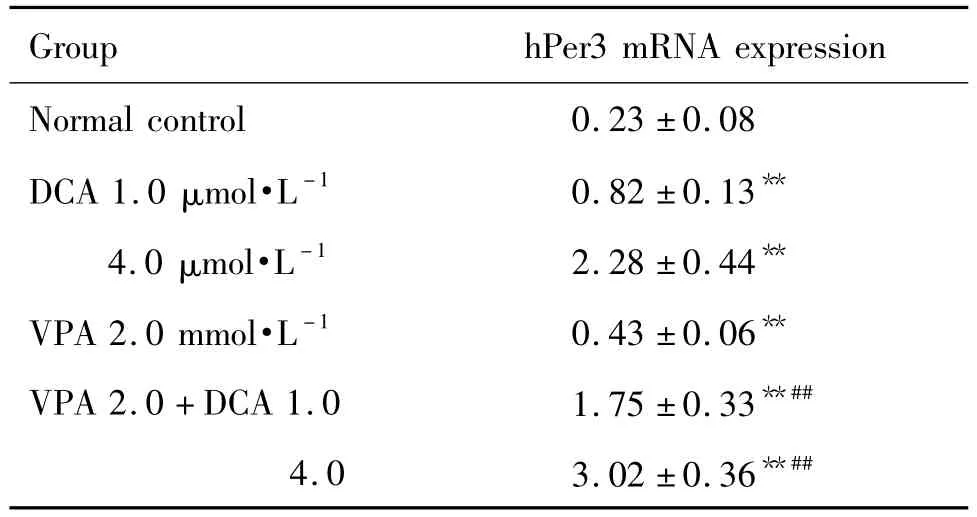
Tab.3 Synergistic effect of DCA and VPA on human period3 mRNA(hPer3 mRNA)expression of HL-60 cells
2.4 地西他滨联合丙戊酸对HL-60细胞中hPer3启动子甲基化状态的影响

Fig.3 Methylation status of hPer3 promoter in HL-60 cell.See Tab.1 for the legend.M and U represent methylation and unmethylation.1:normal control;2:DCA 1.0 μmol·L -1;3:DCA 4.0 μmol·L -1;4:VPA 2.0 mmol·L -1;5:VPA 2.0+DCA 1.0;6:VPA 2.0+DCA 4.0.
图3 结果显示,HL-60中hPer3为完全甲基化状态,DCA 1.0 和4.0 μmol·L-1处理后,高甲基化状态均逐渐减弱,出现非甲基化条带。VPA单独作用无明显去甲基化的作用,但VPA与DCA联用组去甲基化作用加强。
2.5 地西他滨联合丙戊酸对HL-60细胞CD14表达的影响
DCA 1 和4 μmol·L-1显著增加HL-60 细胞CD14表达率(P <0.01)。VPA 2.0+DCA 1.0 联合用药组CD14 表达显著高于DCA 1.0 μmol·L-1组和VPA 2.0 mmol·L-1组(P <0.01);VPA 2.0+DCA 4.0 联合用药组 CD14 表达显著高于 DCA 4.0 μmol·L-1组和VPA 2.0 mmol·L-1组(P <0.01)(表4)。
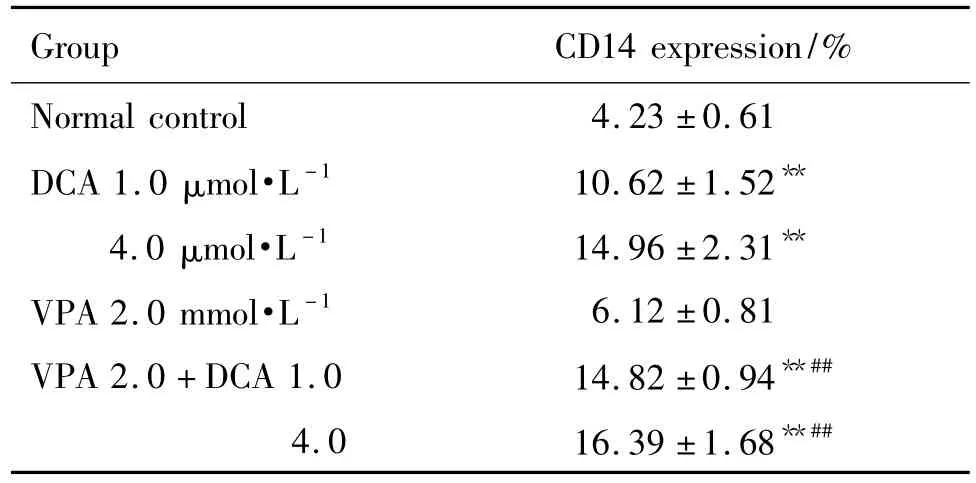
Tab.4 Synergistic effect of DCA and VPA on CD14 expression of HL-60 cells
3 讨论
表观遗传学药物治疗原发性AML已成为恶性血液疾病化疗的研究热点之一,本研究结果也显示,两种不同机制的表观遗传学药物DCA和VPA联用能增强对HL-60的生长抑制、促凋亡和促分化作用,并且这种作用可能与VPA通过增强DCA对hPer3基因启动子去甲基化从而促hPer3基因表达有关。真核细胞基因表达调控途径通常有转录水平调控、染色质结构调控、转录后水平调控、翻译水平调控等,启动子区域甲基化属于转录水平调控的一种,如果CpG岛的甲基化引起转录效率降低,那么其转录效率一般和甲基化程度存在相关性,如Na等[3]用MS-PCR和逆转录PCR观察45例非小细胞肺癌患者GADD45家族基因启动子甲基化和其基因的关系,发现GADD45G mRNA降低与甲基化存在显著相关。Corn等[4]研究发现,E钙黏素在白血病细胞株、AML和ALL中启动子存在高甲基化,并引起E钙黏素表达沉默。目前多数研究均表明DCA和VPA联用在体外多种肿瘤细胞中均体现出较佳的抗肿瘤活性和恢复抑癌基因表达的效果,如LU等[5]在U266细胞中联用DCA和VPA恢复抑癌基因rassf1a的表达,Luszczek等[6]发现DCA与VPA联用引起小细胞肺癌DNA损伤。除了直接作用于细胞活性以外,两类药联用还能间接增强部分肿瘤细胞的对外部处理因素的敏感性,如Cho等[7]观察到两类药联用能增强结肠癌细胞和乳腺癌细胞的辐射敏感性。这些都说明在表观遗传学调控中,组蛋白去乙酰化和DNA甲基化两种机制可以相互协调,共同调控细胞活性和基因表达。
DCA主要的副作用为骨髓抑制导致血三系降低,进而引起感染风险的增加[8],通常需要口服抗生素加以预防[9]。研究显示,DCA虽能促进MDS细胞株向成熟髓系细胞分化,表达CD14和CD11b成熟髓系抗原,但这种促分化作用较低,最高只能使CD14和 CD11b抗原表达率提升到10%左右[10]。本研究显示,VPA 2.0 mmol·L-1并不能明显促进HL-60 细胞表达 CD14,但与 DCA 1.0 μmol·L-1联用能大幅度促进HL-60表达CD14。CD14为脂多糖(lipoploysaccharide,LPS)受体,存在于单核细胞、巨噬细胞等细胞表面的白细胞分化抗原,识别、结合LPS,介导LPS性细胞反应,在LPS性炎症反应、内毒素休克等病理反应中起重要作用[11]。本研究显示,DCA和VPA体外联用能促进CD14的表达,提示其增强了体外抗革兰阴性菌能力。典型的革兰阴性菌血症是间歇性和机会性的,虽然这种菌血症可能不影响健康人,但对化疗后的AML患者则可产生严重后果,感染的初发部位通常在肺部、泌尿生殖道、胃肠道或软组织,包括患有褥疮溃疡的皮肤。如果DCA和VPA在体内联用也能促白血病细胞分化表达CD14,则有助于增强AML患者的抗革兰阴性菌能力,但体内两药联用是否也存在类似的效应,尚需进一步研究。
[1]Wang YK,Zhou JH,Zhou SQ,Fang GA,Li YW,Qiu L,et al.Promoter methylation status of hPer3 gene in AML patients and the in vitro effect of decitabine on the status[J].Chin J Hematol(中华血液学杂志),2011,32(5):317-321.
[2]Blum W,Klisovic RB,Hackanson B,Liu Z,Liu S,Devine H,et al.PhaseⅠstudy of decitabine alone or in combination with valproic acid in acute myeloid leukemia[J].J Clin Oncol,2007,25(25):3884-3891.
[3]Na YK,Lee SM,Hong HS,Kim JB,Park JY,Kim DS.Hypermethylation of growth arrest DNA-damage-inducible gene 45 in non-small cell lung cancer and its relationship with clinicopathologic features[J].Mol Cells,2010,30(1):89-92.
[4]Corn PG, Smith BD, Ruckdeschel ES, Douglas D,Baylin SB,Herman JG.E-cadherin expression is silenced by 5'CpG island methylation in acute leukemia[J].Clin Cancer Res,2000,6(11):4243-4248.
[5]Lu F,Liu CF,Ma DS,Liu YP,Kong HL,Zhang JJ.Synergistic effect of DNA methylation inhibitor and histone deacetylase inhibitor on RASSF1A gene expression in U266 cells[J].Chin JHematol(中华血液学杂志),2010,31(4):223-227.
[6]Luszczek W,Cheriyath V,Mekhail TM,Borden EC.Combinations of DNA methyltransferase and histone deacetylase inhibitors induce DNA damage in small cell lung cancer cells:correlation of resistance with IFN-stimulated gene expression[J].Mol Cancer Ther,2010,9(8):2309-2321.
[7]Cho HJ,Kim SY,Kim KH,Kang WK,Kim JI,Oh ST,et al.The combination effect of sodium butyrate and 5-aza-2'-deoxycytidine on radiosensitivity in RKO colorectal cancer and MCF-7 breast cancer cell lines[J].World J Surg Oncol,2009,(7):49.
[8]Stathis A,Hotte SJ,Chen EX,Hirte HW,Oza AM,Moretto P,et al.PhaseⅠ study of decitabine in combination with vorinostat in patients with advanced solid tumors and non-Hodgkin's lymphomas[J].Clin Cancer Res,2011,17(6):1582-1590.
[9]Lee JH,Lee KH,Lee JH,Kim DY,Kim SH,Lim SN,et al.Decreased incidence of febrile episodes with antibiotic prophylaxis in the treatment of decitabine for myelodysplastic syndrome[J].Leuk Res,2011,35(4):499-503.
[10]Yang L,Xu RR,Huang HM,Ding RS,Jiang SH.Research of effects of MDS cell line SKM-1 by decitabine[J].Med J Communi(交通医学),2007,21(1):34-35.
[11]Dessing MC,Knapp S,Florquin S,de Vos AF,van der Poll T.CD14 facilitates invasive respiratory tract infection by Streptococcus pneumoniae[J].Am J Respir Crit Care Med,2007,175(6):604-611.

