乙醛脱氢酶2基因在毕赤酵母中的表达和分离纯化
陈 瑞,方 剑,王静涵
(1.皖西学院生物与制药工程学院,六安237012;
2.皖西学院安徽省植物生物技术实验实训中心,六安237012)
乙醛脱氢酶2基因在毕赤酵母中的表达和分离纯化
陈 瑞1,2,方 剑1,王静涵1
(1.皖西学院生物与制药工程学院,六安237012;
2.皖西学院安徽省植物生物技术实验实训中心,六安237012)
将乙醛脱氢酶2(ALDH2)基因整合到质粒pPIC9K上,构建重组表达载体pPIC9K⁃coALDH2,用电转导将表达质粒pPIC9K⁃coALDH2转化至毕赤酵母GS115中,在毕赤酵母中表达经密码子改造的ALDH2。结果表明:重组基因工程菌GS115(pPIC9K⁃coALDH2)发酵液中蛋白质量浓度为8.40 mg/L,1 m L发酵液中酶活为11.35 mU。
乙醛脱氢酶;GS115;表达
乙醛脱氢酶2[1](aldehydehyde dehydrogenase,ALDH2)是一种主要分布在动物肝、胃等器官中的氧化还原酶,它能催化乙醛与乙酸之间的转化反应,是人体代谢乙醇的关键酶[2]。Ge等[3]的研究表明:ALDH2能够减轻缺氧而导致的心肌细胞凋零;对神经细胞、内皮细胞也有减轻缺氧损伤的作用。叶红伟等[4]用离体大鼠心脏,结扎冠状动脉左前降支30 min模拟局部心肌缺血,松开结扎线恢复灌流120 min复制心肌缺血,再灌注(I/R)模型。结果表明与I/R组比,法舒地尔组明显促进了左室发展压、左心室内压最大上升和下降速率、左心室做功的恢复,降低复灌期冠脉流出液中LDH的释放,ALDH2 mRNA表达增加,Bcl⁃2/Bax比值增高。
关于乙醛脱氢酶的研究有很多,其分离纯化、诱导、激活均有所报道。还有通过基因工程在原核生物和植物体内对该酶基因进行表达的研究,鞠建松等[5]从嗜碱芽胞杆菌中获得乙醇脱氢酶和乙醛脱氢酶的基因,构建载体,通过原核表达,获得乙醇脱氢酶和乙醛脱氢酶,但存在表达量低,失活严重等问题。笔者通过研究乙醛脱氢酶基因在毕赤酵母中的诱导表达,得到具有活性的ALDH2,为开发能够预防和缓解乙醇对身体伤害的药物奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
菌株大肠杆菌(Escherichia coli)DH5α,毕赤酵母(Pichia pastoris)GS115(Mut+,his4)和质粒pPIC9K为安徽省植物生物技术实验实训中心保藏。
1.1.2 试剂
Tris、SDS、限制性内切酶Sac I、Bam I、Eco RⅠ以及T4连接酶、Taq酶,宝生物工程有限公司;葡萄糖、异丙醇、乙醇等均为市售国产分析纯。
1.1.3 实验仪器
TGRADIEN PCR仪(德国Biometra公司),DYY-10C型电泳仪(北京六一仪器厂),G:BOX高级凝胶成像系统(美国Syngene公司),722S可见光分光光度计(上海精密科学仪器有限公司),UNIVERSAL32R台式冷冻离心机(德国Hettich公司),THZ-D型台式振荡恒温培养箱(太仓市实验设备厂)。
1.2 方法
1.2.1 酵母菌表达载体的构建[6]
将质粒pPIC9K和含有目的序列的pUC57⁃coALDH2分别用Eco RⅠ和BamⅠ双酶切,再电泳并回收目的序列和酶切后的pPIC9K。用T4连接酶将目的序列插入至pPIC9K的Eco RⅠ和BamⅠ双酶切缺口,得到pPIC9K⁃coALDH2并转化至大肠杆菌DH5α中[7],挑取单菌落进行菌落PCR验证。
1.2.2 基因工程菌株的构建[8]
构建的质粒pPIC9K⁃coALDH2转化至P.pastoris GS115,电转参数为1 500 V,5 ms。首先用SacⅠ线性化质粒并回收,再使用电转化仪转化至毕赤酵母感受态细胞,转化后毕赤酵母涂于选择平板筛选阳性转化子。
1.2.3 诱导表达
将PCR验证为阳性[9]的菌株在酵母膏葡萄糖YPD培养基中培养1 d,培养条件为30℃、150 r/min。按1%接种量接种于毕赤酵母表达用培养基BMGY培养基中,25℃、250 r/min振荡培养2~3 d,期间每24 h补加质量分数为1%的甲醇。诱导结束的发酵液8 000 r/min离心10 min,收集上清液,用SDS⁃PAGE电泳检测。
1.2.4 目标蛋白含量的测定
蛋白质含量采用考马斯亮蓝法(CBB)[10],首先配制标准小牛血清白蛋白(BSA)溶液100μg/mL,然后进行标准溶液的配制,在595 nm处检测吸光度。
1.2.5 酶活检测[11]
酶活体系:1 mol/L Tris⁃HCl buffer(pH 8.0)300μL,20 mmol/Lβ-烟酰胺腺嘌呤二核苷酸(β⁃NAD)300μL,100 mmol/L乙醛200μL,3mol/L KCl 100μL,1 mol/Lβ-巯基乙醇30μL,酶液1 mL及水1.07 mL。
用紫外分光光度计检测酶活体系在340 nm处吸光度的变化值,反应温度为37℃,计算ALDH活性。为了讨论方便,定义每分钟波长340 nm处吸光度变化0.01为1个活力单位(U)。
2 结果与讨论
2.1 表达载体的构建
图1为目的基因PCR结果及酶切鉴定的电泳鉴定图。由图1可以看出:第1、2泳道为pUC57⁃coALDH2双酶切回收的1 500 bp目的片段,第3泳道为质粒pPIC9K双酶切后回收片段,大小为9 300 bp,与理论值相符。
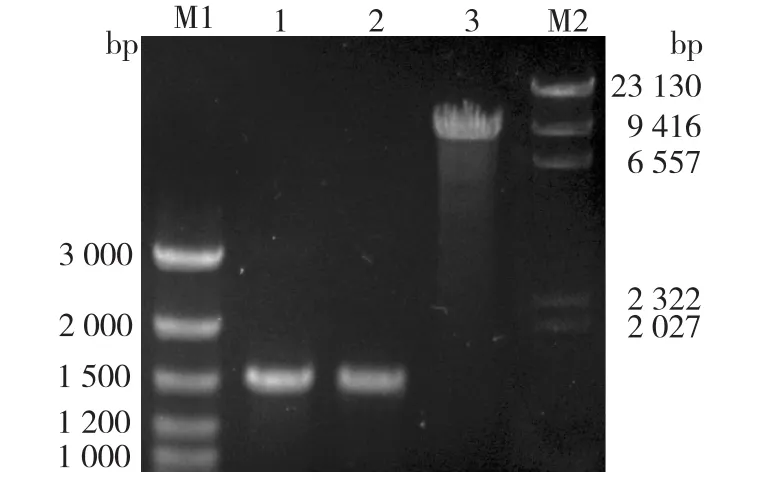
图1 酶切回收目的片段的电泳Fig.1 Results of restriction and extraction
2.2 基因工程菌的筛选鉴定
用GeneTools分析各回收片段浓度的比例。按插入片段和质粒摩尔比2∶1混合回收的片段,用T4连接酶连接pPIC9K和coALDH2,并转化到E.coli DH5α中。挑取筛选平板上的单菌落进行菌落PCR验证,验证后质粒电转至P.pastoris GS115,得到重组菌P.pastoris GS115(pPIC9K⁃coALDH2)。提酵母总DNA后进行PCR检验,结果见图2。
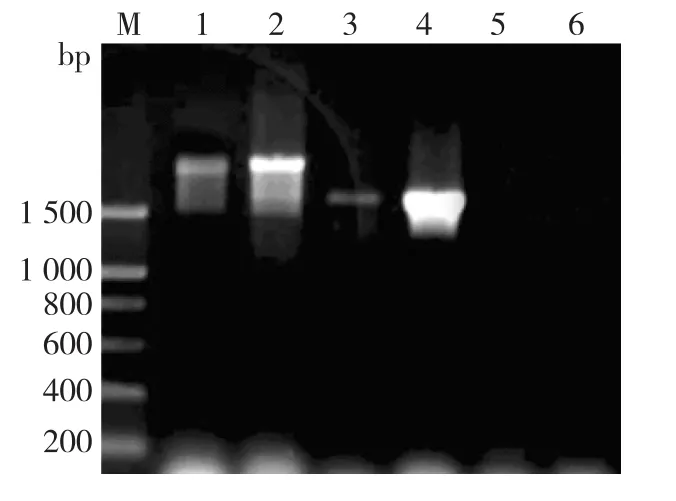
图2 以毕赤酵母基因组为模板的PCR扩增结果Fig.2 Results of P.pastoris genome PCR amplification
由图2可知:第1、2、5泳道为5′AOX1和3′ALDH为引物,PCR的扩增结果(理论长度1 867 bp);第3、4、6泳道为a⁃factor和3′ALDH为引物,PCR的扩增结果(理论长度1 570 bp)。结果发现,第1、2、3、4泳道为GS115(pPIC9K⁃coALDH2),结果为阳性;5、6号泳道为对照(GS115),结果为阴性。说明基因工程菌株构建成功。
2.3 目标蛋白的SDS⁃PAGE检测
图3为重组菌与对照菌发酵液的上清液的SDS⁃PAGE电泳分析结果。由图3可以发现,目的蛋白的大小约为46 000,与乙醛脱氢酶的理论值相符[12]。
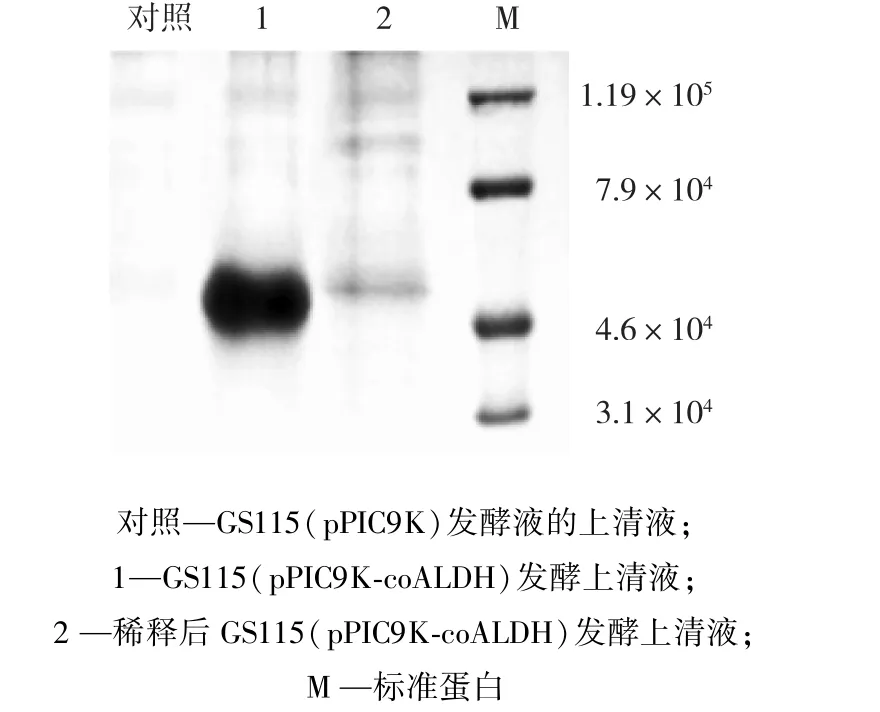
图3 SDS⁃PAGE电泳检测目的蛋白Fig.3 SDS⁃PAGE analysis of target protein
2.4 目标蛋白含量的测定
利用考马斯亮蓝法测定目的蛋白,BSA蛋白含量的标准曲线结果见图4。由图4可以看出,试样中蛋白含量m=0.27 919A-0.22 956,R2=0.99 514。
由此计算出250μL试样中目的蛋白含量为2.10 μg,发酵液中目的蛋白质量浓度为8.40 mg/L。
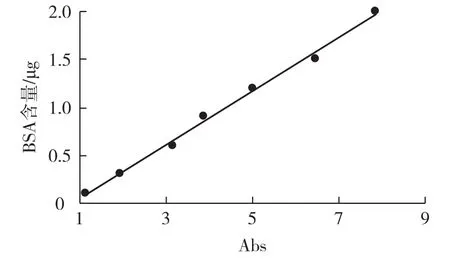
图4 蛋白含量标准曲线Fig.4 Standard curve of protein content
2.5 酶活检测
发酵液中某些物质在340 nm处吸光度较大,可以推测出该物质主要是酵母的代谢产物。用PEG沉淀能较好地将目的蛋白与干扰物质分开,且PEG对酶有一定的保护作用,处理后酶活损失较少,结果比较稳定,能基本反映发酵液中酶活的总量。
取1mL发酵液处理上清后,加入酶活体系测得乙醛脱氢酶的酶活为11.35 mU,比活力为1.35 U/mg。
3 结 论
以质粒pPIC9K为载体,毕赤酵母P.pastoris GS115为宿主菌,构建得到重组基因工程菌GS115(pPIC9K⁃coALDH),经摇瓶发酵发现GS115(pPIC9K⁃coALDH)的蛋白表达量为8.40 mg/L,比酶活为11.35 mU/mL。通过研究乙醛脱氢酶基因在毕赤酵母中的诱导表达,得到纯度较高、活性较高的ALDH2,在此基础上进一步研究乙醛脱氢酶的其他生理学作用,为开发能够预防和缓解乙醇对身体伤害的药物奠定基础。
[1] Yoshida A,Rzhetsky A,Hsu L C,et al.Human aldehyde dehydrogenase gene family[J].Eur J Biochem,1998,251(3):549⁃557.
[2] Kirch H H,Bartels D,Wei Y,et al.The ALDH gene superfamily of Arabidopsis[J].Trends Plant Sci,2004,9(8):371⁃377.
[3] Ge JB,Sun A J,Zou Y Z,et al.The new use of anti⁃alcohol drug contains Aldehyde dehydrogenase[J].Health Ind,2010,9(8):71⁃74.
[4] 叶红伟,康品方,王洪巨.乙醛脱氢酶2在法舒地尔心肌保护作用中的机制[J].中国老年学杂志,2013,54(5):36⁃41.
[5] 鞠建松,马宁.假坚强芽孢杆菌中乙醇降解相关酶的克隆、表达及酶学特性[J].微生物学报,2013,54(4):363⁃371.
[6] Weber H,Chételat A,Reymond P,et al.Selective and powerful stress gene expression in Arabidopsis in response to malondialdehyde[J].Plant J,2004,37(6):877⁃888.
[7] Sophos N A,Vasiliou V.Aldehyde dehydrogenase gene superfamily:the2002 update[J].Chem Biol Interact,2003,143⁃144:5⁃22.
[8] Perozich J,Nicholas H,Wang B C,et al.Relationshipswithin the aldehyde dehydrogenase extended family[J].Protein Sci,1999,8(1):137⁃146.
[9] 张伍魁,范清林,宋礼华.毕赤酵母表达系统在外源基因表达中的研究进展及应用[J].中国生物工程杂志,2006,26(1):87⁃91.
[10] 李东阳,于建,田露,等.利用重组Pichia pastoris生产腺苷甲硫氨酸[J].生物工程学报,2002,18(3):295⁃299.
[11] 周祥山,范卫民,张元兴.不同甲醇流加策略对重组毕赤酵母高密度发酵生产水蛭素的影响[J].生物工程学报,2002,18(3):348⁃351.
[12] 吴桂英,赵玉凤,吴元欣,等.酿酒酵母细胞破碎释放乙醛脱氢酶的研究[J].食品工业科技,2007,28(3):61⁃63.
Expression of acetaldehyde dehydrogenase 2 gene in Pichia pastoris
CHEN Rui1,2,FANG Jian1,WANG Jinghan1
(1.College of Biology and Pharmaceutical Engineering,West Anhui University,Lu′an 237012,China;2.Experiment and Training Center of Plant Biotechnology of Anhui Province,West Anhui University,Lu′an 237012,China)
To obtain acetaldehyde dehydrogenase 2(ALDH2),the pPIC9K⁃ALDH2 was linearized and transformed by electroporation into Pichia pastoris GS115,and the new engineering bacteria GS115(pPIC9K⁃co1ALDH)for overexpressing ALDH2 was obtained.The results showed that the content of target protein was 8.40 mg/L and the enzymatic activities in culture recombinant Pichia strains reached 11.35 mU/mL,and itwas higher than that in extracellular expression.
acetaldehyde dehydrogenase;GS115;express
Q78
A
1672-3678(2013)06-0034-04
10.3969/j.issn.1672-3678.2013.06.007
2012-09-18
大学生创新创业计划项目(201210376007);六安市定向委托皖西学院市级研究项目(2012LW001)
陈 瑞(1985—),男,安徽六安人,硕士,研究方向:微生物学,E⁃mail:umeyama@163.com

