利奈唑胺临床治疗安全性分析
古丽拜尔·卡哈尔,侍效春,刘晓清,张丽帆,梅 丹,邓国华
利奈唑胺是首个应用于临床的新型恶唑烷酮类抗菌药物,它与核糖体50s亚基相结合,阻止70s亚基起始复合物的形成,作用于细菌蛋白质合成的起始阶段,最终产生抑菌作用[1]。它对耐药革兰阳性菌包括耐甲氧西林的金黄色葡萄球菌和耐万古霉素的肠球菌均有良好的抗菌作用,为临床治疗严重和 (或)耐药革兰阳性菌感染提供了新的选择。近年来随着利奈唑胺临床应用的增多,关于其不良反应的报道也逐渐增多。本研究对我院2007年9月—2010年5月应用利奈唑胺的53例共62人次住院患者相关资料进行回顾性分析,探讨利奈唑胺临床治疗的安全性,并筛选预测其发生的重要临床特征,以期为临床合理用药和提高安全性提供参考。
1 对象与方法
1.1 研究对象 2007年9月—2010年5月北京协和医院因临床需要接受利奈唑胺治疗的全部住院患者。排除标准:利奈唑胺用药时间<6 d;患者年龄<14岁;存在血液系统疾病;系统性红斑狼疮合并血液系统改变;正在接受放化疗。
1.2 利奈唑胺的用法 利奈唑胺600 mg/次,每12 h静脉滴注1次,疗程6~32 d。
1.3 观察指标 收集患者用药前后全血细胞计数和肝功能的动态变化。全血细胞计数中记录白细胞计数、中性粒细胞计数、血红蛋白和血小板计数;肝功能中记录丙氨酸氨基转移酶(ALT)和总胆红素 (TBIL);肾功能采用肌酐值 (Cr),然后采用改良的肾病膳食改良试验 (MDRD)公式估算肾小球滤过率 (eGFR),以eGFR<80 ml/min定义为肾功能不全[2]。
1.4 不良反应评价 显著的血液学检查异常定义为:基础值正常者,<75%参考值低限 (中性粒细胞计数为小于50%);基础值异常者,<75%参考值低限 (中性粒细胞计数为小于50%)和<75%基础值[3]。血小板下降分度按WHO化疗急性和亚急性毒副作用表现和分度标准,Ⅲ度为 (26~49) ×109/L,IV 度≤25×109/L[3]。肝毒性分级标准采用 AIDS临床试验小组标准[4],肝毒性1级以上判为肝功能异常,即ALT高于正常上限的1.25倍或TBIL高于正常上限的1.1倍。
1.5 统计学方法 采用SPSS 13.0统计软件进行数据处理。计量资料以 (±s)表示,组间比较采用t检验。计数资料以率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 性别及年龄分布 本研究共计纳入53例62人次静脉使用利奈唑胺患者,其中男 29例 (占 54.7%),女 24例(45.3%);年龄14~91岁,平均59.6岁。
2.2 不良反应情况 血小板减少的发生率为27.4%,其中有8人次 (12.9%)发生了Ⅲ度或Ⅳ度血小板下降。共计3人次出现肝功能异常 (8人次合并梗阻性黄疸和2人次合并溶血性黄疸除外),2人次为ALT升高,均为肝毒性1级,其中1人有肝硬化基础病,另1人联合使用氟康唑;1人次出现TBIL升高,为肝毒性2级,该患者同时使用四联抗结核药物。本组病例中,不良反应多发生在用药后的前2周内,见表1。
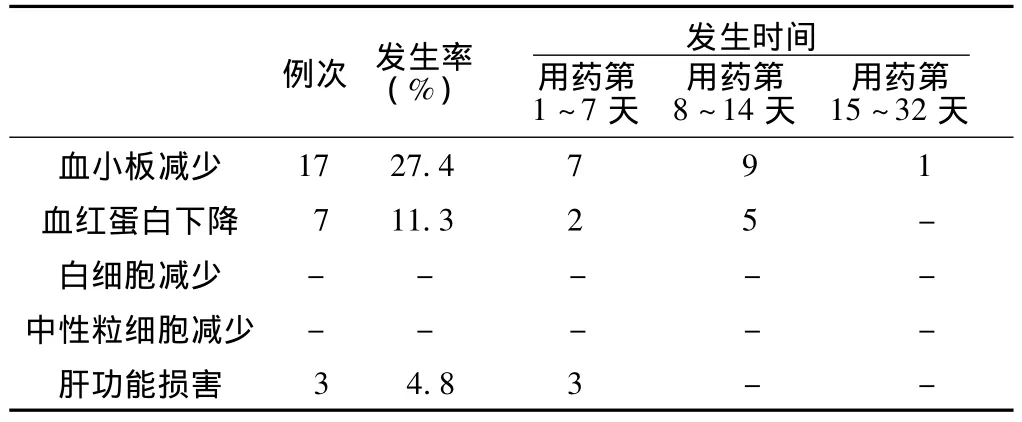
表1 62人次临床应用利奈唑胺患者中发生血液学和肝功能异常情况Table1 Occurrence of hematology and liver function abnormalities in 62 person-time patients treated with linezolid
2.3 不良反应的处理及转归 7人次发生血红蛋白下降的患者中,5人次需要输血,不需要停药;17人次发生血小板减少的患者中,9人次需要输血小板,3人次需要停药。经对症输血和停药处理后,除7例患者因基础病严重而死亡外,其余10人次均恢复到基线水平。3例发生肝功能异常的患者均在保肝和停药后肝功能好转。
2.4 发生血液学异常的相关因素分析 将62人次患者分别分为血小板减少组和无血小板减少组、血红蛋白下降组和无血红蛋白下降组,比较不同组各指标的差异。有无血小板减少的两组患者在年龄、肾功能不全和基础血小板值3种指标上差异有统计学意义 (P<0.05,见表2);是否发生血红蛋白下降的两组患者在年龄和肾功能不全2种指标上差异有统计学意义 (P<0.05,见表3)。

表2 患者使用利奈唑胺期间发生血小板减少的相关因素分析Table2 Related factor analysis of thrombocytopenia in patients treated with linezolid
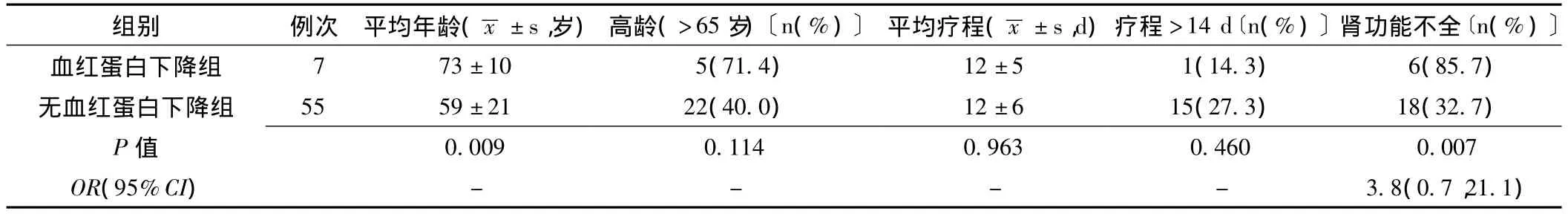
表3 患者使用利奈唑胺期间发生血红蛋白下降的相关因素分析Table3 Related factor analysis of hemoglobin dropped in patients treated with linezolid
3 讨论
利奈唑胺对革兰阳性菌有较好的抗菌活性,以其独特的抗菌机制、良好的抗菌活性和低耐药率而临床应用广泛。因此,其治疗安全性备受关注。随着临床应用的增多,关于其不良反应的报道也逐渐增多。利奈唑胺虽然一般只是发生轻度的不良反应,但应警惕骨髓抑制,尤其是血小板减少的发生。
利奈唑胺致血小板减少的机制目前尚不完全明确。由于研究设计不同、血小板减少的定义不同以及样本量的差异,文献报道利奈唑胺致血小板减少的发生率为2.4%~64.7%各异[3-7]。Ⅲ期临床试验结果显示其发生率仅为2.4%(0.3%~10.0%)[3],但药物上市后的临床观察显示该药导致血小板减少的发生率明显高于该试验结果。文献报道高龄、长疗程、肾功能不全、低基础血小板计数和原发病危重程度高等因素是利奈唑胺导致的血小板减少的危险因素[8-11]。本研究中17人次发生血小板减少,其中有8人次为Ⅲ度或Ⅳ度血小板下降,需要输血小板甚至停药,有3人次在停药后仍有血小板的进一步下降,但均为可逆性血小板减少。此外,相关因素分析显示,是否发生血小板减少可能与高龄、肾功能不全和低基础血小板值3种因素有关。
一些文献报道治疗疗程长是利奈唑胺致血液系统毒性反应的危险因素之一[12-13]。Birmingham 等[12]进行的一项包括 796例使用利奈唑胺的患者的研究显示,疗程分别为≤14 d、15~28 d和≥28 d时,血液系统不良反应发生率分别为1.9%、5.1%和7.4%。但是,本研究显示血液系统不良反应的发生率和利奈唑胺的疗程无关,这可能是由于样本量少、≥28 d的病例数少且患者原发病严重等多种因素导致的。
本研究中,其他不良反应包括血红蛋白下降和肝功能异常。利奈唑胺致血红蛋白下降的机制目前多倾向于骨髓抑制学说,与应用利奈唑胺的长期治疗 (4周至6个月)、高龄、血红蛋白基线值<105 g以及肾功能减退等因素有关[14-16]。本研究分析显示利奈唑胺导致血红蛋白下降在年龄和肾功能不全2种因素上具有统计学差异,提示在这些人群中需要注意监测血红蛋白的变化。而利奈唑胺的肝毒性并不明显,本研究中3人次发生肝损害均为轻度,且1例合并肝硬化基础病,另2例同时使用其他有肝毒性的药物,经对症治疗和停药处理后均好转。
总之,利奈唑胺治疗具有良好的安全性,最常见的不良反应为血小板减少,停药后多可恢复至基线水平。在高龄和低基础血小板计数的患者中需要密切监测全血细胞计数。
1 Moellering RC.A novel antimicrobial agent joins the battle against resistant bacteria[J].Ann Inter Med,1999,130(2):155-157.
2 陆再英,钟南山,谢毅,等.内科学[M].7版.北京:人民卫生出版社,2008.
3 Gerson SL,Kaplan SL,Bruss JB,et al.Hematologic effects of linezolid:Summary of clinical experience[J].Antimicrob Agents Chemother,2002,46(8):2723-2726.
4 AIDS Clinical Trial Group.Table of grading severity of adult adverse experiences[S].1996.
5 French G.Safety and tolerability of linezolid[J].Antimicrob Chemother,2003,51(Suppl 2):ii45-ii53.
6 Bishop E,Melvani S,Howden BP,et al.Good clinical outcomes but high rates of adverse reactions during linezolid therapy for serious infections:A proposed protocol for monitoring therapy in complex patients[J].Antimicrob Agents Chemother,2006,50(4):1599-1602.
7 Takahashi Y,Takesue Y,Nakajima K,et a1.Risk factors associated with the development of thrombocytopenia in patients who received linezolid therapy[J].J Infect Chemother,2011,17(3):382-387.
8 Matsumoto K,Takeshita A,Ikawa K,et a1.Higher linezolid exposure and higher frequency of thrombocytopenia in patients with renal dysfunction[J].Int J of Antimicro Agents,2009,33(1):98-99.
9 Rao N,Ziran BH,Wagener MM,et al.Similar hematologic effects of long-term linezolid and vancomycin therapy in a prospective observational study of patients with orthopedic infections [J].Clin Infect Dis,2004,38(8):1058-1064.
10 Grau S,Morales-Molina JA,Mateu-de Antonio J.Linezolid:Low pretreatment platelet values could increase the risk of thrombocytopenia[J].J Antimicrob Chemother,2005,56(2):440-441.
11 穆玉,范春芳,朱铁梁,等.重症患者利奈唑胺所致血小板减少危险因素分析[J].中国感染与化疗杂志,2012,12(1):10-14.
12 Birmingham MC,Rayner CR,Meagher AK,et al.Linezolid for the treatment of multidrug-resistant,gram-positive infections:Experience from a compassionate-use program [J].Clin Infect Dis,2003,36(2):159-168.
13 Takahashi Y,Takesue Y,Nakajima K,et al.Risk factors associated with the development of thrombocytopenia in patients who received linezolid therapy[J].J Infect Chemother,2011,17(3):382-387.
14 Green SL,Maddox JC,Huttenbach ED.Linezolid and reversible myelosuppression[J].JAMA,2001,285(10):1291.
15 Senneville E,Legout L,Valette M,et al.Risk factors for anemia in patients on prolonged linezolid therapy for chronic osteomyelitis:A case-control study [J].J Antimicrob Chemother,2004,54(4):798-802.
16 Hiraki Y,Tsuji Y,Matsumoto K,et al.Influence of linezolid clearance on the induction of thrombocytopenia and reduction of hemoglobin[J].Am J Med Sci,2011,17(1):70-75.

