蝇蛹金小蜂的交配行为及雄蜂交配次数对雌蜂繁殖的影响
孙 芳,陈中正,段毕升,贺 张,谢 磊,胡好远
(安徽师范大学生命科学学院,安徽省高校生物环境与生态安全省级重点实验室,芜湖 241000)
对于多数昆虫而言,雄性常常与多个雌性进行交配,雌性也往往能接受雄性个体的多次交配[1-2]。毫无疑问,多次交配对于昆虫种群的延续有重要意义。对于雄性而言,与更多的雌性进行交配能够获得更多后代;而对于雌性而言,多次交配也往往能够促进后代数量的增加[1]。然而,有资料表明,多数寄生蜂的雌蜂仅具有单个配偶,一些寄生蜂雌蜂一生仅交配1次,而雄蜂可与多头雌蜂进行交配[3-6]。随寄生蜂雄蜂交配次数的增加,交配时提供给雌性的精子数量趋于减少,但这些雄性仍能持续交配,对其配偶的繁殖产生影响[4-7]。寄生蜂的雄性个体一般为未受精的单倍型卵发育,而雌性个体由受精的二倍型卵发育[8]。雌蜂体内精子相对缺乏时,将产出更高比例的未受精卵,后代的雄性比例显著增加[9]。
蝇蛹金小蜂(Pachycrepoideus vindemmiae Rondani)是多种蝇类害虫蛹期常见寄生蜂种类,属于小蜂总科(Chalcidoidea)金小蜂科(Pteromalidae)金小蜂亚科(Pteromalinae),为世界范围内的广布种[10];在单个寄主体内一般仅有单头后代能完成发育,为单寄生性寄生蜂,并且寄生时,能将寄主麻痹,属于抑性寄生蜂[11-12]。前期研究表明,雌蜂产卵后期,寄生蜂后代雄性比例增加,表现出产卵者体内储存的精子数量出现缺乏[13-14]。这可能与雄蜂的交配次数相关,随雄蜂交配次数的增加,与之交配的雌蜂获得的精子数量可能趋于减少,从而出现更高比例的雄性后代。蝇蛹金小蜂雄蜂的交配次数,可能对雌蜂的繁殖产生影响。本文在对蝇蛹金小蜂交配行为过程描述的基础上,探讨了雄蜂交配次数对雌蜂繁殖的影响程度,并探讨了雌蜂再次交配的可能性。
1 材料与方法
1.1 材料来源与饲养
供试家蝇(Musca domestica)采自安徽师范大学赭山校区食堂附近,并参照何凤琴[15]的方法在室内进行人工饲养,以获得家蝇蝇蛹。蝇蛹金小蜂为实验室常年饲养的芜湖株系[13],经中国科学院动物研究所肖晖副研究员鉴定。在人工气候箱内进行培养,温度为(25±1)℃,光照强度为60%(约2000 lx)(L∶D=14∶10),相对湿度为RH=(50±5)%。饲养寄生蜂的培养器皿为直径5 cm、高9 cm的透明玻璃杯,蝇蛹和雌蜂比例为10∶1,同时饲以10%的蜂蜜水。
实验前,对家蝇幼虫饲养密度定量化,以获得大小一致的蝇蛹(长度在6.0—6.5 mm之间),使用直尺(精确到0.5 mm)对所用的蝇蛹进行测量,获得近似等同大小的蝇蛹,用作寄生蜂繁殖,以确保寄生蜂后代大小近似。
1.2 蝇蛹金小蜂交配行为的研究
蝇蛹金小蜂为单寄生性寄生蜂,一般在单头寄主体内仅能够羽化成熟单头后代[11-13]。将即将羽化寄生蜂的寄主用2 mL冻存管单头分装,获得未交配过的雌蜂和雄蜂。同时以脱脂棉沾取10%蜂蜜水补充营养,喂食1d。
在直径4 cm、高5 cm的特制玻璃杯中,放置1头未交配的雄蜂和雌蜂,同时以脱脂棉沾取10%蜂蜜水补充寄生蜂的营养。记录寄生蜂交配前的搜寻、求偶、交尾前期、交尾和交尾后期的时间长度,共记录11组;对交配的各阶段进行拍照。各阶段参照King和Kuban[16]:
求偶 从雄蜂追逐雌蜂至攀爬到雌蜂背上;
交尾前期 从雄蜂攀爬到雌蜂背上到雌蜂生殖孔打开;
交尾 从雌蜂生殖孔打开至雄性交配器抽出;
交尾后期 交尾结束至雄蜂从雌蜂背上离开。
1.3 蝇蛹金小蜂雄蜂交配次数对雌蜂繁殖的影响
上述11组寄生蜂交配结束后,取出雌蜂,每间隔10 min,分别再次给予1头未交配的雌蜂,各组雄蜂均连续交配15头雌蜂。将交配后雌蜂按顺序编排,供下一步实验使用。
雄蜂交配次数对雌蜂繁殖影响的实验分为6个处理组,分别以雄蜂第1、3、6、9、12和15次交配的雌蜂为产卵者,每处理组均为11个重复。在上述的特制玻璃杯中引入1头雌蜂,接入10头1—2日龄家蝇蛹,同时以脱脂棉沾取10%蜂蜜水补充营养。每天定时取出杯中蝇蛹,再放入10头1—2日龄的蝇蛹并更换蜂蜜水棉球。实验持续至产卵者全部死亡。每日将各杯中更换后的家蝇蛹分别装入直径1cm、高5 cm的冻存管中,棉塞封口。定期记录各管内羽化的雄蜂和雌蜂数量,管内蝇蛹在体式显微镜下镜检,记录未能成功钻出寄主蛹的寄生蜂后代。统计获得每头雌蜂的雌雄后代日产量、总产量和性比。
1.4 蝇蛹金小蜂雌蜂交配次数
将上述的其余交配次序时获得的雌蜂分为2组。第1组(雄蜂第2、4、7、10和13次交配的雌蜂各11头)在交配完成10min后,对每头雌蜂均分别给予1头未交配的雄蜂,观察交配是否能够再次完成,如交配不能在10min内完成则更换1头雄蜂,如果雄蜂连续更换3次,均不能完成交配,则将该雌蜂视为不能再次交配。第2组(雄蜂第5、8、11和14次交配的雌蜂各11头)每日分别给予10头1—2日龄的新鲜蝇蛹并喂饲蜂蜜水,寄生8d后,再分别给予未交配过的雄蜂,按上述方法记录其是否具有交配能力。
1.5 数据分析
在R2.13.0软件[17-18]中使用广义线性模型(Generalized Linear Model,GLM)分析了雌蜂产卵期和交配次数对寄生蜂日后代数量、后代性比的影响。数量数据使用泊松分布模型,性比比例数据使用二项分布模型。建立模型后,根据模型的HF(残差/d f)值判定数据与泊松分布或二项分布的符合程度。较大的HF值(HF>1)意味着偏离泊松分布或二项分布,会导致显著性检验程度被高估;用近似泊松分布(quasipoisson)或近似二项分布(quasibinomial)进行模型拟合,对最后获得的模型用F检验进行分析[18]。其它分析使用SPSS11.5软件完成。
2 结果与分析
2.1 蝇蛹金小蜂交配行为
蝇蛹金小蜂雌雄蜂交配行为主要过程图1所示。在雄蜂搜寻发现雌蜂后,经历求偶、交尾前期、交尾和交尾后期,完成交配。
搜寻和求偶 实验条件下,雌蜂发现雄蜂的历时为(85.55±52.99)s;当雄蜂发现雌蜂后,震动翅膀追逐雌蜂,捕获雌蜂后,从雌蜂后面爬到雌蜂背上,整个求偶过程历时(41.21±83.16)s。
交尾前期 交尾前,雄蜂用前足抱握雌蜂的胸部,中和后足抱握雌蜂腹部,有时以后足支撑身体,并以触角不断敲打雌蜂的触角,短暂接触后,雌蜂打开生殖孔,交尾前期历时(26.05±17.99)s。
交尾 雌蜂打开生殖孔,雄蜂后退,将交配器插入雌蜂的生殖孔,并不停用触角敲打雌蜂的腹部。交尾期历时(2.62±0.62)s。
交尾后期 交尾结束后,雄蜂向前移动到交尾前期的位置,仍会继续用触角不断敲打雌蜂的触角,这时雌蜂的生殖孔仍处于打开状态。随后雌蜂开始爬行,摆脱雄蜂,交尾后期历时(30.43±11.44)s。
2.2 蝇蛹金小蜂交配次数对雌蜂后代繁殖的影响
雄蜂可以与多头雌蜂连续交配,雄蜂连续交配15次的雌蜂仍能产雌性后代,表明这时雄蜂仍能够提供精子。雄蜂交配第1、3、6、9、12 和15 次时,雌蜂寿命分别为(11.18±7.17)d、(10.82±8.51)d、(9.09±5.74)d、(9.36±4.74)d、(9.64±3.47)d 和(13.45±7.03)d,雌蜂产卵期历时分别为(9.73±7.52)d、(9.82±8.51)d、(7.55±5.20)d、(8.18±4.71 d)、(8.55±3.50)d 和(11.64±7.50)d(图 2)。雄蜂的交配次数对雌蜂的寿命并无显著影响(F5,60=0.73,P=0.61),对雌蜂的产卵期历时也无显著影响(F5,60=0.58,P=0.72)。
各交配次数时产卵者后代总产量分别为(57.00±39.15)、(50.18±35.52)、(44.18±24.62)、(42.55±15.69)、(47.27±18.23)和(62.09±37.55)头(图 3);单个产卵者所有后代的雄性百分比分别为(0.21±0.19)、(0.17±0.06)、(0.27±0.22)、(0.43±0.31)、(0.45±0.30)和(0.63±0.34)头。交配次数对后代总产量无显著影响(F1,578=0.26,P=0.61);但随雄蜂交配次数的增加,各产卵者的雌蜂后代总数量显著减少(r=-0.38,P<0.01),雄蜂后代总数量则显著增加(r=0.36,P<0.01),单个产卵者总后代的雄性百分比也随交配次数的增加而显著增大(r=0.52,P<0.01)。

图1 蝇蛹金小蜂交配行为主要阶段Fig.1 Main phases of mating behavior of P.vindemmiae
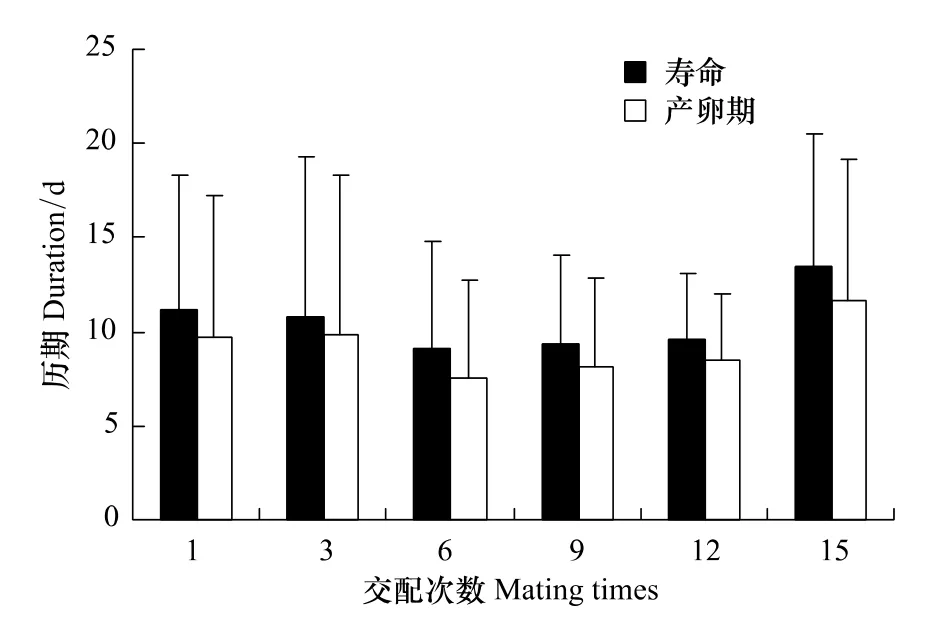
图2 蝇蛹金小蜂雄蜂各交配次数时雌蜂的寿命和产卵期Fig.2 Longevity and oviposition duration of P.vindemmiae females when mated with males mated different times
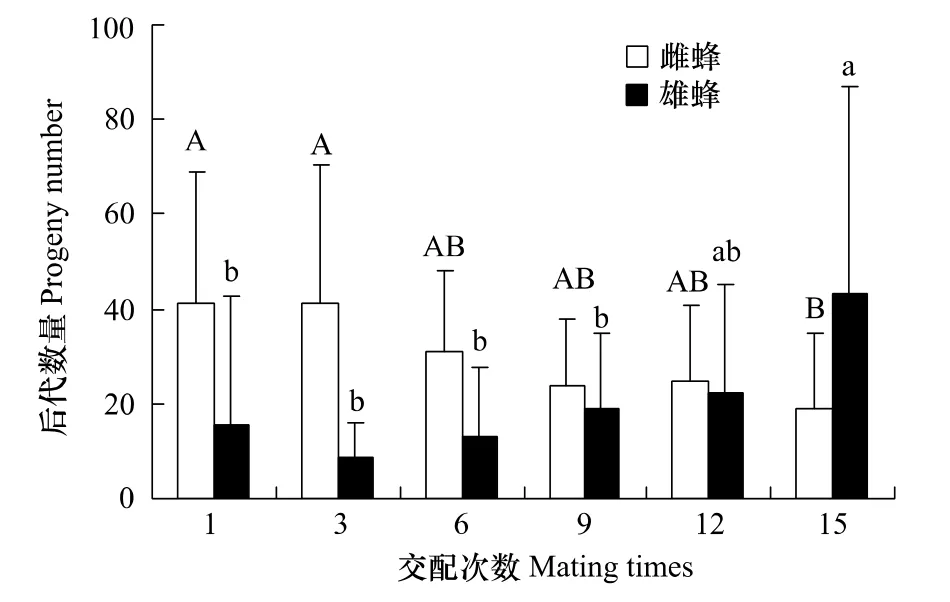
图3 蝇蛹金小蜂雄蜂各交配次数时后代数量Fig.3 Progeny number of P.vindemmiae females when mated with males mated different times
雄蜂交配第1、3、6、9、12和15次时,雌蜂日后代产量和性比如图4所示。在各交配次数下,日后代总数中,雄性百分比超过50%情况分别出现在第8、17、11、6、5和2天。后代雌蜂产量极显著地受亲代雄蜂交配次序的影响(F1,578=169.35,P<0.01),随亲代雄蜂的交配次数增加,后代雌蜂数量显著减少;亲代雌蜂日龄也对后代雌蜂产量有极显著影响(F1,577=563.17,P<0.01),随亲代雌蜂产卵期延长,后代雌蜂数量显著减少;交配次序和日龄间的交互作用对后代雄蜂产量存在极显著影响(F1,576=133.32,P<0.01),表明交配次序和雌蜂日龄的影响并不是独立的,亲代雄蜂的交配次数越多,产卵者后代雌蜂数量越显著地随产卵期延长而减少(图4)。
后代雄蜂产量受亲代雄蜂交配次序影响极显著(F1,578=223.08,P<0.01),随亲代雄蜂交配次数的增加,后代雄蜂数量显著增加;亲代雌蜂日龄也对后代雄蜂产量有显著影响(F1,577=4.10,P=0.04),在亲代雌蜂产卵后期,后代中雄蜂显著增多;交配次序和日龄间的交互作用对后代雄蜂产量有极显著影响(F1,576=8.25,P<0.01),在与已交配多次的雄蜂进行交配后,雌蜂后代的雄蜂数量更显著地增加(图4)。
蝇蛹金小蜂后代性比受亲代雄蜂交配次序影响极显著(F1,578=401.75,P<0.01),随亲代雄蜂交配次数的增加,后代雄性百分比极显著增加;亲代雌蜂日龄也对后代性比有极显著影响(F1,577=337.23,P<0.01),在亲代雌蜂产卵后期,后代雄性百分比显著增大;交配次序和日龄间的交互作用对后代性比有极显著影响(F1,576=48.29,P<0.01),在与多次交配的雄蜂进行交配后,雌蜂后代的雄性百分比更显著地增加(图4),雌蜂产卵期内更早地出现精子不足。
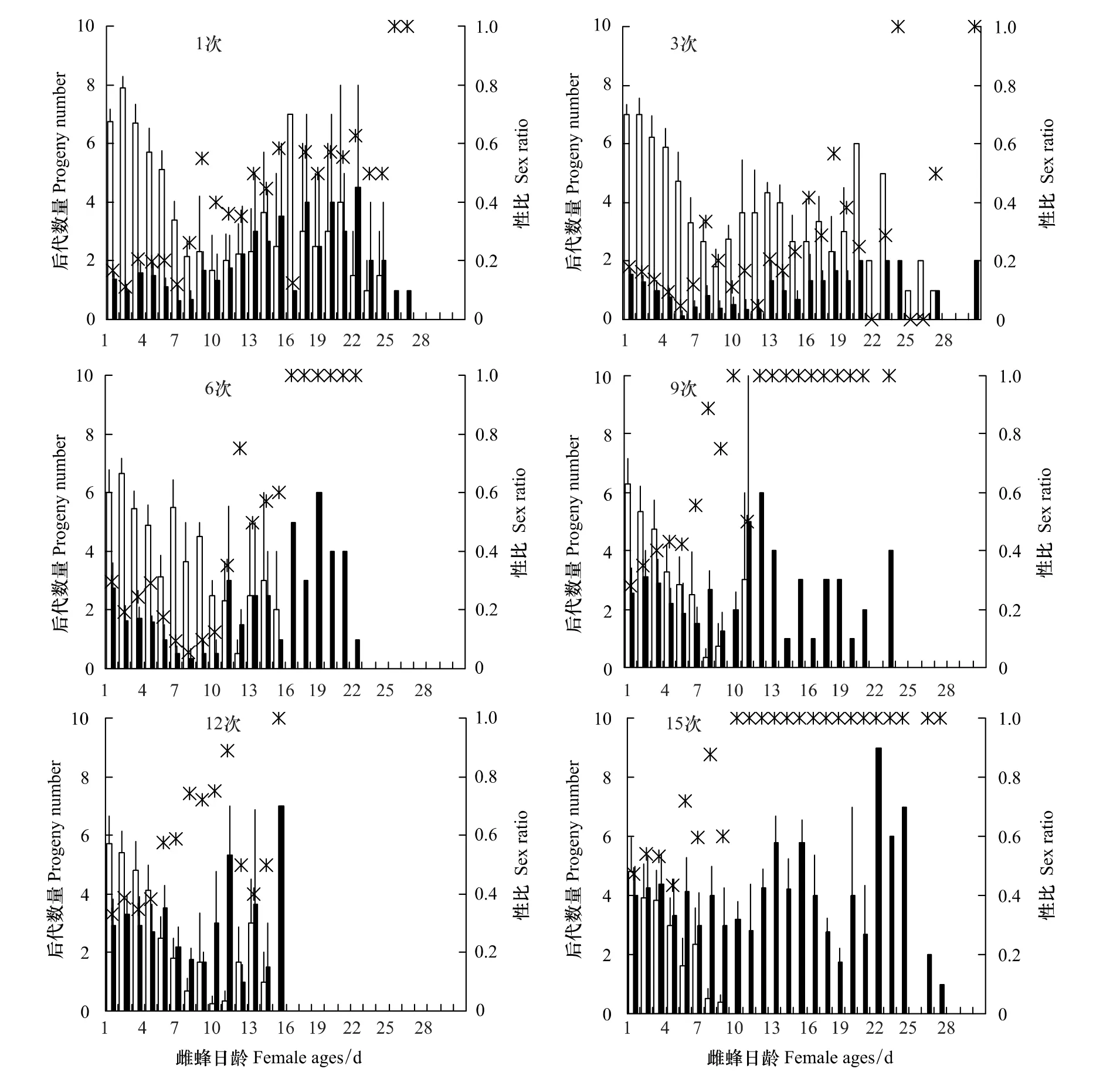
图4 蝇蛹金小蜂雄蜂各交配次数下雌蜂每天的后代数量和性比Fig.4 Daily progeny number and sex ratio of P.vindemmiae females when mated with males mated different times
2.3 蝇蛹金小蜂雌蜂的交配次数
雄蜂第2、4、7、10、13次交配的雌蜂在完成交配的10min后,所有雌蜂均不能与雄蜂再次完成交配(N=55);虽然雄蜂仍具有追逐已交配的雌蜂的行为,甚至能够爬到雌蜂的背上,但雌蜂的生殖孔不能再次打开。已交配的雌蜂产卵8 d后,再次给予未交配过的雄蜂时,所有雌蜂仍不能再次完成交配(N=44)。
3 讨论
随寄生蜂雄蜂交配次数的增加,交配时能提供给雌性的精子数量趋于减少[4-7,20-22]。佣小蜂Spalangia cameroni(Hymenoptera:Pteromalidae)雄蜂羽化后,体内的精子数量是固定的,不会再产生新的精子[19];但这些精子枯竭的雄性还能持续交配,从而导致与之交配的雌蜂体内精子数量的降低,引起产卵后期寄生蜂后代雄性比例的更显著增大[19-20]。与初次交配时体内精子数量相比,交配7次后,寄生蜂Trichogramma evanescens(Hymenoptera:Trichogrammatidae)雄蜂体内精子数量减少近一半,导致给予雌蜂精子不足,雌蜂的雄性后代增加[7]。本研究结果显示,随着蝇蛹金小蜂雄蜂交配次数的增加,与之交配的雌蜂后代雄性比例显著增大,雌蜂在产卵期中更早地出现精子不足;但精子不足的雄蜂仍能继续交配。
在雌雄交配策略方面,寄生蜂雄蜂一般可以同多个雌蜂进行交配,而一些种类的雌蜂常常仅能交配1次,这种现象在单寄生性(在单头寄主内产下单个卵)寄生蜂中可能更加普遍[3]。在单寄生性寄生蜂中,蝇蛹佣小蜂(S.endius)(Hymenoptera:Pteromalidae)雌蜂在一生中常常仅能交配1次,即使在产卵后期精子枯竭时[4-6];寄生蜂Lariophagus distinguendus(Hymenoptera:Pteromalidae)的大多数雌蜂一生仅能交配1次,少数的再次交配行为与雌蜂体内的精子数量并无相关性[21]。对聚寄生性(在单头寄主内产下多个卵)寄生蜂Cephalonomia hyalinipennis(Hymenoptera:Bethylidae)的研究表明,已交配的雌蜂可与雄蜂再次交配,但交配持续时间明显延长[22];聚寄生性寄生蜂丽蝇蛹集金小蜂(Nasonia vitripennis)(Hymenoptera:Pteromalidae)雌蜂也能够再次进行交配[23-24]。聚寄生性寄生蜂在单个寄主体内往往存在多头后代,并存在亲属间的竞争,雌蜂多次交配可能会有助于减少这种竞争;而这种竞争在单寄生性种类中并不存在,有助于单寄生性寄生蜂形成单次交配现象[3]。本研究结果也表明,在蝇蛹金小蜂交配完成后,所有雌蜂均不能与雄蜂再次完成交配;已交配的雌蜂产卵8d后,多数雌蜂后代中雄性百分比已经开始增加,表明雌蜂体内的精子已经减少,但雌蜂仍不能再次完成交配。可见,无论交配对象是否提供足够的精子以及精子是否出现不足,蝇蛹金小蜂雌蜂均仅能完成单次交配,其一生中可能仅能完成单次交配。
对于多数昆虫而言,雌性多次交配可以增加适合度[1]。然而,雌雄个体在交配时,常常具有不同交配倾向,导致性别间冲突产生[25-26]。对于雄性而言,其适合度主要体现在与高质量雌性进行交配的能力,它们进化形成多种策略来控制雌性的再次交配能力,并可能影响到雌性的后代产量和寿命[26-27],通过减少其它雄性与雌性的接触和交配,来实现自身利益最大化[26-28]。在受精时,雄性不仅仅传递精子,也包括一些雄性附属腺体分泌的肽聚糖等生物活性物质;这些物质降低了雌性的生理反应,产生对其它雄性的不应性,这种雄性交配主导地位可能是引起雌蜂单次交配行为产生的重要原因[29]。
[1] Arnqvist G,Nilsson T.The evolution of polyandry:multiple mating and female fitness in insects.Animal Behaviour,2000,60(2):145-164.
[2] Reynolds JD.Animal breeding systems.Trends in Ecology& Evolution,1996,11(2):68-72.
[3] Ridley M.Clutch size and mating frequency in parasitic hymenoptera.American Naturalist,1993,142(5):893-910.
[4] King B H,Fischer CR.Male mating history:effects on female sexual responsiveness and reproductive success in the parasitoid wasp Spalangia endius.Behavioural Ecology and Sociobiology,2010,64(4):607-615.
[5] King B H,Bressac C.No fitness consequence of experimentally induced polyandry in a monandrous wasp.Behaviour,2010,147(1):85-102.
[6] King B H,Saporito K B,Ellison JH,Bratzke RM.Unattractivenessof mated femalesto males in the parasitoid wasp Spalangia endius.Behavioral Ecology and Sociobiology,2005,57(4):350-356.
[7] Damiens D,Boivin G.Male reproductive strategy in Trichogramma evanescens:sperm production and allocation to females.Physiological Entomology,2005,30(3):241-247.
[8] Charnov E L.The theory of sex allocation.Princeton:Princeton University Press,1982.
[9] Godfray H C J.Parasitoids:behavioral and evolutionary ecology.Princeton:Princeton University Press,1994.
[10] Noyes J S.Interactive catalogue of world Chalcidoidea(CD-ROM).London:Taxapad and the Natural History Museum,2002.
[11] Wang X G,Messing R H.Two different life-history strategies determine the competitive outcome between Dirhinus giffardii(Chalcididae)and Pachycrepoideus vindemmiae(Pteromalidae),ectoparasitoids of cyclorrhaphous Diptera.Bulletin of Entomological Research,2004,94(5):473-480.
[12] Tormos J,Beitia F,Bockmann E A,Asis J D,Fernandez S.The preimaginal phases and development of Pachycrepoideus vindemmiae(Hymenoptera,Pteromalidae)on mediterranean fruit fly,Ceratitis capitata(Diptera,Tephritidae).Microscopy and Microanalysis,2009,15(5):422-434.
[13] Chen Z Z,Liu J B,He Z,Duan B S,Hu H Y.Strategies of Pachycrepoideus vindemmiae parasitizing pupae of houseflies.Chinese Journal of Applied Entomology,2011,48(6):1765-1769.
[14] Hu H Y,Chen Z Z,Duan B S,Zheng J T,Zhang T X.Effects of female diet and age on offspring sex ratio of the solitary parasitoid Pachycrepoideus vindemmiae(Rondani,1875)(Hymenoptera,Pteromalidae).Revista Brasileira de Entomologia,2012,56(2):259-262.
[15] He F Q.Massive rearing of the houseflies.Beijing:Jin Dun Publishing House,2006:39-67.
[16] King B H,Kuban K A.Should he stay or should he go:male influence on offspring sex ratio via postcopulatory attendance.Behavioral Ecology and Sociobiology,2012,66(8):1165-1173.
[17] R Development Core Team.R:A language and environment for statistical computing.R Foundation for Statistical Computing,Vienna,Austria.ISBN 3-900051-07-0,URL.http://www.R-project.org/.2011.
[18] Crawley M J.The R book.Chichester:John Wiley and Sons,2007.
[19] Gerling D,Legner E F.Developmental history and reproduction of Spalangia cameroni parasite of synanthropic flies.Annals of the Entomological Society of America,1968,61(6):1436-1443.
[20] King B H.Sperm depletion and mating behavior in the parasitoid wasp Spalangia cameroni(Hymenoptera:Pteromalidae).Great Lakes Entomologist,2000,33(2):117-127.
[21] Steiner S,Henrich N,Ruther J.Mating with sperm-depleted males does not increase female mating frequency in the parasitoid Lariophagus distinguendus.Entomologia Experimentalis et Applicata,2008,126(2):131-137.
[22] Pérez-Lachaud G.Reproductive costs of mating with a sibling male:sperm depletion and multiple mating in Cephalonomia hyalinipennis.Entomologia Experimentalis et Applicata,2010,137(1):62-72.
[23] Grillenberger B K,Van de Zande L,Bijlsma R,Gadau J,Beukeboom L W.Reproductive strategies under multiparasitism in natural populations of the parasitoid wasp Nasonia(Hymenoptera).Journal of Evolutionary Biology,2009,22(3):460-470.
[24] Burton-Chellew M N,Beukeboom L W,West S A,Shuker D M.Laboratory evolution of polyandry in the parasitoid wasp Nasonia vitripennis.Animal Behaviour,2007,74(5):1147-1154.
[25] Chapman T,Arnqvist Gr,Bangham J,Rowe L.Sexual conflict.Trends in Ecology and Evolution,2003,18(1):41-47.
[26] Snook R R.Sexual selection:conflict,kindness and chicanery.Current Biology,2001,11(9):R337-R341.
[27] Chapman T,Liddle L F,Kalb J M,Wolfner M F,Partridge L.Cost of mating in Drosophila melanogaster females is mediated by male accessory gland products.Nature,1995,373(6511):241-244.
[28] Zhu D H.Sperm competition and adaptive significance of prolonged post-copulatory mounting in Oxya yezoensis(Orthoptera:Catantopidae).Acta Ecologica Sinica,2004,24(1):84-88.
[29] Gillott C.Male accessory gland secretions:modulators of female reproductive physiology and behavior.Annual Review of Entomology,2003,48(1):163-184.
参考文献:
[13] 陈中正,刘继兵,贺张,段毕升,胡好远.蝇蛹金小蜂对家蝇蛹的寄生策略.应用昆虫学报,2011,48(6):1765-1769.
[15] 何凤琴.家蝇规模化养殖.北京:金盾出版社,2006.
[28] 朱道弘.小翅稻蝗的精子竞争及交配行为的适应意义.生态学报,2004,24(1):84-88.

