丹皮酚通过miR-21介导的p38MAPK信号通路下调氧化低密度脂蛋白诱导的大鼠血管内皮细胞肿瘤坏死因子-α释放
刘雅蓉,陈君君,戴 敏,苏祥飞,叶伊琳
(1.安徽中医药大学药学院 省部共建新安医学教育部重点实验室 安徽省中药研究与开发重点实验室,安徽合肥 230031;2.安徽中医药大学护理学院,安徽合肥 230038)
·实验研究·
丹皮酚通过miR-21介导的p38MAPK信号通路下调氧化低密度脂蛋白诱导的大鼠血管内皮细胞肿瘤坏死因子-α释放
刘雅蓉1,陈君君1,戴 敏1,苏祥飞1,叶伊琳2
(1.安徽中医药大学药学院 省部共建新安医学教育部重点实验室 安徽省中药研究与开发重点实验室,安徽合肥 230031;2.安徽中医药大学护理学院,安徽合肥 230038)
目的 观察微RNA-21(microRNA-21,miR-21)对p38丝裂原活化的蛋白激酶(p38mitogen-activated protein kinase,p38-MAPK)信号通路的调控作用,探究丹皮酚(paeonol,Pae)抑制血管内皮细胞(vascular endothelial cell,VEC)损伤的机制。方法 组织块预消化贴壁法培养大鼠VEC;氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)诱导VEC的损伤;用HiPerFect试剂将miR-21模拟物或抑制剂转染进入VEC;免疫印迹法检测p38MAPK信号通路相关蛋白的表达;酶联免疫吸附试验检测VEC中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的水平。结果 ox-LDL明显提高VEC中Ras、p-MKK3/6、p-p38蛋白表达水平,并诱导VEC分泌TNF-α;miR-21高表达可升高TNF-α水平及Ras、p-MKK3/6、p-p38蛋白表达水平;Pae明显降低损伤的VEC分泌TNF-α水平,且抑制由miR-21高表达引起的TNF-α水平上升及p38MAPK信号通路的激活。结论 Pae可抑制miR-21介导的p38MAPK信号通路,减少ox-LDL诱导的VEC中TNF-α的分泌。
丹皮酚;氧化低密度脂蛋白;血管内皮细胞;miR-21;p38MAPK
在动脉粥样硬化(atherosclerosis,AS)的发生发展过程中,血管内皮细胞(vascular endothelial cell,VEC)功能失调和损伤是AS形成的始动环节[1],氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)是公认的致VEC损伤的危险性因子之一[2]。微RNA-21(microRNA-21,miR-21)作为一种具有显著抗癌细胞凋亡作用的特殊微RNA,在肿瘤领域尤其引人关注。新近发现,miR-21在心血管领域也具有重要的作用,与血管炎性反应密切相关[3]。本课题组已有研究表明,ox-LDL可以诱导miR-21的表达,造成VEC的炎性损伤,但是,miR-21是否参与调控VEC的炎性损伤以及其损伤机制尚不清楚。
丹皮酚(paeonol,Pae)是毛茛科植物牡丹Paeonia Suffruticoas Andr.的干燥根皮及萝摩科植物徐长卿Cynanchum paniculatum(Bge.)Kitag.的干燥根及根茎中的有效成分之一。经过大量实验证实,Pae抑制家兔AS 模型的斑块局部炎性因子肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白细胞介素-1β(interleukin-1beta,IL-1β)的释放,减轻斑块局部炎性反应[4],明显降低由ox-LDL诱导VEC的丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)通路中MAPK8(别名JNK1/2)、MAPK14(别名p38)和MAPK1/3(别名ERK1/2)的磷酸化水平,下调ox-LDL引起的VEC中miR-21高表达,而Pae对MAPK信号通路的影响及其抗炎作用的发挥是否与调控miR-21水平有关,还需进一步验证。本实验以VEC的miR-21为切入点,阐明Pae抗炎作用的分子机制,从而为研究Pae抗AS的新靶点提供科学依据。
1 材料
1.1 实验动物 健康Sprague-Dawley(SD)雄性大鼠,清洁级,体质量(160±10)g,安徽医科大学实验动物中心提供,生产许可证号:SCXK(皖)2011-0015。
1.2 药物与试剂 Pae:安徽省宣城百草植物工贸有限公司生产,纯度99%;ox-LDL:广州奕源生物科技有限公司;达尔伯克改良伊格尔培养基(Dulbecco's modified Eagle's medium,DMEM):美国Gibco公司,批号12000-038;特级胎牛血清(fetal bovine serum,FBS):天津市灏洋生物制品科技责任有限公司;鼠抗β-actin(批号AP0060)、兔抗Ras抗体(批号BS1788)、兔抗MKK3/6抗体(批号BS1227)、兔抗p-MKK3/6抗体(批号BS6407)、兔抗p38抗体(批号BS1681)、兔抗p-p38抗体(批号BS3736):美国Bioworld科技公司;辣根过氧化酶(horse-radish peroxidase,HRP)标记山羊抗小鼠IgG(批号ZB2305)、HRP标记山羊抗兔IgG(批号ZB2301):北京中杉金桥生物技术有限公司;蛋白质分子质量标准(protein molecular weight marker):美国Thermo公司;p38MAPK抑制剂SB203580:上海碧云天生物技术研究所;miR-21抑制剂、miR-21模拟物、Hiperfect转染试剂:德国QIAGEN公司;TNF-α酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒:美国Biosource公司。
1.3 主要仪器 MCO-175型CO2培养箱:日本Sanyo公司;SW-CJ-1F型洁净工作台:江苏苏净集团安泰公司;CK2型倒置显微镜:日本Olympus公司;ELX800uv酶标仪:美国Bio-TEK公司;Hoefer电泳仪:美国Amersham Biosciences公司。
2 方法
2.1 大鼠主动脉VEC的分离、培养与鉴定[5]大鼠处死后,用乙醇浸泡30min,无菌条件下取出胸主动脉放入装有DMEM基础培养液的培养皿中,用镊子小心剥离血管外结缔组织及脂肪组织,用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗干净后,移入另一新鲜培养液的培养皿中,将血管外翻,使内膜暴露,灭菌线将血管两端折入结扎,培养液冲洗内膜。将血管放入装有0.2%的Ⅰ型胶原酶的小瓶中,放入37℃、5%CO2培养箱培养消化1h,用含20%FBS的DMEM培养液轻轻漂洗2次,用眼科剪将主动脉血管剪成2mm×2mm小块,按其内膜朝下贴入鼠尾胶原包被的培养瓶中,并加入1ml含20%FBS的DMEM培养液,置37℃、5%CO2培养箱培养,12h后补加培养液1ml。采用免疫细胞化学链霉菌抗生物素蛋白-过氧化酶连结法(streptavidin-peroxidase,S-P)鉴定VEC胞浆内Ⅷ因子相关抗原[6]。
2.2 转染miR-21抑制剂或模拟剂 miR-21模拟剂和抑制剂由QIAGEN公司设计并化学合成,加入50μl二乙基焦磷酰胺(diethyl pyrocarbonate,DEPC)水于1nmol模拟剂或抑制剂中,配制成浓度为20μmol/L的溶液,充分混匀,-80℃保存备用。取3~5代VEC,以1×105/ml接种于6孔板中,每孔培养基体积为2ml,置于CO2培养箱中常规培养。根据试剂盒规定的转染浓度,取0.6μl miR-21模拟剂和(或)6μl miR-21抑制剂稀释于400μl无血清培养基中,使其终浓度为5nmol/L,再加入3μl Hiperfect转染试剂于模拟剂和(或)抑制剂中,涡旋混匀,室温孵育10min使其形成复合物。将形成的复合物滴加入之前接种的细胞中,轻轻晃动6孔板,使复合物分布均匀,将6孔板置于培养箱中常规培养,24h时更换培养基,进行分组干预。
2.3 实验分组及给药 将VEC以1×105/ml接种于6孔板中。正常对照组:用含20%FBS的正常DMEM培养;ox-LDL组:用含20%FBS的正常DMEM培养24h后,加入终浓度为20μg/ml ox-LDL的DMEM培养24h;miR-21模拟剂组:接种细胞的同时以终浓度为5nmol/L的miR-21模拟剂作用24h,再加入ox-LDL作用24h;miR-21抑制剂组:接种细胞的同时以终浓度为50nmol/L的miR-21抑制剂作用24h,再加入ox-LDL作用24h;Pae组:先加入Pae终浓度为120μmol/L的培养液作用24h,再加入ox-LDL作用24h;Pae+miR-21模拟剂组:转染miR-21模拟剂后,加入Pae终浓度为120μmol/L的培养液作用24h,再加入ox-LDL作用24h;Pae+miR-21抑制剂组:转染miR-21抑制剂后,加入Pae终浓度为120μmol/L的培养液作用24h,再加入ox-LDL作用24h;SB203580组:先加入终浓度为20μmol/L的抑制剂SB203580孵育2h,吸弃培养液,再加入ox-LDL作用24h。
2.4 ELISA法检测TNF-α 吸取上述各组细胞上清液备用。将标准品依次稀释为40、80、160、320、640ng/L。空白对照孔只加显色剂A&B和终止液,其余各步骤操作相同;标准品孔:加入50μl标准品,50μl链霉素-HRP;待测样品孔:加入各细胞上清液样品40μl,然后各加入抗TNF-α抗体10μl、链霉亲和素-HRP 50μl,每组样品设置3个复孔,盖上封板膜,轻轻振荡混匀,37℃温育60min。经过洗涤、显色及终止反应后,采用酶标仪在450nm波长下测量各孔的光密度(optical density,OD)值,根据标准品的浓度及对应的OD值绘制标准曲线,根据样品的OD值计算出对应的样品浓度。
2.5 Western blotting检测p38MAPK通路蛋白变化 细胞裂解液提取上述各组细胞总蛋白,二辛可酸(bicinchoninic acid,BCA)蛋白定量试剂盒进行蛋白定量,15%、10%分离胶和5%浓缩胶进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),然后将蛋白转至硝酸纤维素(nitrocellulose,NC)膜。5%脱脂奶粉常温封闭4h后,用磷酸盐吐温缓冲液(phosphate buffered saline Tween-20,PBST)洗涤3遍,每次10min。将NC膜放入一抗稀释液稀释的一抗中,4℃孵育过夜。用PBST洗3遍,每次10min。加入脱脂奶粉稀释的二抗IgG-HRP,室温孵育2h。用PBST洗3遍,每次10min,用化学发光(electrochemical luminescence,ECL)试剂显影,凝胶成像系统采集图片。
2.6 统计学方法 采用SPSS 17.0进行统计学处理,呈正态分布的连续型变量以“均数±标准差(±s)”进行统计学描述,多组间均数比较采用单因素方差分析,两组间均数比较采用LSD检验,P<0.05为差异有统计学意义。
3 结果
3.1 VEC形态学观察及鉴定 倒置显微镜下显示,原代培养的VEC呈单层铺路石样紧密排列,细胞边缘光滑,胞核清晰。Ⅷ因子相关抗原鉴定结果显示,镜下细胞胞浆呈棕黄色,即呈阳性反应,VEC细胞纯度达到95%以上。见图1。
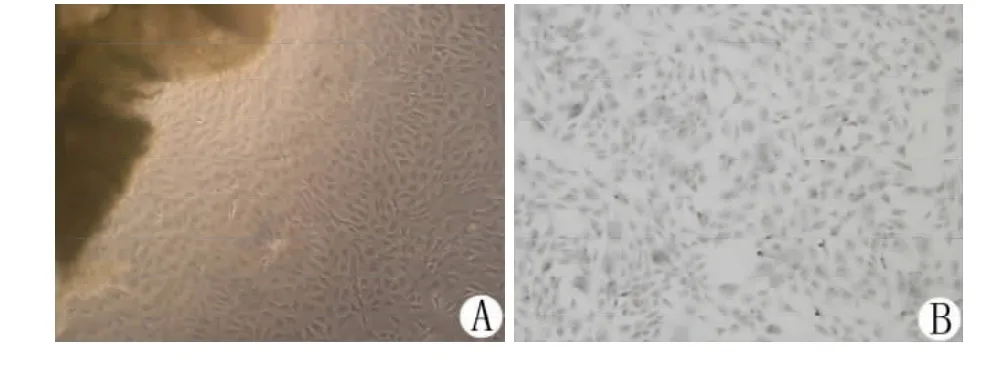
图1 VEC形态学观察及鉴定(10×10倍)
3.2 miR-21对TNF-α分泌的调控 与正常对照组比较,ox-LDL显著上调TNF-α的水平(P<0.01);与ox-LDL组比较,miR-21模拟剂组TNF-α的水平显著升高(P<0.01),miR-21抑制剂组TNF-α的水平显著降低(P<0.01)。表明在VEC中,ox-LDL可诱导VEC中TNF-α水平升高,且miR-21高表达可引起TNF-α水平的升高,miR-21的低表达可抑制TNF-α的分泌,即miR-21介导了ox-LDL引起的VEC炎症因子释放。见表1。
表1 miR-21对ox-LDL介导的VEC中TNF-α分泌的影响(n=3,±s)

表1 miR-21对ox-LDL介导的VEC中TNF-α分泌的影响(n=3,±s)
注:与正常对照组比较,**P<0.01;与ox-LDL组比较,##P<0.01。
组 别TNF-α/(ng/L)351.6±21.4 ox-LDL 467.9±10.8**miR-21模拟剂506.2±24.4##miR-21抑制剂367.1±7.4正常对照##
3.3 miR-21对p38MAPK信号通路的调控 与正常对照组比较,ox-LDL显著上调Ras、p-MKK3/6及p-p38蛋白表达水平(P<0.01);与ox-LDL组比较,miR-21模拟剂组Ras、p-MKK3/6及p-p38蛋白表达水平均显著增高(P<0.05),miR-21抑制剂组Ras、p-MKK3/6及p-p38蛋白表达水平均显著降低(P<0.01)。表明ox-LDL可通过上调miR-21的表达水平激活VEC中p38MAPK信号通路。见图2、图3。
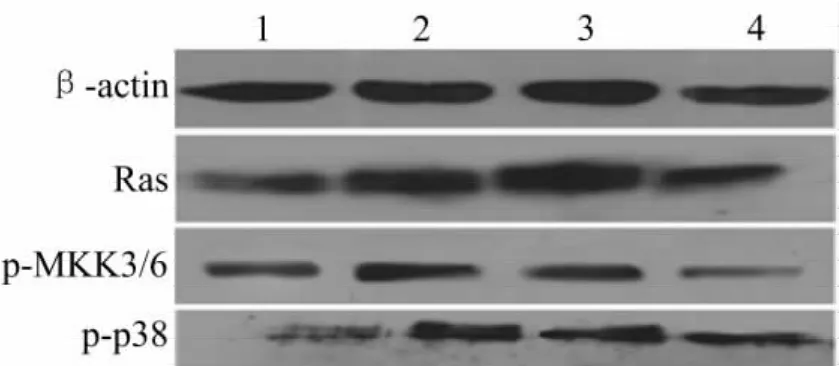
图2 miR-21对p38MAPK信号通路相关蛋白表达水平的影响(Western blotting法)
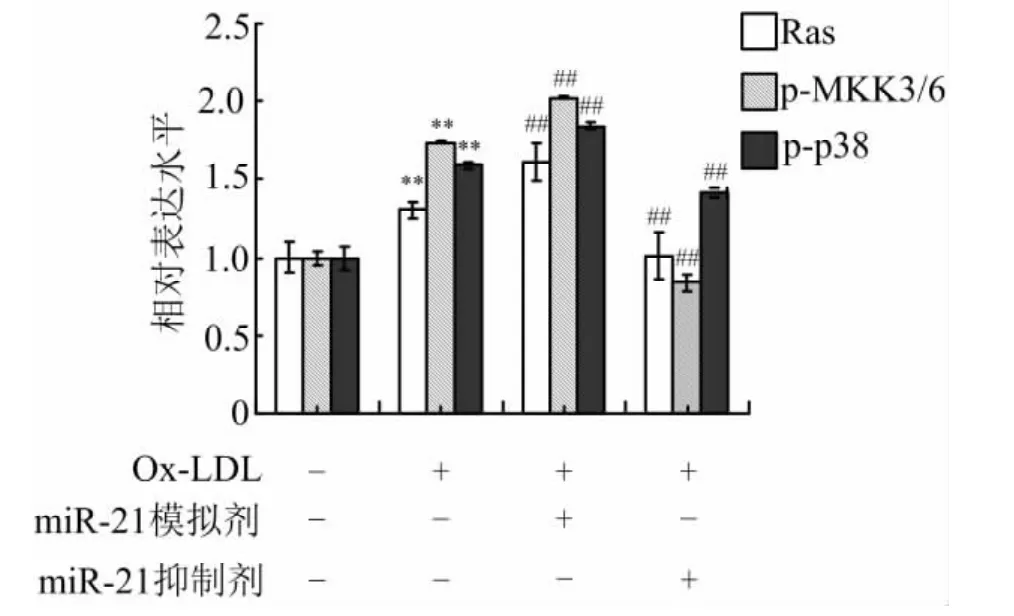
图3 miR-21对p38MAPK信号通路相关蛋白相对表达水平的影响
3.4 Pae对miR-21调控TNF-α水平的影响 与正常对照组比较,ox-LDL组TNF-α水平显著增加(P<0.0 1);与ox-LDL组比较,Pae组、miR-2 1模拟剂+Pae组、miR-2 1抑制剂+Pae组以及SB2 0 3 5 8 0组TNF-α水平均显著降低(P<0.0 5,或P<0.0 1)。这些结果表明Pae可以抑制ox-LDL引起的TNF-α高表达,并且p3 8 MAPK信号通路参与调控TNF-α的分泌,同时Pae可以反转miR-2 1模拟剂对TNF-α的升高作用,Pae与miR-2 1抑制剂合用更显著抑制TNF-α的分泌,说明Pae通过调控miR-2 1的表达水平,进一步抑制TNF-α的分泌。见表2。
表2 Pae对miR-21调控TNF-α水平的影响(n=3,±s)
注:与正常对照组比较,**P<0.01;与ox-LDL组比较,#P<0.05,##P<0.01。
组 别TNF-α/(ng/L)361.6±21.4 ox-LDL 467.9±10.8**Pae 355.6±13.9##miR-21模拟剂+Pae 391.3±18.2#miR-21抑制剂+Pae 303.9±16.2##SB203580 372.5±22.3正常对照##
3.5 Pae对miR-21调控p38MAPK信号通路的影响 与正常对照组比较,ox-LDL组Ras、p-MKK3/6及p-p38蛋白的表达水平显著增加(P<0.01);与ox-LDL组比较,Pae组、miR-21模拟剂+Pae组、miR-21抑制剂+Pae组以及ox-LDL+SB203580组Ras、p-MKK3/6及p-p38蛋白的表达水平均显著降低(P<0.05,或P<0.01)。这些结果表明Pae与SB203580的作用相似,可以抑制p38MAPK信号通路的活化,同时Pae可以反转miR-21模拟剂对p38MAPK信号通路的活化作用,Pae与miR-21抑制剂合用对ox-LDL激活的p38MAPK信号通路有更显著的抑制作用,进一步说明Pae是通过调控miR-21的表达水平,抑制p38MAPK信号通路,最终抑制TNF-α的分泌。见图4、图5。
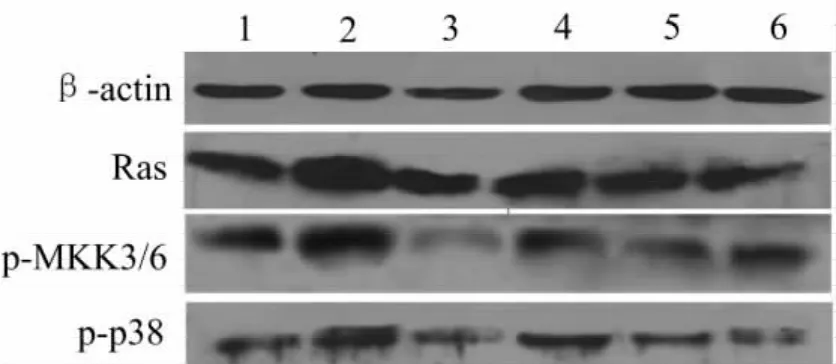
图4 Pae对miR-21调控p38MAPK信号通路相关蛋白表达水平的影响(Western blotting法)
4 讨论
VEC功能失调和损伤是AS形成的始动环节,而血液中低密度脂蛋白(low density lipoprotein,LDL)进入内皮下被氧化修饰成为ox-LDL是AS发生发展过程中最主要的促炎症因素[7]。本课题组前期研究显示,ox-LDL与VEC共孵育可使细胞形态发生显著改变,细胞抑制率明显上升,表明ox-LDL可导致VEC的损伤与功能失调[8],并且ox-LDL刺激浓度为20μg/ml,作用时间为24h时,细胞抑制率达到50%;Pae 60、120、240μmol/L可提高细胞存活率[9],且当浓度为120μmol/L时显著降低miR-21的表达。故本实验选用ox-LDL 20μg/ml作用24h诱导VEC损伤体外细胞模型,选用Pae 120μmol/L预保护24h进行分子机制研究。
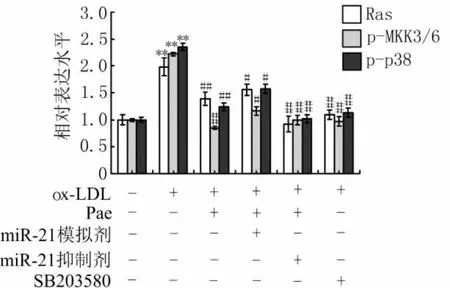
图5 Pae对miR-21调控p38MAPK信号通路相关蛋白相对表达水平的影响
微RNA(microRNAs,miRs)是一类由内源基因编码的18~22个碱基长度的非编码单链RNA分子,与细胞炎性反应关系密切,并发展为人类疾病的诊断和治疗的一种新方法[10-11]。其中,miR-21在心脑血管疾病中,特别是AS的发生发展过程中发挥重要作用[12]。研究表明,miR-21在人脐静脉内皮细胞和损伤的大鼠VEC中均有较高表达[13],并参与内膜的修复,miR-21的下调则会引起新生内膜的形成减少[14]。从课题组前期实验结果得知,ox-LDL可以显著上调VEC中miR-21表达,在本研究中,miR-21的高表达可引起TNF-α水平的升高,miR-21的低表达可抑制TNF-α的分泌,说明miR-21介导ox-LDL引起的VEC炎性因子释放。而前期研究已表明,Pae可以下调VEC中ox-LDL引起的miR-21高表达,结合本实验结果,进一步提示,Pae通过调控miR-21的表达水平,抑制ox-LDL诱导的TNF-α表达。
miR-21可以通过mRNA剪切和抑制蛋白翻译的方式负调控靶基因[15],大量研究表明磷酸酶和张力蛋白同源基因(phosphatase and tensin homolog,PTEN)是miR-21的下游靶基因[16-18],编码的PTEN蛋白具有脂质磷酸酶活性和蛋白磷酸酶活性,可与酪氨酸和丝氨酸/苏氨酸蛋白激酶竞争共同底物,使自身去磷酸化,从而抑制酪氨酸和丝氨酸/苏氨酸介导的信号转导过程。p38MAPK信号通路是酪氨酸和苏氨酸介导的信号转导通路,与炎性反应密切相关[19],其级联反应由Ras、MKK3/6和p38MAPK 3种激酶构成一个连续的蛋白激酶反应链。miR-21的高表达负调控PTEN基因,使PTEN蛋白水平下降,导致p38MAPK信号通路激活,活化的p38MAPK通过上调某些转录因子基因的表达和生物活性,影响细胞炎性反应,使细胞因子如TNF-α大量释放[20]。本实验研究发现,miR-21可以调控p38MAPK信号通路的传导,影响炎性因子TNF-α的释放。Pae可能通过下调miR-21水平,抑制p38MAPK信号通路,最终减少炎性因子TNF-α的释放。
[1]Gao Y,Liu C,Zhang X,et al.Circulating endothelial cells as potential markers of atherosclerosis[J].Can J Neurol Sci,2008,35(5):638-642.
[2]Pirillo A,Catapano AL.Soluble lectin-like oxidized low density lipoprotein receptor-1as a biochemical marker for atherosclerosis-related diseases[J].Dis Markers,2013,35(5):413-418.
[3]Jazbutyte V,Thum T.MicroRNA-21:From cancer to cardiovascular disease[J].Curr Drug Targets,2010,11:926-935.
[4]Li H,Dai M,Jia W.Paeonol attenuates high-fat-dietinduced atherosclerosis in rabbits by anti-inflammatory activity[J].Planta Med,2009,75:7-11.
[5]潘礼龙,戴敏,王伟.大鼠主动脉内皮细胞原代培养的研究[J].中国药理学通报,2007,23(3):411.
[6]张步春,王安才,李利芳,等.血管内皮细胞体外培养方法的实验研究[J].实用医学杂志,2009,25(7):1048-1049.
[7]Badrnya S,Butler LM,Söderberg-Naucler C,et al.Platelets directly enhance neutrophil transmigration in response to oxidised low-density lipoprotein[J].Thromb Haemost,2012,108(4):719-729.
[8]Wang YQ,Dai M,Zhong JC,et al.Paeonol inhibits oxidized low density lipoprotein-induced monocyte adhesion to vascular endothelial cells by inhibiting the mitogen activated protein kinase pathway[J].Biol Pharm Bull,2012,35(5):767-772.
[9]李笑春,戴敏,陈鹏.丹皮酚对高脂血清诱导的大鼠主动脉内皮细胞损伤的保护作用及其黏附功能的影响[J].安徽中医学院学报,2010,29(1):53-57.
[10]Erson AE,Petty EM.MicroRNAs in development and disease[J].Clin Genet,2008,74(4):296-306.
[11]Kim T,Reitmair.Non-coding RNAs:functional aspects and diagnostic utility in oncology[J].Int J Mol Sci,2013,14(3):4934-4968.
[12]Jazbutyte V,Thum T.MicroRNA-21:from cancer to cardiovascular disease[J].Curr Drug Targets,2010,11:926-935.
[13]Weber M,Baker MB,Moore JP,et al.MiR-21is induced in endothelial cells by sheer stress and modulates apoptosis and eNOS acting[J].Biochem Biophys Res Commun,2010,393(4):643-648.
[14]Zeng J,Xiong Y,Li G,et al.MiR-21is overexpressed in response to high glucose and protects endothelial cells from apoptosis[J].Exp Clin Endocrinol Diabetes,2013,121(7):425-430.
[15]Fabian MR,Sonenberg N.The mechanics of miRNA-mediated gene silencing:a look under the hood of miRISC[J].Nat Struct Mol Biol,2012,19(6):586-593.
[16]Zhang BG,Li JF,Yu BQ,et al.microRNA-21promotes tumor proliferation and invasion in gastric cancer by targeting PTEN[J].Oncol Rep,2012,27(4):1019-1026.
[17]Liu CZ,Liu W,Zheng Y,et al.PTEN and PDCD4 are bona fide targets of microRNA-21in human cholangiocarcinoma[J].Chin Med Sci J,2012,27(2):65-72.
[18]Qin X,Yan L,Zhao X,et al.microRNA-21overexpression contributes to cell proliferation by targeting PTEN in endometrioid endometrial cancer[J].Oncol Lett,2012,4:1290-1296.
[19]李刚,黎介寿,祁小平.p38丝裂原活化蛋白激酶信号级联在炎症反应中的作用[J].医学研究生学报,2004,17(8):737-740.
[20]Huang J,Lin Z,Luo M,et al.Sinomenine suppresses TNF-alpha-induced VCAM-1expression in human umbilical vein endothelial cells[J].Ethnopharmacol,2007,114(2):180-185.
Paeonol Reduces Release of TNF-αin Vascular Endothelial Cells Induced by Oxidized Low-Density Lipoprotein through microRNA-21-mediated p38 MAPK Pathway
LIU Ya-rong1,CHEN Jun-jun1,DAI Min1,SU Xiang-fei1,YE Yi-lin2
(1.School of Pharmacy,Anhui University of Chinese Medicine &Key Laboratory of Xin'an Medicine Jointly Supported by Ministry of Education and Anhui Province &Anhui Province Key Laboratory of Reserch and Development of Chinese Medicine,Anhui Hefei 230031,China;2.School of Nursing,Anhui University of Chinese Medicine,Anhui Hefei 230038,China)
Objective To observe the regulatory effect of microRNA-21(miR-21)on the p38mitogen-activated protein kinase(p38MAPK)pathway and to investigate the molecular mechanism by which paeonol(Pae)inhibits injury of vascular endothelial cells(VECs).Methods VECs were isolated from rat thoracic aortas by collagenase digestion and adherent culture and then injured by oxidized low-density lipoprotein(ox-LDL);the cells were transfected with miR-21 mimic or inhibitor using a HiPerFect transfection reagent.The protein expression of Ras,p-MKK3/6,and p-p38was measured by Western blotting;the level of tumor necrosis factor-α(TNF-α)in VECs was measured by enzyme-linked immunosorbent assay.Results The ox-LDL significantly increased the protein expression of Ras,p-MKK3/6,and pp38and induced secretion of TNF-αin VECs.Enhanced miR-21expression increased the level of TNF-αand protein expression of Ras,p-MKK3/6,and p-p38.Pae significantly reduced the release of TNF-αin injured VECs and inhibited the increase in TNF-αlevel and activation of p38MAPK pathway caused by enhanced miR-21expression.Conclusion Pae can inhibit the miR-21-mediated p38MAPK pathway and reduce ox-LDL-induced release of TNF-αin VECs.
paeonol;oxidized low-density lipoprotein;vascular endothelial cell;microRNA-21;p38MAPK
R285.5
A
10.3969/j.issn.2095-7246.2014.01.020
2013-11-26)
国家自然科学基金项目(81073090,81274134);安徽中医药大学研究生科技创新基金(2013zd003)
刘雅蓉(1989-),女,硕士研究生
戴敏,daiminliao@163.com

