知母皂苷类化合物及其结构修饰研究进展
付之文,吴 斌,薛 睿
(1.上海中医药大学附属曙光医院,上海 201203;2.中国科学院上海药物研究所,上海 201203)
知母皂苷类化合物及其结构修饰研究进展
付之文1,2,吴 斌2,薛 睿2
(1.上海中医药大学附属曙光医院,上海 201203;2.中国科学院上海药物研究所,上海 201203)
知母皂苷是知母中的重要药效成分,其具有改善记忆力、抑制血小板聚集、抗氧化和降血糖等药理作用。综述近年来关于知母皂苷类化学成分及其结构修饰的研究进展,为知母皂苷及其他甾体皂苷类化合物的研究提供科学依据。
知母皂苷;化学成分;结构修饰;研究进展
1 背景介绍
知母为百合科植物知母AnemarrhenaasphodeloidesBge.的干燥根茎[1],始载于《诗经·尔雅》,《神农本草经》中将其列为中品良药。其味苦、甘,性寒,归肺、胃、肾经,具有清热泻火、滋阴润燥等功效[2],临床上主要用于外感热病、高热烦渴、肺热燥咳、骨蒸潮热、内热消渴、肠燥便秘的治疗。甾体皂苷是知母的重要有效成分之一,其在知母中含量高,种类也较多,迄今为止已经被分离鉴定的甾体皂苷有60多种。近年来,国内外各研究者针对知母皂苷进行了多项药理活性研究,发现其在改善老年痴呆症状、抗动脉粥样硬化、抗血小板聚集以及改善骨质疏松等方面有显著作用[3]。因此,将知母皂苷作为新药进行研究和开发十分必要,具有很好的应用前景。
2 知母皂苷类成分化学结构与分类
甾体皂苷(Steroidal Saponins)是一类螺旋甾烷类化合物与糖结合的寡糖苷,常见的糖有葡萄糖、半乳糖、木糖、阿拉伯糖、鼠李糖以及岩藻糖等。糖多与苷元C3-OH结合成苷,苷元由27个碳原子组成。知母皂苷的基本骨架为螺旋甾烷及其衍生物,主要有15种常见类型,相关基本母核以及糖取代基类型如图1所示。
其中40种有代表性的知母皂苷的化学结构信息如表1所示。
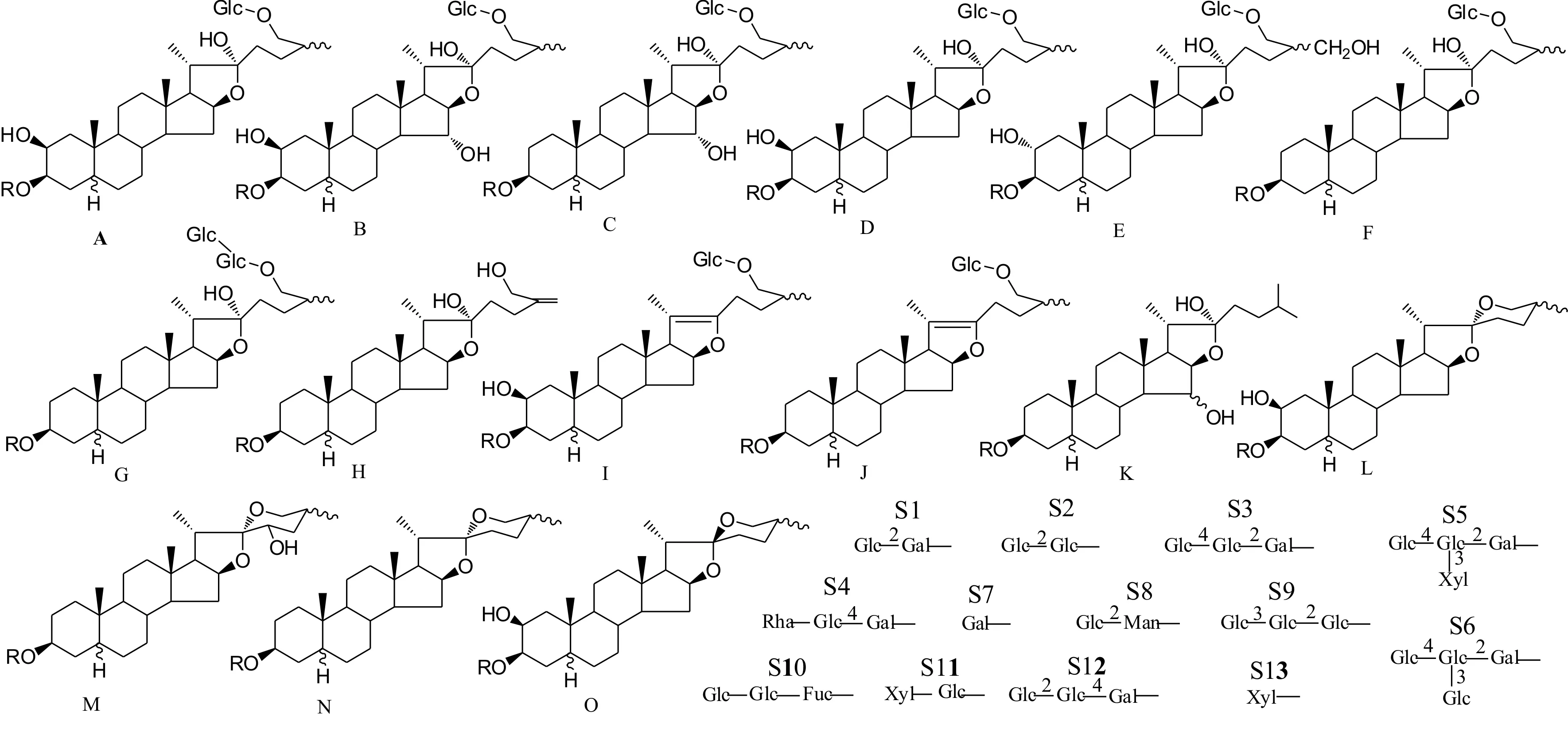
图1 知母甾体皂苷成分基本母核骨架以及糖取代基类型
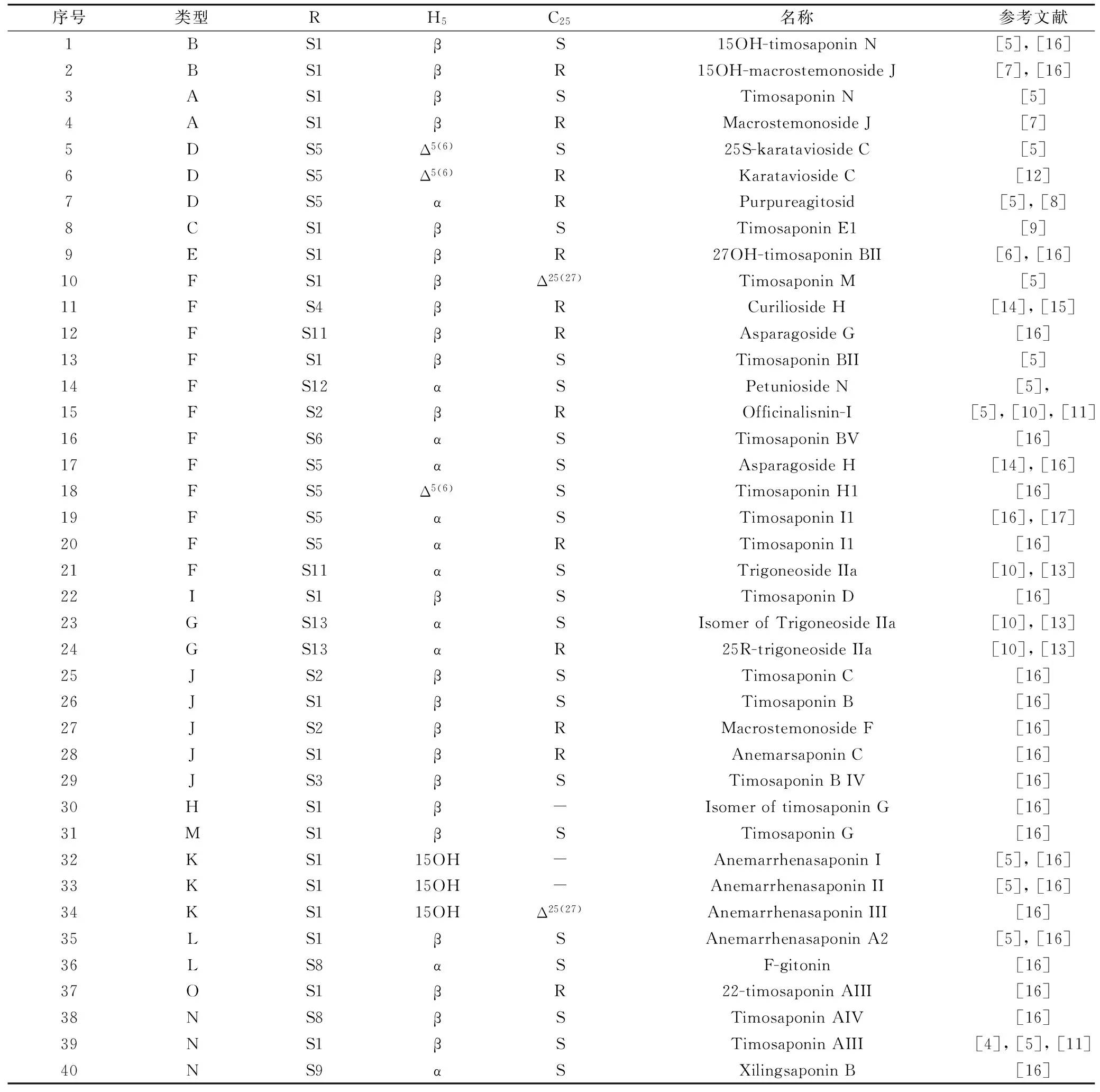
序号类型RH5C25名称参考文献1BS1βS15OH-timosaponinN[5],[16]2BS1βR15OH-macrostemonosideJ[7],[16]3AS1βSTimosaponinN[5]4AS1βRMacrostemonosideJ[7]5DS5Δ5(6)S25S-karataviosideC[5]6DS5Δ5(6)RKarataviosideC[12]7DS5αRPurpureagitosid[5],[8]8CS1βSTimosaponinE1[9]9ES1βR27OH-timosaponinBII[6],[16]10FS1βΔ25(27)TimosaponinM[5]11FS4βRCuriliosideH[14],[15]12FS11βRAsparagosideG[16]13FS1βSTimosaponinBII[5]14FS12αSPetuniosideN[5],15FS2βROfficinalisnin-I[5],[10],[11]16FS6αSTimosaponinBV[16]17FS5αSAsparagosideH[14],[16]18FS5Δ5(6)STimosaponinH1[16]19FS5αSTimosaponinI1[16],[17]20FS5αRTimosaponinI1[16]21FS11αSTrigoneosideIIa[10],[13]22IS1βSTimosaponinD[16]23GS13αSIsomerofTrigoneosideIIa[10],[13]24GS13αR25R-trigoneosideIIa[10],[13]25JS2βSTimosaponinC[16]26JS1βSTimosaponinB[16]27JS2βRMacrostemonosideF[16]28JS1βRAnemarsaponinC[16]29JS3βSTimosaponinBIV[16]30HS1β-IsomeroftimosaponinG[16]31MS1βSTimosaponinG[16]32KS115OH-AnemarrhenasaponinI[5],[16]33KS115OH-AnemarrhenasaponinII[5],[16]34KS115OHΔ25(27)AnemarrhenasaponinIII[16]35LS1βSAnemarrhenasaponinA2[5],[16]36LS8αSF-gitonin[16]37OS1βR22-timosaponinAIII[16]38NS8βSTimosaponinAIV[16]39NS1βSTimosaponinAIII[4],[5],[11]40NS9αSXilingsaponinB[16]
3 知母皂苷类化合物结构修饰
在药物研发过程中,有些新药虽然药理作用显著,但一些影响其疗效发挥的因素,如体内药代动力学过程欠佳、毒副作用过大或药物本身稳定性差等,往往成为制约药物正常研发的重大障碍。因此,我们很有必要对该类物质的结构进行适当修饰,以期改善上述不利因素,开发出更适合临床使用的新药。
知母皂苷具有广泛的药理活性,如防治老年痴呆症[18]、改善脑缺血损伤[19]、抗凝血[20]、抗氧化[21]、抗肿瘤[22]、抗骨质疏松[23]等,均已有文献报道,其开发利用具有广泛的市场前景。然而,从知母中直接分离得到的大部分皂苷都存在溶解性差、生物利用度低、毒副作用过大等问题。因此,对知母皂苷进行结构修饰已逐渐成为天然药物结构改造研究领域中的一个重要研究方向。笔者对近年来有关知母皂苷结构修饰方面的研究作一概述,以期为知母皂苷及其他类似甾体皂苷类化合物的进一步研发提供思路。
3.1 酸水解法
酸水解是用于制备次级皂苷或皂苷元的最常用方法,适用于工业化大量生产,且具有较高的可操作性和经济可行性。在前期知母皂苷BIII体内代谢实验的指导下,笔者发现BIII在大鼠体内主要进行脱糖化代谢反应。Wu等[24]使用稀硫酸对知母皂苷BIII进行水解,反应7h,萃取处理后得到3个水解产物,分别为Timosaponin BIII-a、Timosaponin BIII-b和Timosaponin BII-a,其中Timosaponin BIII-a和Timosaponin BIII-b为新化合物。同样,Liu等[25]在此基础上,使用浓度不同的稀硫酸对BIII进行水解,另外得到一个新的水解产物,即Timosaponin BIII-c。
3.2 生物转化法
生物转化法是指利用动植物离体器官或细胞以及生物酶对目标化合物进行结构修饰的一种方法。该法成本高,难以实现工业生产等因素限制,但其具有反应选择性强、反应条件温和、副产物少、不造成环境污染和后处理简单等优势,因此生物转化法也是天然产物结构修饰过程中广泛采用的一种手段。刘艳平等[26]研究发现可利用葡萄糖苷酶水解知母皂苷BII制备AIII,并针对反应条件进行了优化,最终确定了条件温和、转化率高的反应路线。Zhou等[27]从黑曲霉菌AS3.0739中提取出一种粗酶,并利用该酶对知母皂苷BII进行水解,结果发现,随着反应时间的延长,可相继得到Timosaponin BII-b、Timosaponin BII-a、Timosaponin BII-c三种转化产物。该团队后续又使用另一种Toruzyme 3.0L 商品化环糊精葡萄糖基转移酶对BII进行反应,结果得到9种不同的糖基化衍生物,同时也证实了GH13家族中的淀粉酶以及CGTase等对BII的糖基衍生化有促进作用[28]。Jiang等[29]利用葡萄糖苷酶对知母皂苷BIII进行水解后得到3种转化产物,即除知母皂苷AIII外,还得到timosaponin BIII-a以及另外一个AIII异构体(20R,25S)-5-spirostane-3-ol-3-O-D-glucopy-ranosyl-(1→2)-D-galacopyanoside。其还对上述三种转化产物以及BIII进行了抗抑郁活性筛选,初步总结了知母皂苷抗抑郁的构效关系:其中C-3和C-26位的糖基可增强活性,C-22的R构型当为螺甾烷构型,C-20的S构型以及C-20和C-22之间的双键可能为活性必需基团。
3.3 其他化学方法
除上述两类常用方法以外,López等[30]从菝葜皂苷元出发,在5%NaNO2/BF3醋酸水溶液催化下,修饰得到一种新型的二呋喃型衍生物——(22S,23S)-22,23-dihydroxy-23,26-epoxyfurostane。狄维等[31]对菝葜皂苷元的C3-位羟基进行了糖基化修饰,利用1-位活化的单糖与菝葜皂苷元联结,得到一系列不同糖基的皂苷衍生物,这些糖包括D-葡萄糖、D-半乳糖、D-甘露糖、D-阿拉伯糖、L-阿拉伯糖、D-核糖和L-鼠李糖,这为筛选知母皂苷类化合物抗老年痴呆活性以及构型关系研究提供了化学基础。彭缨等[32]则对菝葜皂苷元C-3位点羟基进行了-Br、-Cl、-SO3OH等不同基团的取代反应,分别得到8种不同的取代基产物,然后对其进行抗衰老活性筛选,发现8种产物均有不同程度的抗衰老活性,结合MTT和-gal染色实验,最终筛选出抗衰老作用强同时毒性小的为硫酸酯化菝葜皂苷元。此外,Fang等[33]采用一种很巧妙的方法合成了知母皂苷AIII的5种衍生物(如图2),其反应的关键在于使用了一种半保护的半乳糖硫苷。
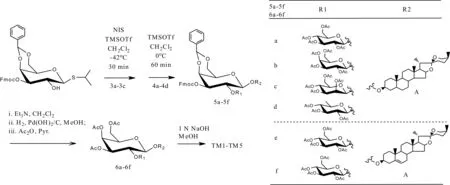
图2 知母皂苷AIII系列衍生物合成路线
4 结语
综上所述,知母皂苷作为知母中的一类重要药效成分,在防治老年痴呆症和保护脑缺血损伤等方面效果显著,但其作为新药进行开发仍存在较大不足。因此,如何对其进行合理的结构修饰,在保证药效的同时,改善其体内药代动力学过程欠佳、毒副作用过大或药物稳定性差等缺陷,是研究知母皂苷及其他甾体皂苷类似物的重要方向。随着相关研究的不断深入,相信皂苷类药物将很快走向市场,造福患者。
[1] 国家药典委员会.中华人民共和国药典[M].一部.北京:化学工业出版社,2010.
[2] 路军章,魏峰.神农本草经[M].北京:中医古籍出版社,2013.
[3] 王颖异,郭宝林,张立军.知母化学成分的药理研究进展[J].科技导报,2010,28(12):110-115.
[4] Y J KANG, H J CHUNG, J W NAM, et al. Cytotoxic, Antineoplastic activity of timosaponin AIII for human cancer cells [J]. Journal of Natural Products, 2011(74):701-706.
[5] L P KANG, J ZHANG, Y CONG,et al. Steroidal glycosides from the rhizomes of Anemarrhena asphodeloides and their anti-platelet aggregation activities [J].Planta Medica,2012(78): 611-616.
[6] L P KANG, K YU, Y ZHAO, et al. Characterization of steroidal glycosides from the extract of Paris Polyphylla var. Yunnanensis by UPLC/Q-TOF MSE [J]. Journal of Pharmaceutical and Biomedical Analysis, 2012(63):235-249.
[7] J P PENG, X S YAO, Y OKADA, et al. Further studies on new furostanol saponins from the bulbs Allium macrostemon [J]. Chemical and Pharmaceutical Bulletin,1994(42): 2180-2182.
[8] R TSCHESCHE, A M JAVELLANA, G WULFF, Steroidsaponine wit mehr als einer Zuckerkette, IX Purpureagitosid, ein bisdesmosidicsches 22-hydroxyfurostanol-glycoside aus den blattern von Digitalis purepure L [J]. Chemische Berichte,1974(10):2828-2834.
[9] Z Y MENG, S X XU, L H MENG. Timosaponins E1 and E2 [J]. Acta pharmacologica Sinica,1998(33): 693-696.
[10] X. PANG, L.P. KANG, H.S. YU, et al. Furostanol saponins from Chniese fenugreek (Trigonella foenum-graecum.L) seeds: isolation and LC-MS profiling bases on UPLC-ESI-Q/TOF MSE [J]. Journal of Separation Science, 2012(35): 1538-1550.
[11] J ZHANG, B P MA, L P KANG, et al. Furostanol saponins from the fresh rhizomes of Polygonatum kingianum [J]. Chemical and Pharmaceutical Bulletin, 2006(54): 931-935.
[12] Y S VOLLERNER, M B GOROVITS, T T GOROVITS, et al. Steroidal saponins and sapogenins of Allium. XVII. Structure of karatavioside C [J]. Khimiya Prirodnykh Soedinenii, 1980(3): 355-359.
[13] L P KANG, Y ZHAO, X PANG, et al. Characterization and identification of steroidal saponins from the seeds of Trigonella foenum-graecum by ultra-high-performance liquid chromatography and hybrid time-of-flight mass spectrometry [J]. Journal of Pharmaceutical and Biomedical Analysis, 2013(74):257-267.
[14] S C SHARMA, H C SHARMA.Oligofurostanosides from Asparagus curillus leaves [J]. Phytochemistry, 1993(33):683-686.
[15] Z BELHOUCHET, M SAUTOUR, T MIYAMOTO, et al. Steroidal saponins from the roots of Smilax aspera subsp. mauritanica [J]. Chemical and Pharmaceutical Bulletin,2008(56) 1324-1327.
[16] X JI, Y F FENG. Advances in studies on saponins in Anemarrhena asphodeloides [J]. Chinese Traditional Herb Drugs, 2010(41): S12-S15.
[17] Z Y MENG, S X XU Three new furostanol saponins from Anemarrhena asphodeloides Bge. [J]. Journal of Shenyang Pharmaceutical University, 1998(15):130-131.
[18] T J LI, Y QIU, P Y YANG, et al. Timosaponin B-II improves memory and learning dysfunction induced by cerebral ischemia in rats [J]. Neuroscience Letters,2007,421(2):147-151.
[19] J K OH, S Y HYUN, H R OH, et al. Effects of Anemarrhena asphodeloides on focal ischemic brain injury induced by middle cerebral artery occlusion in rats [J]. Biological & Pharmaceutical Bulletin, 2007, 30(1): 38-43.
[20] A NIWA, O TAKEDA, M ISHIMARU, et al. Screening test for platelet aggregation inhibitor in natural products. The active principle of Anemarrhenae Rhizoma [J]. Yakugaku Zasshi,1988, 108(6): 555-561.
[21] Z Y MENG, J Y ZHANG, S X XU, et al. Steroidal saponins from Anemarrhena asphodeloides and their effects on superoxide generation [J].Planta Medica,1999,65(7):661-663.
[22] P TROUILLAS, C CORBIRE, B LIAGRE, et al. Structure-function relationship for saponin effects on cell cycle arrest and apoptosis in the human 1547 osteosarcoma cells: a molecular modelling approach of natural molecules structurally close to diosgenin [J]. Bioorganic & Medicinal Chemistry, 2005,13(4):1141-1149.
[23] H NIAN, L P QIN, W S CHEN, et al. Protective effect of steroidal saponins from rhizome of Anemarrhena asphodeloides on ovariectomy-induced bone loss in rats [J]. Acta Pharmacologica Sinica,2006,27(6):728-734.
[24] B WU, Z Y LIU, M S FAN, et al. The structural elucidation of two new artificial steroidal saponins [J]. Chinese Chemical Letter,2012(23): 332-334.
[25] Z Y LIU, W X JIANG, B WU, et al. New saponins from timosaponin BIII by acid hydrolysis [J]. Asian Journal of Chemistry,2013(5):2503-2505.
[26] 刘艳平,杨轶舜,张彤,等.知母皂苷AIII酶解工艺优选[J].中国实验方剂学杂志,2013,19(2): 1-3.
[27] W B ZHOU, B FENG, H Z HUANG, et al. Hydrolysis of timosaponin BII by the crude enzyme from Aspergillus niger AS 3.0739 [J]. Journal of Asian Natural Products Research,2010(12): 955-961.
[28] W B ZHOU, B FENG, H Z HUANG, et al. Enzymatic synthesis of -glucosyl-timosaponin BII catalyzed by the extremely thermophilic enzyme: Toruzyme 3.0L [J]. Carbohydrate Research, 2010(345):1752-1759.
[29] W X JIANG, J GUO, R XUE, et al. Anti-depressive activities and biotransformation of timosaponin B-III and its derivatives [J].Natural Product Research,2014(22): 1-8.
[31] 狄维,王林,彭涛,等.知母菝葜皂苷元3-位糖基化衍生物的合成[J].中国药物化学杂志, 2003,13(6):324-328.
[32] 彭缨,李玲芝,李成磊,等.知母中菝葜皂苷元分离、其衍生物合成及活性[J].沈阳药科大学学报,2012,29(12):927-932.
[33] M FANG, L GU, G F GU, et al. Facile Synthesis and Antitumor Activities of Timosaponin AIII and Its Analogs [J]. Journal of Carbohydrate Chemistry, 2012(31):187-202.
(责任编辑:尹晨茹)
2014-07-14
国家自然科学基金项目(81274055)
付之文(1990-),男,上海中医药大学附属曙光医院硕士研究生,研究方向为中药药效物质。
薛睿(1986-),女,中国科学院上海药物研究所博士后,研究方向为中药及其复方药效物质。
R284
A
1673-2197(2014)18-0029-04

