肝移植术后胆管并发症的相关危险因素分析*
张 帅 夏明峰 田 虎
(1.泰山医学院,山东 泰安 2710016 2.山东中医药大学,山东 济南 250000;3.山东省千佛山医院普外中心肝胆外二科,山东 济南 250014)
胆管并发症(biliary complication,BC)是肝移植术后最常见的并发症,目前发病率约10%~25%[1]。由于发生率高、治疗难度大并严重影响患者的胆道功能恢复,肝移植术后胆道并发症常导致长期和反复的临床治疗,甚至再次肝移植。随着肝移植作为终末期肝病的主要治疗手段在临床上的日益开展,肝移植后胆管并发症已成为制约肝移植疗效和患者生存质量的关键因素[2]。本研究回顾性分析了102例肝移植病例的临床资料,并讨论了肝移植术后胆管并发症的相关危险因素,以期为该病的预防和诊治提供临床经验。
1 资料与方法
1.1一般资料 2000年以来,我院共施行肝移植手术300余例。选取近5年资料较完整的102例,男92例,女10例;年龄30~69岁,平均50.9岁。原发疾病为:原发性肝癌61例,乙型肝炎后肝硬化31例,丙型肝炎后肝硬化4例,酒精性肝硬化5例,急性肝衰竭1例。供体选择为尸体供肝,供肝均无肝脏基础疾病、恶性肿瘤和明显脂肪变性,病毒血清学检查阴性。供受体ABO血型相同者97例,相符者4例,供体A受体B者1例(术后呼吸循环衰竭、死亡)。
1.2手术方法及术后治疗监测 经典原位肝移植96例,背驮式肝移植4例,二次移植1例,肝肾联合移植1例。放置T管引流26例,未放置86例。术中恢复移植肝血流均为先开放门静脉后开放肝动脉,胆道重建方式均行供受体肝总管端端吻合。术后常规采用抗排斥治疗。术后主要监测指标:患者体征、胆汁引流量、生化指标(TBIL、DBIL、ALT和AST等)。分别于术后1周、2周、3周行床旁彩色多普勒超声检查肝门部血管,注意观察肝动脉血流情况,测定记录RI等指标,之后定期复查。必要时行内镜逆行胰胆管造影(endoscopic retrograde cholangio-pancreatography,ERCP)、经皮肝胆管穿刺造影(percutaneous transhepatic cholangiography,PTC)或经T管行胆道造影检查。
1.3相关危险因素 根据国内外文献报道并结合临床实践,选择患者性别、年龄、原发病、供受体血型、国际标准化比值(INR)、MELD评分、CHILD分级、ABO血型配型、供肝冷热缺血时间、移植术式、T管放置、术前及术后肝肾功能指标和肝动脉阻力指数(RI)等作为可能的危险因素。
1.4统计学方法 将有胆管并发症发生的患者归为实验组,无胆管并发症者为对照组。用SPSS 17.0统计软件处理并分析各组患者中各因素的相关数据。正态分布的计量数据用均数±标准差表示,组间比较采用t检验。分类资料用相对数表示,组间比较采用χ2检验。定量资料经正态性检验,不服从正态分布的数据采用非参数的两样本Mann-Whitney检验,多样本数据采用非参数的Kruskal-Wallis检验。相关因素的分析采用logistic回归分析。P≤0.05为差异有统计学意义。
2 结 果
2.1肝移植术后胆管并发症 术后胆管并发症18次,发生率17.6%。包括胆管狭窄6例(5.88%),胆系感染6例(5.88%),胆漏3例(2.94%),胆系感染并胆管狭窄3例(2.94%)。
2.2单因素方差分析 各相关危险因素中(表1~3),不同并发症患者的年龄差异无统计学意义(t=0.162,P=0.872,P>0.05)。重复测量方差分析不同时间点的ALT、AST均数(F=48.24,P=0.001),差异有统计学意义,首先增高并达到高峰,然后逐渐下降(P<0.05),渐至正常。重复测量方差分析不同时间点的TBIL、DBIL、IBIL均数(F=1.302,P=0.207,P>0.05),差异无统计学意义,即在不同时间点的测量值趋向于平稳(P>0.05)。术后2周与术后3周测得的肝动脉阻力指数(RI)、术后第2次和3次测得的尿肌酐(CR)、各时间点测得的血谷草转氨酶(ALT)和谷丙转氨酶(AST)在有并发症组和对照组有显著性差异(P<0.05)。其中,术后2周测得的RI在两组间差异最显著(P=0.013),并由此确定RI=0.64作为临界值。
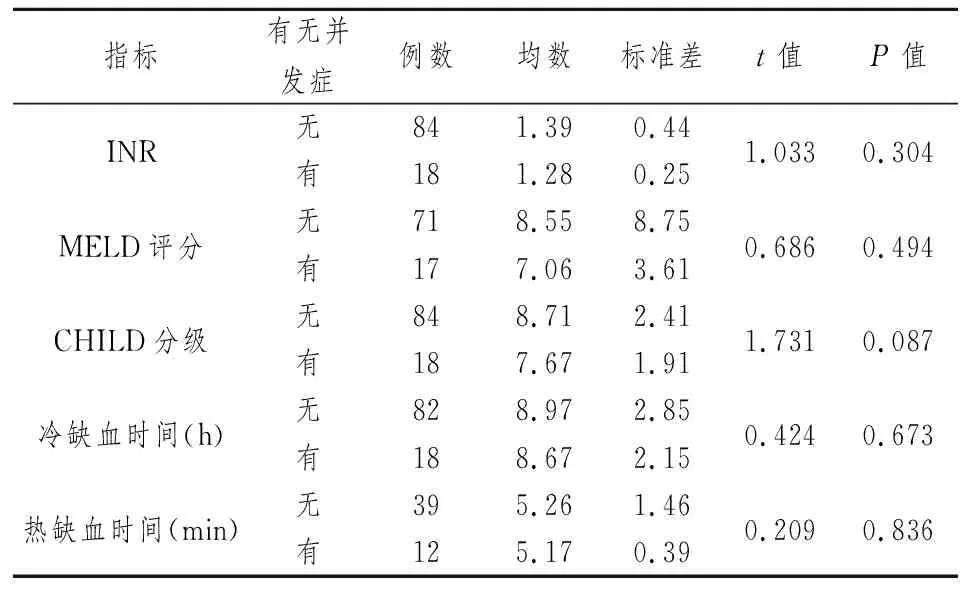
表1 非正态分布计量资料统计分析
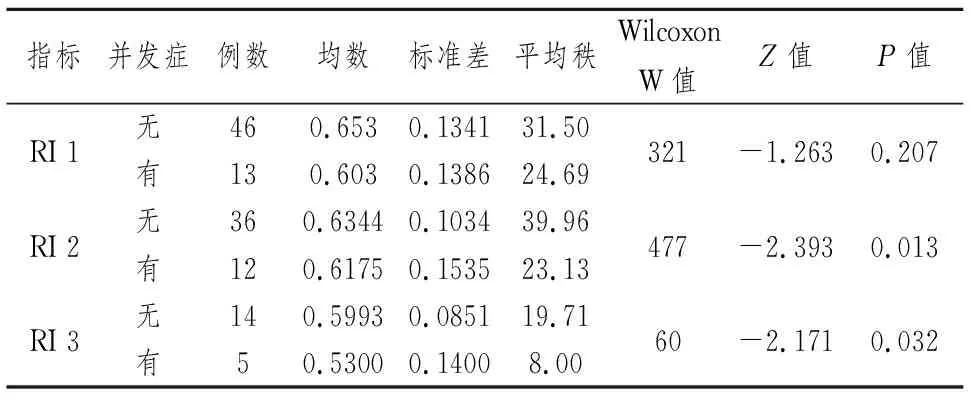
表2 RI的非参数的Mann-Whitney检验分析
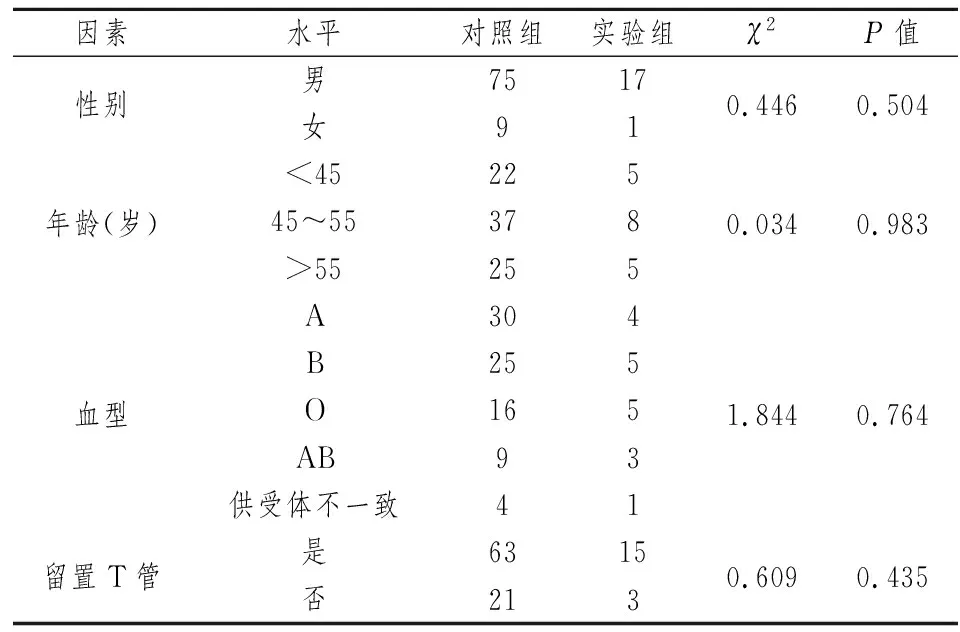
表3 计数资料统计分析
2.3多因素分析 对各候选因素进行Logistic回归分析,血总胆红素(TBIL)、直接胆红素(DBIL)、留置T管和术后2周与3周测得的RI等指标的优势比(OR)均大于1,提示是可能的危险因素(表4)。但由于各指标的P>0.05,故各OR值没有统计学意义。
2.4并发症的治疗与转归 结合其他影像学资料,通过ERCP明确病因并实施内镜治疗。对18例肝移植术后胆管并发症患者行32次ERCP诊疗,成功31次,ERCP插管失败1例,成功率为96.9%(31/32)。并发症发生的部位分别为:供体肝胆管、受体胆管、胆管吻合口及十二指肠乳头。治疗方式:乳头括约肌切开(EST)21.88%(7/32),乳头柱状球囊扩张(EPBD)15.63%(5/32),EST+EPBD 13.12%(8/61),扩张器扩张胆管34.38% (11/32),鼻胆管引流(ENBD)56.25%(18/32),胆管支架引流(ERBD)31.25%(10/32),取胆泥、胆道铸型或结石15.63%(5/32),胆管冲洗37.50%(12/32)。
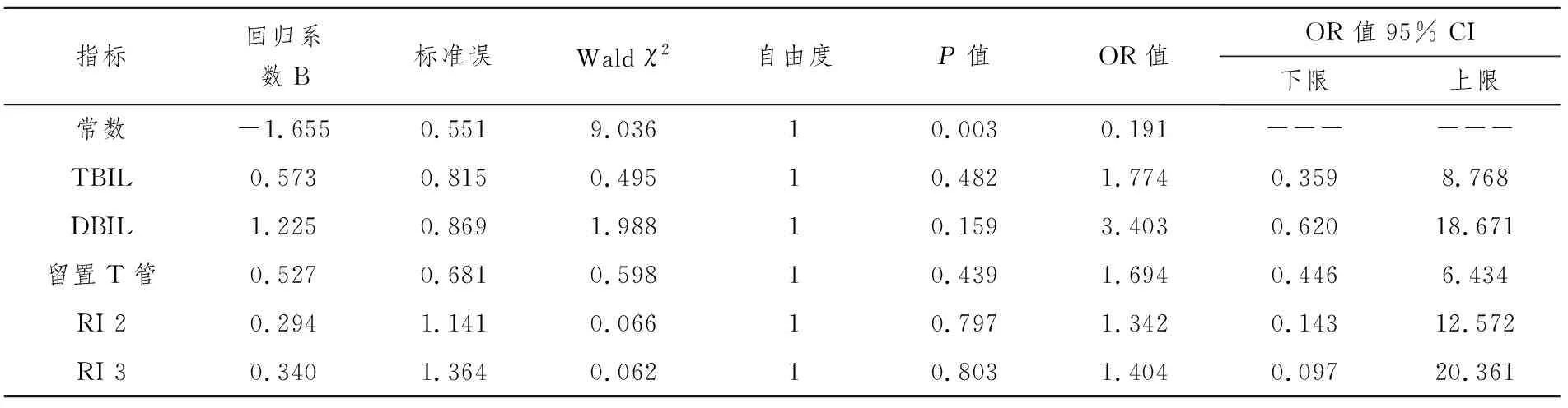
表4 Logistic回归分析
3 讨 论
肝移植是治疗终末期肝病患者的重要手术方式,随着肝移植的广泛开展和胆管并发症的增加,术后胆管并发症的诊疗和防治逐渐成为人们关注的热点。但由于肝移植手术术式多样、程序复杂、影响因素众多,胆道解剖和血供构造独特、组织再生能力低下等原因,术后胆道并发症的危险因素及其作用机制至今尚未明确,已成为制约肝移植成功率和肝移植技术进一步发展的关键问题[1,2]。
肝移植术后常见的胆管并发症主要有:胆漏、胆管狭窄、胆道感染、胆泥和胆石、胆管铸型综合征、oddi括约肌功能失调等[3]。我们对102例肝移植患者的临床资料分析表明:术后胆管并发症共发生18次,发生率17.6%;其中胆管狭窄6例(5.88%),胆系感染6例(5.88%),胆漏3例(2.94%),胆系感染并胆管狭窄3例(2.94%)。本组肝移植术后胆管并发症总发生率与国内外文献基本一致[4],各种胆道疾病类型中则以胆管狭窄和胆系感染发生率为最高,胆漏和胆系感染并胆管狭窄次之。许多研究报道[5],肝移植术后胆道并发症以胆漏最为常见。另有研究显示[6],术后3个月内以胆漏为主,3个月后以胆道狭窄常见,胆漏提示将来可能逐步发生胆管狭窄。
根据肝移植手术进程,术后胆道并发症的致病因素可分为:(1)供受双方的基本情况(一般情况、血型和原发病等)相关的胆道并发症;(2)供肝保存(灌洗不足和缺血再灌等)和修整时导致的胆道损伤;(3)手术术式、胆道重建方式及是否设置T管引流等的选择;(4)术中操作等导致的胆道损伤;(5)术后感染、免疫排斥、肝动脉供血不足和原发病等引起的胆管并发症[7]。随着肝移植技术水平的不断提高,由供肝保存和修整、手术操作等引起的胆管并发症的发生率逐渐降低,从而凸显了其他因素的影响作用。本研究根据国内外文献报道并结合临床实践,选择患者性别、年龄、原发病、供受体血型、国际标准化比值(INR)、MELD评分、CHILD分级、ABO血型配型、供肝冷热缺血时间、移植术式、T管放置、肝肾功能指标和肝动脉阻力指数(RI)等作为候选因素,进行单因素分析和Logistic回归分析。
胆管的血供仅来源于动脉系统而非门脉系统,肝移植术中的肝动脉重建是恢复供肝侧胆道动脉血供的唯一途径,因此肝动脉重建后血供是否充分是影响胆管并发症的重要因素[8]。肝动脉吻合口狭窄、肝动脉血栓形成、受体肝动脉过细或异常等原因引起肝动脉供血不足,均可引起胆管缺血性损伤(ischemic type biliary lesion,ITBL),最终导致胆漏或胆道狭窄。胆道重建时对胆管周围血管网的破坏也可导致ITBL发生[9]。用彩色多普勒超声测定肝动脉阻力指数(RI)是通过肝动脉血管床阻力的变化了解肝脏血流动力学状态,判断肝动脉有无狭窄的有效方法[10]。RI反映肝动脉收缩期与舒张期血流速度变化度,不受血管形态及取样角度影响,是判断肝动脉血流的重要参数,正常值为0.55~0.80,RI降低提示动脉壁弹性减低,近端血流存在梗阻。
本研究发现,术后第2周与第3周测得的RI在有并发症的患者和无并发症的患者之间有显著性差异,Logistic回归分析显示RI的优势比(OR)大于1,提示RI可能是肝移植术后胆道并发症的危险因素。根据统计分析结果,我们将RI=0.64确定为发生胆道并发症的临界值,该值在正常范围(0.60~0.80)之内,这提示胆道并发症的发生对肝动脉缺血非常敏感,尚未出现梗阻表征的肝动脉血供降低即有可能导致胆道并发症。这与国内外以往的报道是一致的[11]。此外,我们还对RI在患者不同性别、年龄和原发病等组间进行了分析,发现RI值在以上各组间无统计学差异,这提示RI是不受以上各因素影响的独立预测因子。总之,在肝移植术后应密切监测肝动脉血流动力学改变,建议在RI≤0.64时即需引起重视。肝动脉血供的改善有赖于手术技术与器官保存技术的改进以及术后微血栓形成前的预防性抗凝治疗等措施干预。
血清胆红素水平是判断肝脏病理改变的高敏感性指标,肝移植术后早期较常发生高胆红素血症,其影响因素复杂[12]。例如,各种终末期肝病导致的术前基础胆红素水平升高、供肝保存损伤、排斥反应、术后胆道及血管并发症、感染、药物性肝损伤和其他器官功能衰竭等各种因素可单独或者合并导致胆红素水平升高。本研究中Logistic回归分析显示,总胆红素(TBIL)和直接胆红素(DBIL)的OR值大于1,提示TBIL和DBIL可能是肝移植术后胆管并发症的相关危险因素。因此,术后需要严密的肝脏功能监测,并及时给予肝功能保护治疗。此外,本研究中单因素方差分析显示,术后各时间点测得的血谷草转氨酶(ALT)和谷丙转氨酶(AST)在有并发症组和对照组有显著性差异(P≤0.05)。术后高胆红素血症,从术后第1天开始,呈渐降趋势,直至降至正常。
胆道重建后是否留置T管一直存在争议[13]。一方面,留置T管可降低胆道内压力并支撑胆管,有利于观察引流量和胆汁情况,可用于术后影像学检查和介入治疗,并可能有助于降低吻合口漏和吻合口狭窄等并发症的发生率。另一方面,留置T管又增加了感染、胆石及胆泥形成、影响胆管供血血管增生、T管引出口胆漏和拔出T管导致胆漏等并发症的危险性。目前越来越多的研究者建议[14-15],胆道重建过程中不必常规留置T管,仅在存在其他可能的胆管并发症高危因素时选择性留置T管。本研究中留置T管在胆管并发症组和对照组中未发现显著的统计学差异,但Logistic回归分析则显示留置T管的OR值大于1,据此结果仍将留置T管认为是肝移植术后胆管并发症的相关危险因素。此结果有待于通过扩大样本量的进一步研究进行检验。
另有许多研究显示[16-18],患者原发疾病、供肝的冷热缺血时间、血型配型和免疫排斥等各种因素也可作为肝移植术后胆管并发症的危险因素。但在本研究中,通过单因素分析和Logistic回归分析等方法,均未发现这些因素可作为危险因素的统计学依据。此外,本研究中RI≥0.64、TBIL、DBIL和留置T管在回归分析中OR值均大于1,但其P>0.05。故尚有待于通过扩大样本量的进一步研究来继续寻找独立危险因素。
总之,本研究提示,肝移植术中尽量减少胆道重建时对于血供的破坏,术后严密监测肝动脉血流动力学并早期干预、积极监测并保护肝功能、不留置T管等措施,有利于降低胆管并发症的发生率。
[1] Geenen JE, Hogan WJ, Dodds WJ, et al. The efficacy of endoscopic sphincterotomy after cholecystectomy in patients with sphincter-of-Oddi dysfunction[J]. N Engl J Med,1989,320(2):82-87.
[2] Gámán G, Gelley F, Doros A,et al. Biliary complications after orthotopic liver transplantation: the Hungarian experience[J]. Transplant Proc,2013,45(10):3695-3697.
[3] 田虎,郭源,李志强,等.成人原位肝移植术后胆道并发症的内镜诊断和治疗[J].肝胆外科杂志,2010,18(5):338-342.
[4] Buck DG, Zajko AB. Biliary complications after orthotopic liver transplantation[J]. Tech Vasc Interv Radiol, 2008,11(1):51-59.
[5] 唐彬,王宇,周杰,等. 肝移植术后胆道并发症的危险因素分析[J]. 中国普通外科杂志,2011,20(1):1-5.
[6] 王健,张培建. 肝移植术后胆道狭窄的危险因素和治疗[J]. 中华普通外科学文献:电子版,2013,6(6):501-505.
[7] 郑海涛,吕忠船,郭吉田. 肝移植术后胆道并发症的研究进展[J]. 中国现代普通外科进展,2007,10(4):334-337.
[8] Mourad MM, Algarni A, Liossis C, et al. Aetiology and risk factors of ischaemic cholangiopathy after liver transplantation[J]. World J Gastroenterol, 2014,20(20):6159-6169.
[9] 唐晖,陈规划. 肝移植术后缺血性胆道损伤研究进展[J]. 器官移植,2014,15(2):123-127.
[10] 薄华颖,夏稻子,张宇虹. 肝移植后胆道并发症的超声诊断价值[J]. 中国组织工程研究,2014,25(5):693-698.
[11] 郑树森,俞军,张武. 肝移植在中国的发展现状[J]. 临床肝胆病杂志,2014,20(1):2-4.
[12] 侍晓辰,彭志海.肝移植术后胆道并发症的病因分析及治疗对策[J].医学新知杂志,2009,19(1):42-45.
[13] Luo Y, Ji WB, Duan WD, et al. Graft cholangiopathy: etiology,diagnosis, and therapeutic strategies[J]. Hepatobiliary Pancreat Dis Int,2014,13(1):10-17.
[14] Selvakumar N, Saha BA, Naidu SC. Is Duct to Duct biliary Anastomosis the Rule in Orthotopic Liver Transplantation?[J]. Indian J Surg, 2013,75(5):368-3672.
[15] 汪根树, 陈规划, 陆敏强, 等. 原位肝移植术后胆管狭窄的治疗(附43例报告) [J].中国实用外科杂志, 2006, 26( 6) : 432- 433.
[16] Karimian N, Westerkamp AC, Porte RJ. Biliary complications after orthotopic liver transplantation[J]. Curr Opin Organ Transplant, 2014,19(3):209-216.
[17] 何宇,张雷达,卢倩,等.原位肝移植术后胆道充盈缺损性胆系并发症的研究[J].中华消化外科杂志,2007,5(2):92-95.
[18] 李冰,邢万金,张生彬. 肝脏移植术后常见胆道并发症临床研究进展[J]. 中国医学创新,2013,12(2):148-150.

