有关亲核取代反应和β—消去反应的教学思考
陈明君 傅杨武 周群英
(重庆三峡学院化学与环境工程学院 重庆万州 404100)
在有机化学教材中卤代烃一章是学生从烃到烃的衍生物的入门,起着承前启后的作用.在这之前,学生已经学习了游离基取代反应、亲电加成反应、游离基加成反应和亲电取代反应,对有机化学反应有一定的认识,这几种反应基本上是单一的反应.但卤代烃与亲核试剂作用时,在卤代烃的结构中,由于卤原子的电负性大于碳原子,则 C—Xσ键是极性共价键,共用电子对偏向于电负性大卤原子,偏离于电负性小的碳原子,使卤原子一端带部分负电荷,而碳原子一端带部分正电荷,在共价键断裂时容易发生异裂,即由于带部分正电荷的碳远离八隅体稳定结构,带部分负电荷的卤原子更接近八隅体稳定结构,所以,带部分正电荷的碳更容易受带负电荷的亲核试剂的进攻,从而发生亲核取代反应.同时卤代烃中的β—H受到卤原子-I效应的影响,β—碳上的电子云密度降低,使β—H具有一定的酸性,从而也能受亲核试剂的进攻而发生β—消去反应.由于不同卤代烃的结构差异,亲核取代反应有SN1和SN2两种反应机理,消除反应也有E1和E2两种反应机理,所以当卤代烃与亲核试剂作用时是取代反应和消除反应两种反应,SN1、SN2、E1、E2四种机理相互竞争的结果,仅仅是在某一特定条件下某种反应、某种机理占优势的问题[1].学生在学习亲核取代和消去反应知识时对两类反应的影响因素,究竟在什么条件下发生取代反应、什么条件下发生消除反应很难做出正确的判断.为了让学生在充分理解并掌握这四种机理及其影响因素后对相关知识进行归纳和记忆,根据我长期的教学实践,从以下几方面进行教学,收到了很好的教学效果.本文是我在教学过程中对这部分知识的一些经验和体会,供大家参考.
1 掌握基本概念[2]
反应底物(substrate):是指在亲核取代反应中接受亲核试剂进攻的物质.
亲核试剂(nucleophilic agent,简写为:Nu-):带负电荷或部分负电荷的离子或中性分子.
离去基团(X-):带着一对共用电子离去的离子.如果离去的负离子碱性较弱则是较好的离去基团,碱性越强的基团越难离去(离去基团碱性强弱可用其共轭酸酸性的强弱来判断).
亲核取代反应:是指由亲核试剂进攻而发生的取代反应称为亲核取代反应,用SN表示.
质子性极性溶剂:溶剂分子中有比较“裸露”的氢可以作为氢键给体的O-H键或N-H键的的溶剂.
非质子性极性溶剂:没有比较“裸露”的氢存在,不能作为氢键给体的溶剂,不给出质子,与溶质的作用力弱.
溶剂化作用:在溶液中,溶剂分子通过与离子的相互作用而累积在离子周围的过程.溶剂化作用能促进极性共价键的断裂,加快反应进行的速度.
亲核性:一个试剂在形成过渡态时对碳原子的亲和能力.
碱性:是指一种物质在溶剂中能向其它物质提供未共用电子对的能力或一个试剂对质子的亲和能力,注意碱性和亲核性是两个完全不同的概念.
2 SN1、SN2、E1和 E2反应机理
2.1 SN1反应机理(图1)
该反应是分两步完成的,电荷由分散到集中.由于中间体碳正离子,为平面结构,亲核试剂Nu-可以从平面的上方和下方进攻碳正离子,且几率相等,得到的产物Ⅰ和产物Ⅱ的量相等,产物Ⅰ和产物Ⅱ是一对对映体,共同组成外消旋体,所以,单分子亲核取代得到外消旋化产物.由于中间体碳正离子可能发生重排,还可能得到重排产物.
2.2 SN2反应机理(图2)
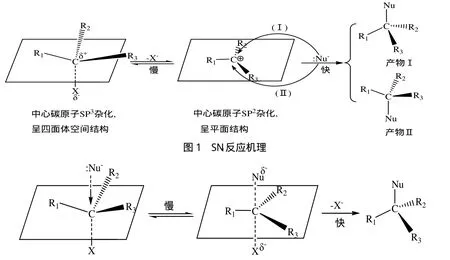
图2 SN2反应机理
该反应是一步完成的,电荷由集中到分散.由于亲核试剂和离去基团均带有较多负电荷且体积较大,所以沿碳—卤键的反向延长线的方向进攻中心碳原子时,亲核试剂与卤原子间的相互排斥作用最小.经历底物到中间过渡态再到产物,中心碳原子由 SP3杂化到 SP2杂化再到 SP3杂化,R1、R2、R3的方向由指向平面的上方到处于平面上再到指向平面的下方,发生了翻转,所以,SN2历程得到构型翻转的产物,注意构型翻转并不等于手性碳原子构型由R变成S或由S变成R,其构型由R/S命名规则确定.
2.3 E1反应机理(图3)
该反应是分两步完成的,电荷由分散到集中.中间体是碳正离子,碳正离子的碳原子和β—碳原子之间为单键,单键可以自由旋转,R2、R3的相对位置可以不停变化,所以发生β—消去反应时可得到遵守扎伊采夫规则的两种不同构型的烯烃.由于中间体碳正离子可能发生重排,还可能得到重排产物.
2.4 E2反应机理(图4)
该反应是一步完成的,反应速度慢的步骤中电荷由集中到分散.由于亲核试剂和离去基团均带有较多负电荷且体积较大,只有当卤原子和β—H处于对位交叉式构象时,亲核试剂进攻β—H时与卤原子之间的距离最远,相互排斥作用最小,所以,在进行E2消去反应时主要是反式消去,其主产物不一定遵守扎伊采夫规则.

图4 E2反应机理
3 亲核取代和消除反应的影响因素
在基础有机化学的教学中,卤代烃亲核取代和消除反应的竞争影响因素多而复杂,实际情况是消去反应、亲核取代反应和SN1、SN2、E1和E2四种机理是同时存在的,仅仅是在某特定条件下主要按某种反应类型的某种机理进行.所以,对于亲核取代和消除反应的竞争性问题,只能近似模糊处理.
3.1 烃基的结构的影响
在卤代烃分子发生双分子亲核取代(SN2)和双分子消去(E2)反应时,如果中心碳原子上连接的烃基越多,亲核试剂从C—X键的反向延长线进攻中心碳原子或进攻β—H时所受到的空间位阻就越大,使卤代烃分子与亲核试剂间发生有效碰撞的概率下降;而在中间过渡态中较多的支链要与中心碳原子保持在同一个平面上,所受张力也将较大,这就使在形成过渡态时需要提供更多的能量即反应有较高的活化能,都将导致卤代烃发生双分子亲核取代和双分子消去反应的活性下降,反应速率减小.对于SN1、E1反应,首先形成的是碳正离子,α—C原子上烃基越多,形成的碳正离子越稳定,生成时需外界提供的能量越少即活化能越低,活化能越低反应速率也就越快.由于单分子亲核取代反应和单分子消去反应第一步形成的是碳正离子,碳正离子可能发生重排,重排时总是趋向于由不稳定的结构重排为更稳定的结构,使其所带正电荷更分散,碳正离子更加稳定[3].所以,一级卤代烃主要按双分子历程进行,三级卤代烃主要按单分子历程进行,二级卤代烃主要看反应的其它条件[4].
3.2 亲核试剂的影响
由于单分子亲核取代和单分子消去反应,第一步生成碳正离子的步骤反应速度慢,是决定反应速率的步骤,而第一步只有卤代烃参与反应,所以只与卤代烷的浓度有关,与亲核试剂无关,故亲核试剂对SN1、E1反应的影响不大.而双分子亲核取代反应和双分子消去反应决定反应速率的步骤同时有卤代烃和亲核试剂参与,则反应与卤代烃的结构和亲核试剂的亲核能力强弱、浓度大小都将有关.一般亲核试剂的亲核能力越强、亲核试剂的浓度越大,与卤代烃中心碳原子或β-H的成键能力越大,反应按双分子亲核取代和双分子消去反应机理进行的趋势越大,反应速率也越快.亲核试剂的亲核能力大小主要是由两个方面的因素决定的.一个是亲核试剂的碱性(即给电子能力),一个是亲核试剂的可极化度(即变形性).这两方面的因素对亲核试剂的亲核能力的影响一般是一致的;不一致的时候,往往是由于亲核原子的变形性起主导作用,但也与溶剂性质有关[2].一般有如下规律.
(1)同一周期的原子作为亲核原子时,亲核试剂的碱性越强亲核能力越强,碱性越弱亲核能力越弱.
(2)同一族的原子作为亲核原子时,变形性越大的原子(即原子半径大、电负性小的原子),亲核能力越强,这与亲核试剂碱性强弱次序刚好相反.
3.3 溶剂极性的影响[5]-[6]
对于SN1、E1反应的速度控制步骤是第一步,即由卤代烃电离生成正碳离子和卤负离子这一步,在这个步骤中,参与反应的底物电荷是从分散到集中,而强极性溶剂有利于电荷的集中,因此强极性溶剂有利于单分子机理.而SN2、E2反应的速度控制步骤是由亲核试剂进攻α—C原子,形成中间过渡态,在此过程中,电荷是由集中到分散的过程,弱极性或非极性溶剂有利于电荷的分散,所以,弱极性或非极性溶剂有利于双分子反应机理.
3.4 亲核取代与消除反应的竞争
卤烃的亲核取代反应与消除反应是一对竞争反应.有利于SN2的反应条件,同样对E2也有利,因而在取代反应的同时常伴随消除反应.一级卤代烃主要发生SN2反应,消除反应产物较少,当β位上连有苄基或烯丙基时,则会增加E2反应速率,提高消除反应产率.β—C上连有支链的一级卤代烃和二级卤代烃,空间位阻导致SN2反应速率减慢,有利于亲核试剂对β—H的进攻,导致消除反应增多.从电子效应考虑,试剂的亲核性强,易于发生SN2反应;试剂的碱性强,浓度大,有利于E2反应.从立体效应考虑,试剂的本积大,则不利于亲核取代反应,而有利于E2反应.由于三级卤代烃主要发生单分子反应,难发生SN2反应,如遇有强碱,则是以E2消除反应为主.SN1与E1反应混合物之比主要取决于空间效应.卤代烃中取代基越大,越有利于消除反应[7].
总之,亲核取代反应与消除反应的取向与卤代烃的结构有直接关系.直链一级卤烃易进行SN2反应,不易发生消除反应,只有强碱条件下才可发生消除反应.二级卤烃及β—C上有支链的一级卤烃进行SN2的反应速度较慢,在弱极性溶剂中,强亲核试剂条件下有利于SN2反应,在弱极性溶剂、强碱性试剂条件下,有利于E2反应.三级卤代烃难以进行SN2反应,在强碱条件下有利于E2反应.三级卤代烃在无强碱存在时,得到SN1和E1混合产物.生成物的相对比率依条件决定,逐渐增大碱的浓度,将增加消除反应比率.
4 结束语
通过对亲核取代反应和消去反应基本概念、反应机理及相互影响因素的讲解,学生对基础化学卤代烃中所涉及的反应究竟是发生取代还是消去反应有了比较清楚的认识.在四种反应机理讲解过程中引入一个平面,将α—C设计在一个假想平面上讲解亲核取代和消去反应机理,方便学生对亲核取代和消去反应机理和有关立体化学的理解和掌握.
[1]杨芬,张永伍.卤代烃亲核取代和消除反应影响因素教学思考[J],广州化工,2013(5):206-235.
[2]邢其毅,裴伟伟,徐瑞秋,等.基础有机化学:第三版[M].北京:高等教育出版社,2005.
[3]曾昭琼,有机化学:第四版(上册)[M].北京:高等教育出版社,2004.
[4]王满力,关于有机反应 SN1机理的注记[J].贵州教育学院学报,2001(2):21-23.
[5]孙占怀.影响亲核取代反应的因素[J].内蒙古石油化工,2003(9):17-19.
[6]范少华,崔玉民.不同溶剂在亲核取代反应中的作用[J].化学教育,2004(4):53-56.
[7]孙金鱼,赵三虎,赵明根.有机化学中的亲核取代反应[J].海南师范大学学报:自然科学版,2012(1):109-118.
——碳正离子的产生及稳定性比较

