大孔吸附树脂纯化五味子木脂素的工艺考察
黄家富 周晓东 周山
大孔吸附树脂纯化五味子木脂素的工艺考察
黄家富 周晓东 周山
目的建立五味子中五味子醇甲、五味子甲素、五味子乙素的高效液相色谱法(HPLC)分析方法, 以此为指标成分, 利用大孔树脂纯化五味子醇提液, 筛选纯化五味子木脂素的最佳树脂及纯化的最佳工艺。对纯化前后HPLC色谱图进行比较, 并测定五味子总木脂素的含量。方法动态上样法比较各种树脂对三种成分的吸附及解吸量来筛选最佳纯化树脂, 通过测定三种成分的上样量和洗脱量来考察最佳上样工艺及洗脱工艺, 对比纯化前后HPLC色谱图来研究纯化合理性, 利用紫外分光光度法来测定纯化后五味子总木脂素的含量。结果最佳纯化树脂为AB-8, 上样药液浓度0.128 g/ml, 流速3 ml/min,径高比1∶3以上, 95%乙醇洗脱。对比HPLC色谱图发现, 纯化前后色谱峰并无减少。木脂素含量测定结果显示纯化后五味子木脂素的含量占固形物60%以上。结论纯化合理且必要, 并且工艺简单实用,可用于工业生产。
五味子木脂素;大孔树脂;纯化;高效液相色谱法;紫外分光光度法
五味子醇提物是富含油性成分的大剂量多种极难溶性复杂成分组成的中药有效部位群提取物, 存在脂肪油、挥发油、树脂等油性无效成分, 这不仅降低了活性成分的含量, 增加了制剂的剂量, 也给后续的制剂工作增添了许多麻烦[1-3]。五味子木脂素是五味子保肝降酶的主要成分, 所以富集木脂素是本研究面临的首要问题。本文首先建立了五味子三种木脂素的HPLC分析方法, 选择五味子醇甲、甲素、乙素为指标性成分作为考察纯化工艺的指标。然后筛选大孔树脂类型,考察上样工艺和洗脱工艺。最后对纯化前后固形物的HPLC色谱图进行对比研究。
1 仪器与试药
1.1仪器 Waters2695高效液相色谱仪(美国沃特世公司);AS20500A型超声波清洗器(天津奥特赛恩斯仪器有限公司);TGL-18C-C型高速台式离心机(上海安亭科学仪器厂);CPA225D型电子分析天平(德国sartorius公司);Lichrospher C18(250 mm×4.6 mm, 5 µm)(江苏汉邦科技有限公司);SHB-Ⅲ真空泵(郑州长城科工有限公司);UV-1100红外分光光度计(上海美普达仪器公司)。
1.2试剂及药品 北五味子(安徽万生中药饮片有限公司);五味子醇甲(批号:110857-201010, 中国药品生物制品检定所);五味子甲素(批号:110857-201010, 中国药品生物制品检定所);五味子乙素(批号:110765-200710, 中国药品生物制品检定所);甲醇(分析纯, 江苏汉邦科技有限公司);乙腈(色谱纯, 美国Tedia公司);磷酸(分析纯, 南京化学试剂有限公司);纯净水(娃哈哈集团);AB-8型树脂(河北沧州宝恩有限公司);D101型树脂(河北沧州宝恩有限公司);X-5型树脂(河北沧州宝恩有限公司);HPD100型树脂(河北沧州宝恩有限公司)。
2 实验方法和结果
2.1三种五味子木脂素的HPLC分析方法的建立
2.1.1色谱条件 色谱柱为Lichrospher C18(250 mm×4.6 mm, 5 µm), 柱温 35℃, 进样量 10 µl, 体积流量为1.00 ml/min, 波长检测λ=254 nm, 流动相为A(乙腈)-B(水), 梯度洗脱程序见表1。

表1 梯度洗脱程序
2.1.2溶液的制备
2.1.2.1提取液的制备 取干燥的五味子适量, 用8倍药材量30%乙醇浸泡过夜, 滤过, 滤液弃去, 生药残渣干燥,粉碎成粗粉, 干燥, 称重。用75%乙醇回流提取3次, 第1次加入4倍量提取3 h, 第2次2倍量2 h, 第3次3倍量1 h,合并提取液, 放置48 h, 弃去沉淀, 虹吸上清液, 减压回收乙醇得稠状物, 再加2倍粗粉量95%乙醇, 摇匀, 静置24 h, 滤过, 收集滤液即得五味子提取液。将醇提液回收乙醇后, 取3等份, 分别加水稀释成药材浓度为0.128、0.064、0.032 g/ml的药液, 备用。
2.1.2.2混合标准品溶液制备 精密称取标准品五味子醇甲、五味子甲素、五味子乙素适量, 置于25 ml的容量瓶中,加甲醇溶解并稀释至刻度, 即得含五味子醇甲281.6 µg/ml、五味子甲素264.0 µg/ml、五味子乙素493.6 µg/ml的混合标准品溶液, 备用。
2.1.2.3供试品的制备 取上述提取液适量, 加倍量甲醇,摇匀, 14000 rpm离心10 min, 取上清液微孔滤膜(0.45 µm)滤过, 备用。
2.1.3系统适应性考察 取混合标准品溶液和供试品溶液按上述色谱条件注入色谱仪, 结果色谱图见图1和图2。

图1 混合标准品HPLC图
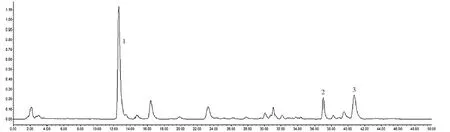
图2 供试品HPLC图
2.1.4标准曲线的绘制 精密吸取2.1.2.2项下混合标准品溶液5 ml , 置10 ml 量瓶中, 加甲醇稀释至刻度, 摇匀。以此法等比例配制后续溶液。分别吸取各浓度溶液10 µl, 按2.1.1色谱条件, 进样测定。以质量浓度(X)对峰面积(Y)进行线性回归, 得到三条标准曲线, 结果见表2, 三种成分在各自浓度范围内线性关系良好。
2.1.5精密度 精密吸取同一浓度的混合标准品溶液10 µl, 按2.1.1色谱条件, 连续进样6次, 积分三种成分的面积, 分别记录五味子醇甲、五味子甲素、五味子乙素的面积, RSD(n=6)分别为1.05%、1.15%、1.20%。该测定方法的精密度良好。

表2三种成分回归方程与线性范围
2.1.6稳定性 精密吸取同一供试品溶液分别于0 、2、4、6、12、24 h进样 10 µl, 在2.1.1色谱条件下测定各成分的峰面积,计算各成分峰面积的RSD(n=6) , 结果为五味子醇甲0.46% 、五味子甲素0.44%、五味子乙素0.078%。结果表明供试品溶液中上述三种成分在室温条件下24 h 内稳定。
2.1.7重复性 按2.1.2.3制备方法制备成供试品溶液, 平行6 份。在2.1.1色谱条件下分别进样10 µl测定, 以峰面积代入回归方程计算三种成分质量浓度, 并计算各成分质量浓度的RSD(n=6) , 结果为五味子醇甲0.94%、五味子甲素1.14%、五味子乙素1.68% 。表明该方法重复性良好。
2.1.8加样回收 精密吸取已知含量的供试品适量置于10 ml容量瓶中, 再加入含五味子醇甲281.6 µg/ml、五味子甲素264.0 µg/ml、五味子乙素493.6 µg/ml的混合标准品溶液5 ml, 加甲醇至刻度, 按2.1.2.3方法制备成供试品溶液, 平行 6 份, 即得。精密吸取上述溶液10 µl, 按2.1.1色谱条件进样测定, 计算各成分回收率和RSD, 结果见表3。
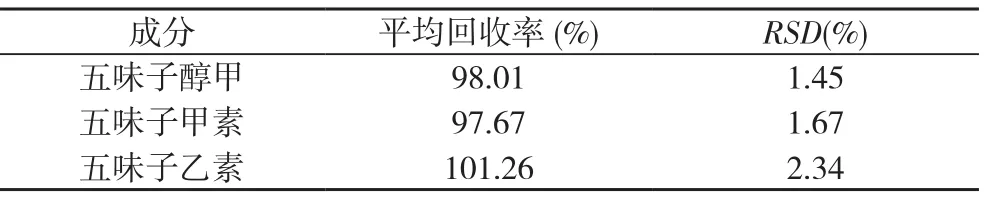
表3三种成分加样回收率和RSD(n=6)
2.2大孔树脂的纯化工艺考察
2.2.1大孔树脂的前处理 称取一定量的大孔树脂AB-8、D101、X-5、HPD100, 置于适量体积的95%乙醇浸泡24 h (乙醇没过树脂即可), 过滤, 置于玻璃层析柱内, 用95%的乙醇洗涤, 直到洗涤液加水无浑浊为止。再改用蒸馏水洗涤, 至洗涤液没有醇味, 取出树脂, 抽滤干, 密封保存于4℃冰箱内,备用。
2.2.2大孔吸附树脂的筛选
2.2.2.1取AB-8、X-5、D101、HPD100四种树脂各5 g于相同的玻璃层析柱中, 取已知浓度的提取液60 ml, 上样流速1 ml/min, 残留液定容到50 ml, 再用50 ml的水冲洗柱子,测定残留液中五味子醇甲、五味子甲素、五味子乙素的含量(水洗液中未检测出三种成分)结果见图3。

图3 四种树脂对三种成分的吸附量
2.2.2.2取上述已吸附有五味子木脂素的树脂, 用95%的乙醇冲洗, 直到冲洗液中检测不到五味子醇甲、甲素、乙素为止, 合并醇洗液, 测定洗脱液中所含醇甲、乙素、甲素的解吸量, 结果见图4。四种树脂对三种成分都能达到较好的吸附, 对五味子乙素的吸附呈现出较大差异, 以AB-8的吸附最高, 故考虑选择AB-8作为纯化木脂素的树脂。

图4 四种树脂对三种成分的吸附量
2.2.3上样工艺考察
2.2.3.1上样浓度考察 取AB-8树脂5 g 3份, 分别置于相同的层析柱中, 再取浓度分别为0.128、0.064、0.032 g/ml的药液, 以1 ml/min的流速上样, 每5 ml收集流出液, 检测三种成分, 直到检测出三种成分为止, 记录上样液体积, 计算三种成分的上样量, 结果见图5。三种上样浓度之间没有较大的差异, 考虑到上样时间及未来工业生产, 选择0.128 g/ml为最佳上样浓度, 开展后续研究。

图5 吸附浓度考察结果图
2.2.3.2上样流速考察 取AB-8树脂5 g 3份, 分别置于相同的层析柱中, 取浓度为0.128 g/ml的药液60 ml, 分别以1、2、3 ml/min的流速上样, 收集残留液, 50 ml的水冲洗柱子, 检测残留液与水洗液中三者成分的量, 三种成分的上样量结果见图6。上样流速之间没有较大差别, 考虑到上样时间,选取3 ml/min作为最终上样流速。

图6 吸附流速考察结果
2.2.3.3径高比考察 取AB-8树脂5 g 3份, 分别置于不同粗细的层析柱中, 形成径高比为1∶9、1∶3.5、1∶2的层析柱, 取0.128 g/ml的药液60 ml, 以3 ml/min的流速上样, 收集残留液, 50 ml水冲洗柱子, 检测残留液和水洗液, 三种成分的上样量结果见图7。径高比为1∶9和1∶3.5时差异较小,但当径高比为1∶2时, 柱子的吸附量减少。故选择1∶9或1∶3.5最为最佳径高比。

图7 树脂径高比考察结果图
2.2.4泄露曲线的绘制 取AB-8树脂5 g置于层析柱中,径高比为1∶9, 取0.128 g/ml的药液适量, 以3 ml/min的流速上样, 残留液每20 ml收集1次, 检测三种成分的含量, 以残留液体积为横坐标, 以残留液中三种成分的质量浓度与上样药液中质量浓度的百分比为纵坐标绘制泄露曲线, 结果见图8。

图8 泄露曲线
2.2.5洗脱工艺考察
2.2.5.1洗脱浓度考察 取AB-8树脂5 g置于层析柱中,径高比为1∶9, 取0.128 g/ml的药液40 ml, 以3 ml/min的流速上样, 收集残留液, 50 ml水洗柱, 分别用95%、80%、60%的乙醇适量, 流速为1 ml/min洗脱, 每20 ml收集1次洗脱液,检测三种成分的含量, 直到检测不到为止, 合并洗脱液, 检测三种成分的总量, 并各取50 ml洗脱液蒸干, 测定固形物的量,再用10 ml甲醇溶解固形物, 并测定固形物中三种成分含量,结果见图9。洗脱液所用乙醇浓度之间有差异, 选取95%的醇浓度为最佳。

图9 洗脱醇浓度考察结果图
2.2.5.2脱流速考察 取AB-8树脂5 g 3份置于相同的层析柱中, 径高比为1∶9, 取0.128 g/ml的药液40 ml, 以3 ml/ min的流速上样, 收集残留液, 50 ml水洗柱, 用95%乙醇适量, 流速分别为1、2、3 ml/min洗脱, 每20 ml收集1次洗脱液,检测三种成分的含量, 直到检测不到为止, 合并洗脱液, 检测三种成分的总量, 并各取50 ml洗脱液蒸干, 测定固形物的量, 再用10 ml甲醇溶解固形物, 并测定固形物中三种成分含量, 结果见图10。洗脱流速以1 ml/min为最佳, 但三者差异较小, 考虑到洗脱时间, 选择3 ml/min。
2.2.6洗脱曲线的绘制 取AB-8树脂5 g置于层析柱中,径高比为1∶9, 取0.128 g/ml的药液40 ml, 以3 ml/min的流速上样, 收集残留液, 50 ml水洗柱, 用95%乙醇适量, 流速分别为3 ml/min洗脱, 每20 ml收集1次洗脱液, 检测三种成分的含量, 直到检测不到为止, 以洗脱液体积为横坐标, 三种成分的质量浓度为纵坐标绘制洗脱曲线, 结果见图11。95%的乙醇洗脱液洗脱至200 ml时能将三种成分完全洗脱。

图10 洗脱流速考察结果图

图11 洗脱曲线
2.2.7大孔吸附树脂纯化工艺的验证 按照上述实验结果,最终确定最佳纯化工艺为:以AB-8树脂, 上样液体积与树脂用量的比例为40 ml∶5 g, 上样浓度为0.128 mg/ml, 流速为3 ml/min, 径高比为1∶3以上;洗脱乙醇浓度为95%, 洗脱流速为3 ml/min。按照上述上样工艺和洗脱工艺平行3份, 验证所选工艺。结果见图12。工艺平行性较好, 能得到较好的验证。

图12 工艺验证结果
2.3提取液纯化前后HPLC色谱图的对比研究 取20 ml提取液和相对提取液的过柱滤液置于蒸发皿中蒸干, 测定固形物的含量, 再取20 ml的甲醇溶解, 取适量按2.1.1的色谱条件进样, 得到色谱图13。过柱前后HPLC的色谱峰没有增减,所选6种木脂素的转移率都能达到75%以上, 在固形物中的含量由99.58 mg/g上升到299.11 mg/g, 占固形物含量的30%。固形物中醇甲、甲素、乙素转移率为80%, 固形物中乙素含量为80 mg/g, 固形物得率:4.8 g/100 g药材。以上数据显示选用AB-8大孔吸附树脂纯化五味子提取液合理。

图13 过柱前后HPLC色谱图比较
2.4大孔树脂纯化固形物中总木脂素的含量测定
2.4.1标准曲线绘制 采用紫外分光光度法测定, 准确称取适量五味子乙素标准品于10 ml容量瓶中, 用甲醇定容,取0.1 ml甲醇作为空白样, 依次取0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7 ml五味子乙素标准溶液, 挥去甲醇, 再分别精密加入5%变色酸澄清水溶液0.5 ml、硫酸1.5 ml、水1 ml摇匀, 置沸水浴中加热30 min后, 迅速冷却, 以上述甲醇管为空白, 分别在488 nm波长处测定吸光度, 计算含量, 以五味子乙素含量为横坐标(X), 以吸光度为纵坐标(Y)绘制标准曲线, 得回归方程Y=12.51X-0.100, r2=0.988。
2.4.2木脂素含量测定 取适量纯化液3等份分别置于蒸发皿中蒸干, 用甲醇溶解, 置于容量瓶中, 再加甲醇定容到一定量, 精密吸取适量置于EP管中, 挥干甲醇, 按2.4.1试剂的加入方法和测定方法, 测定固形物中总木脂素的含量。结果见表4。

表4固形物中木脂素含量测定
3 讨论
3.1本文选取三种木脂素作为大孔树脂纯化五味子木脂素的纯化工艺指标, 是因为首先这三种成分的极性在木脂素中位于高中低的位置, 能最大程度的代表木脂素成分的富集,再者, 这三种成分在木脂素中含量大, 在临床上的疗效更为广泛确切, 没有选择总木脂素作为指标, 因为显色反应条件不稳定, 误差大, 红外测定精密度差[4-9]。
3.2AB-8大孔吸附树脂最适用于从极性溶剂中吸附弱极性物质。五味子中的木脂素成分大多具有联苯环辛二烯母核,是一类低极性小分子化合物[10]。用AB-8来纯化能达到很好的分离效果。
3.3由于木脂素为难溶性有效部位, 浓度过大会形成混悬液, 导致上样量难以控制, 堵塞大孔树脂[11-13]。所以在上样浓度的考察时, 结合预实验选择上述的三种浓度。上样流速间没有明显的差异, 考虑到上样时间和工业生产, 选择最大的流速。
3.4通过对比纯化前后的色谱图, 作者发现6种木脂素的转移率都在75%以上, 固形物量减少两倍, 总木脂素的量占固形物的64%。结果表明大孔树脂纯化能达到精致富集木脂素类成分的目的。可用于五味子药材入药的前处理。
本文建立了同时测定固形物中6种木脂素的方法, 为五味子固形物质量控制提供依据。选择五味子醇甲、五味子甲素、五味子乙素作为大孔树脂纯化的指标, 最后确定了纯化工艺为:AB-8树脂纯化, 上样药液浓度0.128 g/ml, 流速3 ml/min, 径高比1∶3以上, 95%乙醇洗脱。对纯化前后的固形物进行含量测定和分析, 确定AB-8纯化五味子木脂素的科学合理性。
[1] 尹湉, 刘严生, 于叶玲.用大孔树脂提取和纯化五味子总木脂素.沈阳药科大学学报, 2007, 24(2):113-117.
[2] 薛雪, 孟宪军, 李斌, 等.AB-8大孔树脂分离纯化北五味子藤茎总木脂素的研究.食品与机械, 2011, 27(1):22-25.
[3] 莫永俊, 汪春泉, 王琦, 等.大孔树脂纯化五味子总木脂素总三萜工艺研究.制剂与技术, 2013, 10(5):106-111.
[4] 孟宪军, 朱力杰, 李斌, 等.大孔树脂纯化北五味子藤茎中总三萜的研究.食品工业科技, 2012, 4(3):339-342
[5] Gu W, Wei NY, Wang ZZ.LC Analysis of lignans from schisandra sphenanthera rehd.et wils.Chemistry and Materials Science, 2008, 67(11-12):979-983.
[6] 郭丽冰, 王蕾.常用大孔吸附树脂的主要参数和应用情况.中国现代中药, 2006, 8(4):26-32.
[7] 李洪洋, 文连奎.大孔树脂分离纯化五味子醇甲的研究.食品与机械, 2011, 27(3):56-58.
[8] 付绍平, 杨博, 陈彤.北五味子的液相色谱指纹图谱的建立.色谱, 2008, 26(1):64-67.
[9] 黄晓东, 任旷.五味子木脂素成分结构及类型研究进展.中国中医药, 2009, 7(12):165-166.
[10] Tian K, Qi SD, Chen YQ, et al.Separation and determination of lignans from seeds of schisandra species by micellar electrokinetic capillary chromatography using ionic liquid as modifier.chromatography A, 2005, 1078(1/2):181-187.
[11] 郭铁英, 李名扬.木脂素类化合物的研究进展.现代农业科技, 2008(9):199-201.
[12] 可成友, 高珍, 康宏玲.北五味子植物化学成分及其活性的研究进展.辽宁农业科学, 2007(3):57-60.
[13] 赵铁.五仁醇固体分散体胶囊的研究.沈阳药科大学, 2005.
Process investigation on purification of schisandra chinensis lignans by macroporous resin
HUANG Jiafu, ZHOU Xiao-dong, ZHOU Shan.
Department of Drug and Equipment, The People’s Liberation Army 102nd Hospital, Changzhou 213003, China
ObjectiveTo establish a method for determining concentrations of schisandrol A, deoxyschisandrin and schisandrin B from Schisandra chinensis by high performance liquid chromatography (HPLC).To use macroporous resin for purification of schisandrol A, and to filtrate the superior resin for the purification of total lignans from schisandra chinensis and the optimum purification process.At last, to compare the results of HPLC chromatograms before and after purification, and to determinate the content of total lignans from schisandra chinensis.MethodBased on results of adsorption and desorption of different resin for the three ingredients using dynamic injection method, the best purified resin was selected.Injection and elution volume of the three components above-mentioned were measured to determine the best injection and elution process.The reasonableness of the purification was examined according to the results of the HPLC chromatograms before and after the purification process.The content of total lignans from schisandra chinensis after purification was measured by UV spectrophotometry.ResultsThe best purifying- resin was AB-8; the concentration of injection was 0.128 g/ml; the flow rate was 3ml/min; the diameter ratio was more than 1:3 and the ethanol elution was 95%.According to the HPLC chromatograms, chromatographic peak was not reduced after the purification process.The content of total lignans from schisandra chinensis accounted for more than 60% of the total solids after purification.ConclusionThe purification process is reasonable, simple, practical and suitable for industrial production.
Schisandra chinensis lignans; Macroporous resin; Purification; High performance liquid chromatography; UV spectrophotometry
2014-07-29]
213003 解放军第102医院药械科(黄家富);南京军区南京总医院汤山分院药械科(周晓东);正大天晴药业集团股份有限公司南京研发中心(周山)

