蓝隐藻叶绿素蛋白复合物的圆二色谱特性
梁 源,陈 敏
(烟台大学生命科学学院,山东 烟台 264005)
海生藻类门类繁多,进化形式多样,是进行比较光合作用的良好材料.隐藻因其同时含有水溶性藻胆蛋白和脂溶性叶绿素蛋白两套捕光体系,因而成为研究光合系统结构进化与功能的难得材料.近几十年对隐藻色素蛋白复合物的研究主要针对水溶性的藻胆蛋白,而对于叶绿素蛋白复合物的探究则涉及极少,原因主要有2点:一是叶绿素蛋白复合物必须借助去污剂增溶才能将其从膜上剥离出来;二是叶绿素色基和蛋白质的结合方式是非共价的,极易在分离时脱落从而造成复合物失活.
目前,国内外对隐藻叶绿素蛋白复合物的分离曾采用SDS-PAGE圆盘电泳[1]、等电聚焦电泳[2](isoelectric focusing,IEF)、蔗糖密度梯度离心[3-4](sucrose density gradient centrifugation,SDGC)和快速蛋白液相色谱法[5](fast protein liquid chromatography,FPLC),分离的条带数量4~9条不等,通常包括对PSⅡ和PSⅠ各1条以及数量不等的捕光复合物,此外还报道有藻蓝蛋白(phycocyanin,PC)-叶绿素(chlorophyll,Chl)a/c-蛋白复合物的存在[1-2, 4].对复合物的特性分析曾采用光氧化活性、吸收光谱、荧光光谱及多肽组成等方面的测定,但未见对其圆二色谱(circular dichroism,CD)特性的报道,至于复合物的二、三级空间构象等则未有涉及.经比对,通过不同方式分离到的隐藻叶绿素蛋白复合物不仅条带数目不等,在复合物构成、光谱特性等方面也存在一定差异.可见,隐藻叶绿素蛋白复合物在分离方法、条件以及特性研究等方面尚且需要进一步的比对和探究.
CD谱被广泛应用于蛋白质结构研究领域,能够反映蛋白质不同层次的构象特性,尤其是可见光区的CD谱还能够给出蛋白质辅基的种类和状态等信息,但要得到重复性良好的谱图,对于待测样品活性状态以及稳定性的要求较高.本实验以海生蓝隐藻(Chroomonasplacoidea)为材料,控制增溶条件,采用SDGC法分离脂溶性的隐藻叶绿素蛋白复合物,尝试利用CD谱技术对分离到的3种叶绿素蛋白复合物进行了全波段(190~750 nm)扫描并做了初步解析,旨在了解隐藻叶绿素蛋白复合物的空间折叠状态,确定隐藻叶绿素蛋白复合物的特性,以期对隐藻光合系统结构与功能研究提供新的理论依据.
1 材料与方法
1.1 蓝隐藻类囊体膜的制备
蓝隐藻的培养、收集及细胞破碎参照文献[6],用弗式压力破碎机(美国SLM Aminco)在相对压强为1 000 psi[5]条件下破碎细胞.类囊体膜的制备方法参照文献[1],参照Jeffrey公式[7]调整叶绿素浓度为0.8~1.5 mg/mL后于-80 ℃冰箱冻存以备后用.以上所有操作除特殊说明外,均冰浴避光进行.
1.2 叶绿素蛋白复合物的蔗糖密度梯度离心分离
蔗糖溶液(含0.02% Triton X-100)梯度预先铺完后于4 ℃冰箱预冷.将类囊体膜用EDTA/山梨醇清洗2次后弃上清,加入等体积的pH 8.0的三乙醇胺将类囊体膜沉淀悬浮起来,再加入20%Triton X-100增溶至终浓度为0.7%[2],于4 ℃下增溶20 min,36 000×g离心去除膜碎片后取上清上样.上样量0.95~1.5 mL离心管体积为12.5 mL),上样并调平后于超速离心机(美国BECKMAN)中4 ℃,178 305×g离心20 h,离心结束后立即拍照,用注射器取出各条带后分装冻存于-80℃冰箱以备后用.以上所有操作除特殊说明外,均冰浴避光进行.
1.3 室温吸收光谱测定
将分离得到的各叶绿素蛋白复合物用50 mmol/L Tricine-NaOH(pH 8.0)稀释后,使用TU-1900(北京普析通用)双光束紫外可见分光光度计测定室温吸收光谱,扫描范围400~750 nm.
1.4 室温圆二色谱测定
使用J-810圆二色谱仪(日本JASCO)扫描叶绿素蛋白复合物的CD信号,其中远紫外区比色皿光径0.1 cm,光谱带宽3.0 nm,扫描范围190~250 nm;近紫外区比色皿光径0.1 cm,光谱带宽1.0 nm,扫描范围250~340 nm;可见光区比色皿光径1.0 cm,光谱带宽1.0 nm,扫描范围340~750 nm.样品测试前以超纯水进行基线校正.
1.5 二级结构比例测算
复合物的二级结构含量计算使用圆二色谱仪标配的Jasco Secondary Structure Estimation(version 1.0)软件,标准对照文件YANG. jwr由JASCO公司提供.
2 实验结果
2.1 叶绿素蛋白复合物的超速离心分离
类囊体膜经EDTA/山梨醇多次清洗去除大部分阳离子后,在超纯水配置的蔗糖梯度中进行SDGC,可稳定得到4条叶绿素蛋白复合物条带(图1A),由上至下依次命名为BandⅠ~ Band Ⅳ. BandⅠ位于0.3 mol/L蔗糖密度梯度处,呈现墨绿色,相对分布最多;BandⅡ位于0.5 mol/L的蔗糖密度梯度上部,呈黄绿色;Band Ⅲ位于0.5 mol/L蔗糖密度梯度下部,呈鲜绿色;Band Ⅳ位于1.5 mol/L的蔗糖密度梯度处,含量最少,呈翠绿色.而采用Tricine-NaOH缓冲液(50 mmol/L,pH 8.0)配制的蔗糖梯度进行SDGC后只能得到3个复合物条带(图1B),依次为Band α~ Band γ.经复合物条带的颜色、相对分布位置、光谱分析比对(图2)以及前期实验结果[4]判定,图1A中的BandⅠ~ Band Ⅲ与图1B中的Band α~ Band γ分别相对应, BandⅠ为小捕光复合物,BandⅡ为聚合程度较大的捕光复合物,Band Ⅲ为PSⅡ颗粒复合物,而图1B中较图1A缺少的大分子质量条带Band Ⅳ为PSⅠ颗粒复合物.原因可能是由于阳离子屏蔽了膜表面LHCII上的羧基负电荷,维持类囊体膜处于跺叠状态,而PSII主要位于跺叠区,因此更有利于激发能向PSII的分配[8].这表明阳离子浓度在很大程度上影响着隐藻光合系统结构,是导致分离过程中出现分离产物有差异的重要因素.

图1 类囊体膜超速离心结果
2.2 色素蛋白复合物室温吸收光谱
针对图1A的分离结果,SDGC分离到的4个复合物条带的室温吸收光谱特性如图2所示.蓝区435~440 nm以及红区670~680 nm的吸收峰来自Chla;蓝区460 nm附近的吸收峰来自Chlc,而对应于红区630 nm附近的吸收由于PC的存在被掩蔽[9];490~500 nm附近的吸收峰来自类胡萝卜素;580~590 nm的吸收可能与少量非共价形式特异结合的蓝隐藻PC有关[9].

图2 叶绿素蛋白复合物吸收光谱(室温)
比对4个复合物的室温吸收光谱可发现:(1)所有分离到的复合物在红区Chla的吸收峰均高于670 nm,表明我们分离的叶绿素蛋白复合物活性状态良好.(2)BandⅠ和BandⅡ在460 nm附近Chlc的吸收峰以及493 nm附近类胡萝卜素的吸收峰比Band Ⅲ和Band Ⅳ要明显的多且相对吸收较高,这是捕光复合物的典型特征.(3)Band Ⅲ和Band Ⅳ在460 nm附近Chlc的吸收较少,且Chla在红区的吸收峰位于677~678 nm,与捕光复合物的位于671~673 nm的峰相比有明显红移,这是中心复合物特征标志.(4)蓝隐藻的中心复合物(PSⅡ和PSⅠ)与捕光复合物相比,其红区的吸收峰均偏长,这与高等植物中仅PSⅠ在红区的吸收峰有长波不同.
2.3 色素蛋白复合物室温圆二色谱
圆二色谱反映的是光与分子间的能量交换关系,有吸收的那些波段才能有相应的圆二色性信号.
2.3.1 复合物远紫外区圆二色谱 远紫外区(190~250 nm)的信号是由肽键的电子跃迁产生的,可以揭示肽骨架结构信息,因此常用于计算蛋白质中二级结构的比例[10].如α-螺旋(helix)的极值波长在191 nm处有1个正峰,在207~210 nm和221~222 nm处有2个负峰;β-折叠(sheet)的极值波长在195~197 nm处有1个正峰,在217~218 nm处有1个负峰;β-转角(turn)的极值波长在205 nm处有1个正峰,在220~230 nm处有1个弱信号负峰,在180~190 nm处有1个强信号负峰;而无规卷曲(random coil)在212 nm处有1个正峰,在200 nm处有1个负峰.
复合物BandⅡ~BandⅣ的远紫外区CD光谱如图3所示,比对3种叶绿素蛋白复合物的CD谱图可发现:(1)PSⅠ(图3C)在192(+)处α-螺旋的信号峰以及202(+)处β-转角的信号峰比大捕光复合物(图3A)和PSⅡ(图3B)要明显的多,但未发现β-折叠对应的信号峰.(2)β-折叠的信号在大捕光复合物中表现为198(+)单正峰,而在PSⅡ中表现为195(+)和198(+)的双正峰.

图3 复合物远紫外区圆二色谱
根据Jasco Secondary Structure Estimation软件对3种复合物二级结构进行测算,其比例见表1.从表1中可以明显看出:(1)所测定的3种叶绿素蛋白复合物中无规卷曲的比例很相近,都在30%左右.(2)大捕光复合物和PSⅡ颗粒复合物的二级结构元素比例大致相似.(3)与大捕光复合物及PSⅡ颗粒复合物相比,PSⅠ颗粒复合物中含有更高比例的α-螺旋(34.2%)和较高比例的β-转角(35.3%),但不存在β-折叠,此结果是否为PSⅠ复合物的普遍性还需要进一步的比对和确定.
预热器、蒸发器接受热水的热量,将工质R245fa加热成高温高压的蒸汽(非水蒸气),然后进入膨胀机推动转子做功,同时降温降压。蒸汽从膨胀机排出后,进入油分离器,分离润滑油,气体进入冷凝器冷凝成液体,液体被液体泵升压,进入预热器、蒸发器,完成一轮循环,见图1。

表1 复合物二级结构比例
2.3.2 复合物近紫外区圆二色谱 近紫外区(250~340 nm)的信号是由侧链芳香基团的电子跃迁引起的,因此当芳香族氨基酸残基和二硫键处于不对称微环境时,在近紫外区表现出CD信号.如Phe在255、261、268 nm附近有信号峰;Tyr在277 nm附近有信号峰;Trp在279、284、291和305 nm附近有信号峰;Pennington等[11]通过研究隐藻中类胡萝卜素的CD谱指出:320~335 nm的信号峰则源于β,ε-胡萝卜素;而二硫键的变化表现在整个近紫外区.
复合物Band Ⅱ~Band Ⅳ的近紫外区CD光谱如图4所示, 大捕光复合物(图4A)的CD谱在近紫外区呈现4个峰:263(+)、269(+)、283(-)、331(+),其中263、269 nm的正峰源自Phe,283 nm负峰源自Trp,331 nm正峰源于β,ε-胡萝卜素.PSⅡ复合物(图4B)的CD谱在近紫外区呈现3个峰:266(+)、289(-)、333(+),其中266 nm正峰源自Phe,289 nm负峰源自Trp,333 nm正峰源于β,ε-胡萝卜素.PSⅠ复合物(图4C)的CD谱在近紫外区呈现6个峰:267(+)、288(-)、300(-)、308(-)、319(+)、333(+),其中267 nm正峰源自Phe,288、300、308 nm负峰源自Trp,319、333 nm正峰源于β,ε-胡萝卜素.
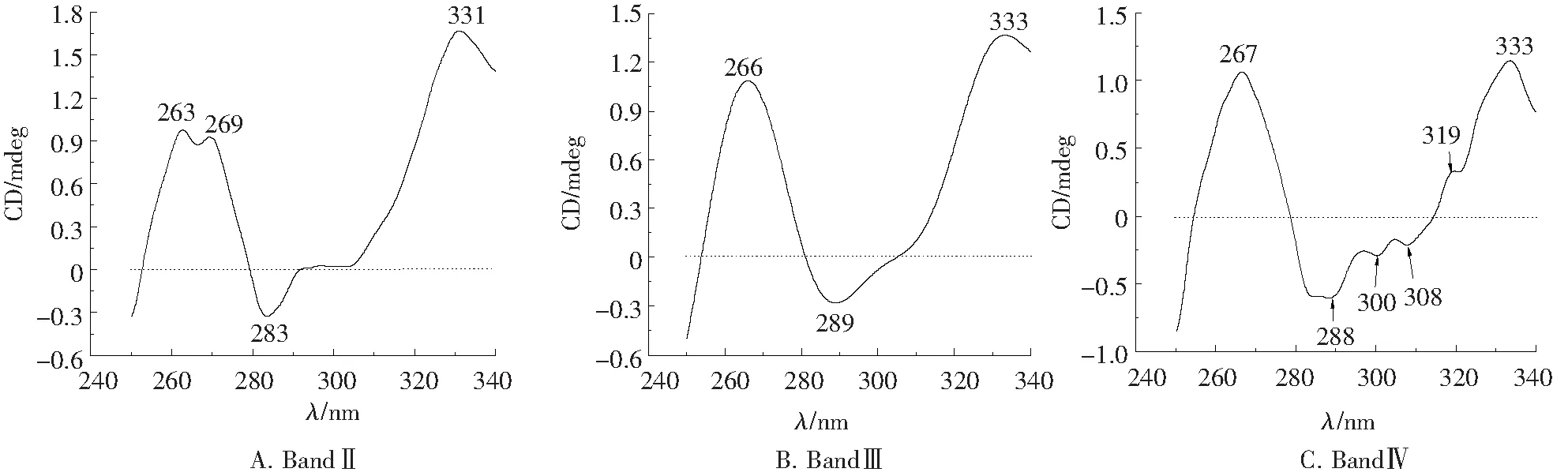
图4 复合物近紫外区圆二色谱
通过对捕光复合物、PSⅡ、PSⅠ近紫外区CD信号的比对,发现:(1)SDGC分离到的各复合物组分中未观测到Tyr的信号峰,表明叶绿素蛋白复合物中可能不含Tyr.这与本实验对类囊体膜所进行的室温及77 K近紫外区荧光发射光谱的测定结果相吻合:类囊体膜的发射光谱中未观测到303 nm附近Tyr的荧光发射峰(结果未发表).(2)Phe的信号在捕光复合物中为双正峰,而在中心复合物中则为单正峰,这可能是捕光复合物和中心复合物的一个差别.(3)在捕光复合物和PSⅡ中,Trp的信号峰表现为单负峰,β,ε-胡萝卜素的信号峰表现为单正峰,而在PSⅠ中则分别为三负峰和双正峰的信号峰.但此现象是否为PSⅠ复合物的普遍性尚需进一步的比对和确定.
2.3.3 复合物可见光区圆二色谱 可见光区(340~750 nm)的信号则是由蛋白质辅基等外在发色团造成的,且此区域的信号峰通常能与吸收光谱的吸收峰相对应,如去镁Chla可能在410 nm附近有信号峰;Chla在435~445 nm以及670 nm附近有信号峰[12];类胡萝卜素可能在480~510 nm处有信号峰;根据Maccoll等[13-15]以及Doust等[16-17]的研究结果,推测CD谱中525~530 nm处的信号峰可能源于PC中β亚基的DBV色基对(β50/61);610~615 nm处的信号峰可能源于PC中β亚基的PCB(β158);而650~660 nm的信号峰则可能源于PC中β亚基的PCB(β82).
复合物Band Ⅱ~Band Ⅳ的可见光区CD光谱如图5所示,大捕光复合物(图5A)的CD谱在可见光区呈现3个峰:412(+)、511(-)、675(-),其中412 nm信号峰可能对应去镁Chla,675 nm的信号峰对应Chla,511 nm信号峰可能对应类胡萝卜素.PSⅡ复合物(图5B)的CD谱在可见光区呈现6个峰:439(+)、488(-)、525(-)、611(-)、659(-)、691(-),其中439 nm信号峰对应Chla,488 nm信号峰可能对应类胡萝卜素,525 nm信号峰可能对应DBV色基对(β50/61),611 nm信号峰可能对应PCB(β158),659 nm信号峰可能对应PCB(β82).PSⅠ复合物(图5C)的CD谱在可见光区亦呈现6个峰:441(+)、485(-)、526(-)、610(-)、654(-)、695(-),其中441 nm信号峰对应Chla,485 nm信号峰可能对应类胡萝卜素,526 nm信号峰可能对应DBV色基对(β50/61),610 nm信号峰可能对应PCB(β158),654 nm信号峰可能对应PCB(β82).
Faludi-Daniel等[18]对从含Chla/b的高等植物中所分离的捕光叶绿素蛋白复合物(light harvesting chlorophyll protein,LHCP)进行CD谱测定,结果表明:LHCP在690 nm处有很明显的负峰,而在蓝隐藻的LHCP中却未发现此处的峰位,相反的,在中心复合物PSⅡ和PSⅠ中发现690 nm附近有明显的负峰,这可能亦是隐藻捕光复合物和中心复合物的一个差别.

图5 复合物可见光区圆二色谱
3 讨 论
高等植物的类囊体膜上主要存在PSⅠ、PSⅡ、LHCⅡ、cytb6f、ATP酶五大类超分子复合物.其中PSⅠ、PSⅡ和LHCⅡ作为含有Chl的蛋白复合物,担负着光合作用中光能吸收、传递、转化的功能.但光合系统中各复合物的结构是动态的:当光照强度、阳离子浓度等变化时,PSⅡ可在单体和二聚体之间转变,PSⅠ则可形成三聚体.LHCⅡ捕光复合物作为“移动天线”,可在类囊体膜上迁移,当PSⅡ能量满溢时,与PSⅠ结合,反之亦然[19].因此,当分离条件变化时,所得到的叶绿素蛋白复合物的种类和大小不同.所以,如何优化分离方法,得到组成稳定且保持活性状态复合物将是研究的关键.
由于膜蛋白难于分离,且分离后的条带活性状态很难维持,因此必须及时对其各方面性质进行测定.当前对通过各种分离方法所得到的隐藻叶绿素蛋白复合物条带的性质的报道和研究,多采用各种光谱学方法,包括吸收光谱、荧光光谱(包括室温和低温)等,但未涉及CD谱,这与CD谱较为复杂,且叶绿素蛋白复合物的状态易于发生变化有关,要得到稳定性良好的CD谱图有较大的难度.实验在稳定复合物分离条件和结果的基础上,给出了以下包括远紫外区、近紫外区和可见光区的全波段CD谱的稳定谱图.
(1)远紫外区(190~250 nm):目前对隐藻叶绿素蛋白复合物的各级结构信息(包括一级结构序列和高级空间结构)没有任何相关报道,本实验给出了捕光复合物、PSⅡ和PSⅠ颗粒3种叶绿素蛋白复合物的远紫外区CD谱图,并借助Jasco Secondary Structure Estimation软件对其二级结构进行了解析.结果显示,3种叶绿素蛋白复合物中所含无规卷曲的比例大致相近,约为30%;PSⅡ和捕光复合物的各二级结构元素比例大致相似,α-螺旋、β-折叠及β-转角约各占20%~25%左右;与PSⅡ和捕光复合物相比,PSⅠ有更高比例的α-螺旋及β-转角,但几乎不含有β-折叠,说明隐藻PSⅠ复合物应主要以α-螺旋跨膜.
(2)近紫外区(250~340 nm):近紫外区CD谱图提示了其芳香族氨基酸排布等三级结构信息.结果显示,3种叶绿素蛋白复合物均未有Tyr的信号峰,似乎暗示隐藻叶绿素蛋白复合物不含或缺少Tyr;在3种复合物中,捕光复合物的Phe在这一区域呈现263、269 nm 2个正峰,而PSⅠ和PSⅡ中心复合物都只在267 nm呈现1个正峰,因此,Phe的信号峰是否为双正峰将可能成为区别隐藻捕光复合物和中心复合物的一个表征;此外,与PSⅡ和捕光复合物相比,PSⅠ的Trp信号峰和β,ε-胡萝卜素信号峰则更为复杂.
(3)可见光区(340~750 nm):可见光区的CD信号在一定程度上反映出色基间的相互作用(能量传递)关系,但隐藻叶绿素蛋白复合物为同时含有藻胆素、叶绿素、类胡萝卜素等多种色基的超分子体系,因此复合物色基组成较高等植物更为复杂.实验给出了3种叶绿素蛋白复合物的可见光区谱图,并结合室温吸收光谱对CD谱做了初步解析和比对,其中690 nm附近信号峰的有无是捕光复合物和中心复合物的一个区别;在CD谱的相邻的正负峰相交处极可能有色基对的存在,但本实验分离到的隐藻叶绿素蛋白复合物中未观测到激子对的存在.
以往的研究结果显示,不同性质的叶绿素蛋白复合物的吸收谱图各有特色,因此常常可用于初步判定和描述复合物条带的性质;低温荧光光谱可以区分PSⅠ和PSⅡ复合物,但室温荧光发射谱则没有明显区别.本实验结果首次给出了3种不同性质的隐藻叶绿素蛋白复合物的CD谱图特性,测定结果不仅补充了隐藻叶绿素蛋白复合物性质研究的空白,也为叶绿素蛋白复合物的分析和鉴定提供了新的光谱鉴定依据.
致谢:衷心感谢山东大学微生物国家重点实验室在CD谱测定过程中给予的帮助.
参考文献:
[1]陈敏,李媛. 蓝隐藻色素蛋白复合物的分离和分析[J]. 烟台大学学报:自然科学与工程版, 2006, 19(3): 187-192.
[2]Chen Min, Li Sihui. A novel phycocyanin-Chla/c2-protein complex isolated from chloroplasts of Chroomonas placoidea[J]. Chinese Chemical Letters, 2007, 18(11): 1374-1378.
[3]Janssen J, Rhiel E. Evidence of monomeric photosystemⅠ complexes and phosphorylation of chlorophylla/c-binding polypeptides inChroomonassp. Strain LT(Cryptophyceae)[J]. International Microbiology, 2008, 11(3): 171-178.
[4]王扬. 蓝隐藻藻蓝蛋白-叶绿素蛋白复合物的分离及其结构与性质的研究[D]. 烟台:烟台大学, 2010.
[5]Kereiche S, Kouril R, Oostergetel G T, et al. Association of chlorophylla/c2complexes to photosystem Ⅰ and photosystem Ⅱ in the cryptophyteRhodomonasCS24 [J]. Biochimica et Biophysica Acta, 2008, 1777(9): 1122-1128.
[6]王扬,陈敏. 蓝隐藻的培养及色素-蛋白复合物分离[J]. 烟台大学学报:自然科学与工程版, 2010, 23(3): 188-193.
[7]Jeffrey S, Humphrey G. New spectrophotometric equations for determining chlorophyllsa,b,c1andc2in higher plants, algae and natural phytoplankton[J]. Biochem Physiol Pflanzen, 1975, 167: 191-194.
[8]韩博平,韩志国,付翔. 藻类光合作用机理与模型[M]. 北京: 科学出版社, 2003:103-107.
[9]Lichtle C, Jupin H, Duval J C. Energy transfers from photosystem Ⅱ to photosystem Ⅰ in Cryptomonas rufescens (Cryptophyceae)[J]. Biochimica et Biophysica Acta, 1980, 591: 104-112.
[10]Kikuchi H, Wako H, Yura K. Significance of a two-domain structure in subunits of phycobiliproteins revealed by the normal mode analysis[J]. Biophys J, 2000, 79(3): 1587-1600.
[11]Pennington F C, Haxo F T, Borch G, et al. Carotenoids of Cryptophyceae[J]. Biochemical Systematics and Ecology, 1985, 13(3): 215-219.
[12]Goss R, Wilhelm C, Garab G. Organization of the pigment molecules in the chlorophylla/b/ccontaining algaMantoniellasquamata(Prasinophyceae) studied by means of absorption, circular and linear dichroism spectroscopy[J]. Biochimica et Biophysica Acta, 2000, 1457(3): 190-199.
[13]Maccoll R, Malak H, Cipollo J, et al. Studies on the dissociation of cryptomonad biliproteins[J]. The Journal of Biological Chemistry, 1995, 270(46): 27555-27561.
[14]Maccoll R, Eisele L E, Marrone J. Fluorescence polarization studies on four biliproteins and a bilin model for phycoerythrin 545[J]. Biochimica et Biophysica Acta, 1999, 1412(3): 230-239.
[15]Maccoll R, Williams E C, Eisele L E, et al. Chromophore topography and exciton splitting in phycocyanin 645[J]. Biochemistry, 1994, 33(21): 6418-6423.
[16]Marin A, Doust A B, Scholes G D, et al. Flow of excitation energy in the Cryptophyte light-harvesting antenna phycocyanin 645 [J]. Biophysical Journal, 2011, 101(4): 1004-1013.
[17]Novoderezhkin V I, Doust A B, Curutchet C. Excitation dynamics in phycoerythrin 545:Modeling of steady-state spectra and transient absorption with modified redfield theory[J]. Biophysical Journal, 2010, 99(2): 344-352.
[18]Faludi-Daniel A, Mustardy L A. Organization of chlorophyllain the light-harvesting chlorophylla/bprotein complex as shown by circular dichroism[J]. Plant Physiol, 1983, 73(1): 16-19.
[19]葛培根. 光合作用[M]. 合肥:安徽教育出版社, 1992:82-88.

