两种乙型肝炎病毒恩替卡韦耐药突变株质粒的构建及其病毒学特征分析
王雪艳,蒋栋,费然,魏来,陈红松
(北京大学人民医院,北京大学肝病研究所 丙型肝炎和肝病免疫治疗北京市重点实验室,北京 100044)
两种乙型肝炎病毒恩替卡韦耐药突变株质粒的构建及其病毒学特征分析
王雪艳,蒋栋,费然,魏来,陈红松Δ
(北京大学人民医院,北京大学肝病研究所 丙型肝炎和肝病免疫治疗北京市重点实验室,北京 100044)
目的构建乙型肝炎病毒(hepatitis B virus,HBV)恩替卡韦耐药突变株表达质粒并对其体外复制病毒学特征进行研究。方法以含1.2倍HBV DNA全基因的质粒pUC-HBV1.2-WT为模板,应用PCR定点诱变技术构建恩替卡韦耐药突变株质粒,转染人肝癌细胞系HepG2细胞,建立HBV体外复制细胞模型,分析耐药突变株复制水平及表达活性。结果成功构建恩替卡韦耐药突变株表达质粒pETV1(rtL180M+M204V+I169T+M250V)和pETV2(rtL180M+M204V+T184G+S202I)。HBV体外复制细胞模型培养上清可检测到HBsAg和HBeAg及HBV DNA,细胞内可检测到HBV复制中间体;耐药突变株复制能力分别为野生株的47.4%和38.6%。结论成功构建乙型肝炎病毒恩替卡韦耐药突变株表达质粒。不同突变形式的ETV耐药突变株体外复制能力较野生株下降。
乙型肝炎病毒;恩替卡韦;耐药;质粒
尽管存在有效的疫苗接种预防措施,乙型肝炎病毒(hepatitis B virus,HBV)感染仍然在全球范围内广泛分布并且可能导致严重的后果。据世界卫生组织2012年更新的相关资料显示,全球约20亿人曾感染过HBV,2.4亿慢性感染者,每年约有60万人死于急性或慢性HBV感染所致疾病[1]。我国属乙型肝炎高发区,2006年全国人群乙肝血清流行病学调查资料显示,乙肝疫苗预防接种工作的开展已使得我国一般人群HBV表面抗原(HBsAg)携带率从1992年的9.75%下降为7.18%[2-3]。但是我国人口众多,据此推算,我国仍有乙肝表面抗原携带者约9300万人,其中慢性乙型肝炎(chronic hepatitis B,CHB)患者约3000万[4]。
有效的抗病毒治疗可延缓CHB患者的肝脏疾病进程和减少死亡率[5]。目前临床药物主要为2种干扰素(Interferon,IFN)和5种核苷(酸)类似物(nucleoside/nucleotide analogs,NAs)[6]。NAs药物具有服用方便、抑制病毒复制能力强、副作用较小等优点,已成为临床首选。5种NAs分别为:拉米夫定(lamivudine,LAM)、阿德福韦酯(adefovir dipivoxil,DV)、替比夫定(telbivudine,LdT)、恩替卡韦(entecavir,ETV)和替诺福韦(tenofovir disoproxil fumarate,TDF)。
ETV可强效抑制HBV复制且具有高耐药基因屏障,是目前国内外CHB治疗临床指南推荐的一线抗病毒药物[7-8]。ETV是在LAM耐药位点rtM204I/V±rtL180M的基础上产生rtT169,rtT184,rtS202,或者rtM250位点的突变[9]。为研究恩替卡韦耐药HBV突变株的复制水平及表达活性,本研究旨在通过构建含有上述突变位点的质粒并瞬时转染人肝癌细胞系,建立HBV体外复制模型,分析耐药突变对病毒复制与表达的影响。
1 材料与方法
1.1 材料
1.1.1 质粒和细胞 pUC-HBV1.2-WT含1.2倍拷贝HBV全基因(基因型B,Genbank引入号为AY518556),可在肝癌细胞内复制表达[10]。人肝癌细胞系HepG2在37℃、5%CO2孵箱内用含10%胎牛血清的DMEN/F12培养基培养。质粒及细胞均由北京大学肝病研究所保存。
1.1.2 主要试剂 胎牛血清和DMEM/F12培养基购自美国Gibco公司,NucleoSpin Extract质粒凝胶回收试剂盒和NucleoBond PC EF无内毒素质粒提取纯化试剂盒购自德国MN公司,真核细胞转染试剂FuGENE HD购自德国Roche公司,各种限制性内切酶、T4 DNA连接酶及DNA分子量标准均购自美国NEB公司,HBV DNA荧光实时定量PCR试剂盒购自深圳凯杰生物工程有限公司,蛋白酶K购自美国Invitrogen公司,地高辛探针标记试剂盒、碱性磷酸酶抗地高辛抗体和CDP-Star试剂盒购自德国Roche公司。HBV核酸定量检测试剂盒购自深圳凯杰公司。
1.2 方法
1.2.1 PCR扩增 按照pUC-HBV1.2-WT中HBV DNA序列,通过Primer 5.0软件分析设计引物,在相应位置引入突变位点。引物由上海生工公司合成,引物名称和序列如下(见表1)。以rtL180M突变位点为例,以质粒pUC-HBV1.2-WT为模板,用引物F和rtL180M R1及引物rtL180M F1和R进行引物分段扩增,分别获得1091 bp和403 bp大小片段。1.2%琼脂糖凝胶电泳检测扩增产物,并通过凝胶回收纯化试剂盒回收纯化片段。将上述两步扩增产物纯化片段混合作为第2轮PCR反应模板,以引物F和R进行重叠延伸法获得含有rtL180M长度为1446 bp的片段。

表1 定点诱变PCR所用引物Tab.1 Primers used for site-directed mutagenesis
1.2.2 突变克隆筛选及鉴定 将PCR产物进行A-T克隆,EcoR I限制性酶切和DNA测序筛选含有预期突变的阳性克隆。以限制性内切酶双酶切阳性克隆和pUC-HBV1.2-WT质粒,电泳分离后将切胶回收目的片段进行连接、并转化挑取单克隆进行酶切和测序鉴定。以此类推,同样方法进行其他位点突变。
1.2.3 瞬时转染 通过NANODROP 2000紫外分光光度计进行质粒浓度定量。按照FuGENE HD转染试剂说明书进行操作,I型鼠尾胶原包被6孔细胞培养板,HepG2细胞融合至90%进行转染。每孔转染2μg目的质粒,转染后72 h收集培养细胞及上清。
1.2.4 细胞培养上清HBsAg和HBeAg检测 通过全自动酶免分析仪ARCHITECT-i2000及其配套试剂产品,采用化学发光微粒子免疫检测方法测定HBsAg和HBeAg。
1.2.5 细胞培养上清HBV DNA检测 应用DNase I消化细胞培养上清中质粒DNA,37℃孵育1 h,按照HBV核酸定量检测试剂盒说明书,使用LightCycler®II PCR仪(Roche公司,美国)进行HBV DNA荧光定量PCR。
1.2.6 细胞内HBV复制中间体检测 用PBS冲洗2次细胞培养板内细胞,加入细胞裂解液充分裂解,振荡后4℃静置15min,12000 g离心5min收集上清,DNase I消化外源质粒,加入蛋白酶K裂解液60℃裂解1 h;酚/氯仿抽提2次,乙醇沉淀后溶于20μL含RNase A的TE缓冲液。将提取的HBV DNA进行1.5%琼脂糖电泳,碱变性后虹吸转膜过夜,紫外交联后用含25 ng/mL地高辛探针的杂交液杂交过夜,封闭后按1∶10000加入抗地高辛抗体,室温孵育30 min,洗膜后加入CDP-Star试剂,压片曝光显影,扫描胶片,用Quantity One软件进行条带的相对灰度值分析。
1.3 统计学方法 应用SPSS16.0进行统计学分析,正态计量资料以“±s”表示。
2 结果
2.1 恩替卡韦耐药质粒的构建和鉴定 以野生株HBV复制质粒pUC-HBV1.2-WT为模板,利用PCR定点突变技术,构建得到恩替卡韦耐药突变株表达质粒,分别命名为pETV1(含位点rtL180M+M204V+I169T+M250V)和pETV2(含位点rtL180M+M204V+T184G+S202I)。质粒经酶切(见图1)和测序鉴定(见图2),显示引入突变位点正确。野生株、pETV1和pETV2突变质粒经EcoR I和HindⅢ双酶切后产生1.2倍HBV全长基因(3800 bp)和pUC18载体片段(2686 bp)。
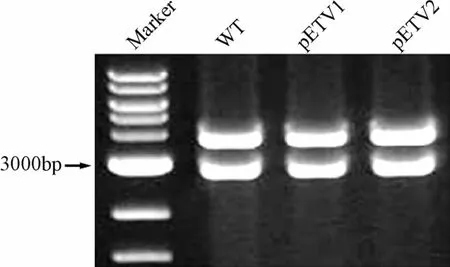
图1 野生株和恩替卡韦耐药突变质粒EcoR I和HindⅢ双酶切鉴定Fig.1 Identification ofwild-type and entecavir-resistant plasmids in the EcoR I/HindⅢdigestion
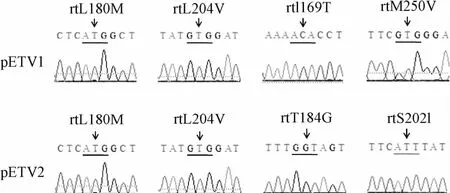
图2 恩替卡韦耐药质粒突变位点测序验证Fig.2 Validation of entecavir-resistant plasmids by DNA sequencing
2.2 抗原表达及病毒复制水平 野生型和突变型HBV质粒转染HepG2细胞72 h后,细胞培养上清中均存在高水平的HBsAg、HBeAg表达和HBV DNA复制(见表2),证明突变质粒转染人肝癌细胞系能够建立HBV体外复制,可向细胞培养上清中分泌成熟病毒颗粒及抗原。
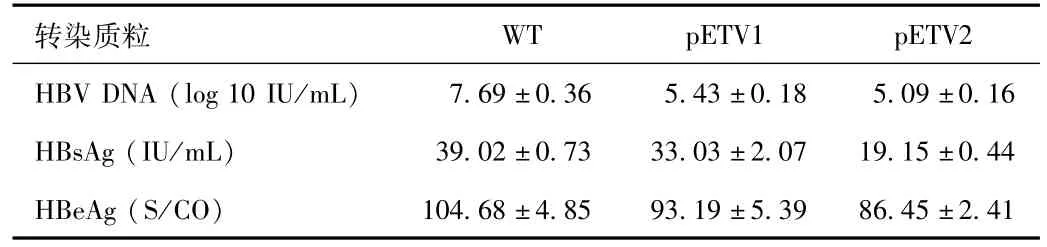
表2 野生株和恩替卡韦耐药株细胞上清中HBsAg、HBeAg和HBV DNA定量检测结果Tab.2 Quantitative analysis of HBsAg,HBeAg and HBV DNA levels in culturemedia from wild-type and entecavir-resistantmutant strains
2.3 HBV突变株病毒复制能力 转染HepG2细胞72 h后,用Southern blotting方法检测野生株和恩替卡韦耐药株HBV复制中间体,可见耐药株较野生株复制水平下降,pETV1和pETV2 HBV复制水平分别为野生株的47.4%和38.6%(见图3)。
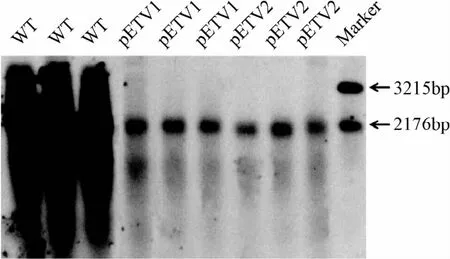
图3 Southern blotting检测野生株和恩替卡韦耐药株细胞内HBV复制中间体Fig.3 Analysis of replicative intermediate ofwild-type and entecavir-resistant HBV DNA by Southern blotting
3 讨论
NAs用于临床抗病毒治疗使得大量CHB患者受益,其作用靶点为HBV逆转录酶,它们在体内被细胞激酶转化为三磷酸盐活性形式,与天然核苷酸底物相互竞争参与DNA链的延长。L型核苷类(拉米夫定)和无环磷酸盐类(阿德福韦和替诺福韦)NAs由于3′端缺少-OH导致HBV DNA链合成的终止。恩替卡韦为D型环戊烷(烯)类NAs,具备高效的抑制病毒复制和细胞内磷酸化,作用于HBV聚合酶启动、前基因组mRNA逆转录成HBV负链DNA以及HBV正链DNA合成的3个环节。恩替卡韦与L型核苷类不同的是,当其以活性磷酸盐形式掺入DNA链后允许核苷酸继续加入,DNA链为减轻空间张力产生变形或封闭dNTP结合位点,导致DNA链终止,从而干扰DNA合成[11]。
NAs长期应用使得耐药突变株获得选择性扩增,替代野生株成为优势株,从而导致临床耐药现象的出现。耐药已成为CHB抗病毒治疗过程中最重要的问题之一。药物的耐药基因屏障是指引起病毒对药物敏感性下降所需的病毒基因组位点突变数目。LAM、ADV和LdT只需1个原发耐药位点突变即可产生耐药,是低耐药基因屏障药物。ETV需同时出现3个氨基酸位点突变才导致药物敏感性下降,是高耐药基因屏障药物[9]。临床试验数据显示,对于初治CHB患者,LAM治疗5年的耐药率为70%,ADV治疗5年的耐药率为29%,LdT治疗3年的耐药率为34%,ETV治疗6年的耐药率仅为1.2%,而TDF治疗6年没有发现耐药现象[12-16]。ETV对HBeAg阳性或阴性患者均能有效抑制病毒复制,但在LAM耐药基础上再出现1个突变位点即可产生ETV耐药。LAM耐药患者用ETV单药治疗5年,耐药发生率高达51%[17],因此对于ETV的表型耐药应有更深入的研究。
本研究以含1.2倍拷贝全长HBV基因组质粒为模板,运用PCR点诱变技术成功构建了2种含有恩替卡韦耐药突变位点的表达质粒,并以此耐药质粒瞬时转染人肝癌细胞系,建立了具有完整病毒复制和抗原表达的HBV体外复制模型。本文构建的质粒是在rtL180M+M204V基础上出现rtI169T+M250V或者rtT184G+S202I位点的突变,突变株的复制能力远远低于野生株,说明这些位点的突变使得HBV复制能力受损,为进一步分析HBV表型耐药及交叉耐药提供研究工具及相关信息。
[1]http://www.who.int/mediacentre/factsheets/fs204/en/.
[2]Liang X,Bi S,YangW,et al.Epidemiological serosurvey of Hepatitis B in China-Declining HBV prevalence due to Hepatitis B vaccination[J]. Vaccine,2009,27(47):6550-6557.
[3]Liang X,Bi S,Yang W,et al.Evaluation of the impact of hepatitis B vaccination among children born during 1992-2005 in China[J].J Infect Dis,2009,200(1):39-47.
[4]Lu FM,Zhuang H.Managementof hepatitis B in China[J].Chin Med J(Engl),2009,122(1):3-4.
[5]Liaw YF.Hepatitis B virus replication and liver disease progression:the impact of antiviral therapy[J].Antivir Ther,2006,11(6):669-679.
[6]Kwon H,Lok AS.Hepatitis B therapy[J].Nat Rev Gastroenterol Hepatol,2011,8(5):275-284.
[7]European association for the study of the liver.EASL clinical practice guidelines:Management of chronic hepatitis B virus infection[J].J Hepatol,2012,57(1):167-185.
[8]Lok AS,McMahon BJ.Chronic hepatitis B:update 2009[J]. Hepatology,2009,50(3):661-662.
[9]Tenney DJ,Levine SM,Rose RE,etal.Clinical emergence of entecavir-resistant hepatitis B virus requires additional substitutions in virus already resistant to Lamivudine[J].Antimicrob Agents Chemother,2004,48(9):3498-3507.
[10]WangY,Wei L,Jiang D,et al.In vitro resistance to interferon of hepatitis B virus with precore mutation[J].World J Gastroenterol,2005,11(5):649-655.
[11]Langley DR,Walsh AW,Baldick CJ,et al.Inhibition of hepatitis B virus polymerase by entecavir[J].JVirol,2007,81(8):3992-4001.
[12]Lok AS,Lai CL,Leung N,et al.Long-term safety of lamivudine treatment in patients with chronic hepatitis B[J].Gastroenterology,2003,125(6):1714-1722.
[13]Hadziyannis SJ,Tassopoulos NC,Heathcote EJ,etal.Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B for up to 5 years[J].Gastroenterology,2006,131(6):1743-1751.
[14]SetoWK,Lai CL,Fung J,et al.Significance of HBV DNA levels at12 weeks of telbivudine treatmentand the 3 years treatmentoutcome[J].J Hepatol,2011,55(3):522-528.
[15]Chang TT,Lai CL,Kew Yoon S,etal.Entecavir treatment for up to5 years in patients with hepatitis B e antigen-positive chronic hepatitis B[J]. Hepatology,2010,51(2):422-430.
[16]Kitrinos KM,Corsa A,Liu Y,etal.No detectable resistance to tenofovir disoproxil fumarate after 6 years of therapy in patients with chronic hepatitis B[J].Hepatology,2014,59(2):434-442.
[17]Reijnders JG,Deterding K,Petersen J,etal.Antiviral effectofentecavir in chronic hepatitis B:influence of prior exposure to nucleos(t)ide analogues[J].JHepatol,2010,52(4):493-500.
(编校:吴茜)
Construction of entecavir-resistant hepatitis B virusmutant p lasm ids and its virological characteristics
WANG Xue-yan,JIANG Dong,FEIRan,WEILai,CHEN Hong-songΔ
(Beijing Key Laboratory of Hepatitis C and Immunotherapy for Liver Diseases,Hepatology Institute of Peking University People's Hospital,Beijing 100044,China)
ObjectiveTo construct entecavir-resistance mutant plasmids of hepatitis B virus with replication competence,and study their replication capacity in transiently transfected HepG2 cells.MethodsThe plasmid containing the entire HBV(1.2 copies)genomewas used to construct objective plasmids via PCR-based site-directed mutagenesis in vitro.The constructed plasmids were validated by DNA sequencing.After transiently transfected into HepG2 cells,HBsAg and HBeAg in supernatants were measured by ELISA,HBV DNA levels in supernatants and Intracellular HBV replicative intermediates were measured by Real-time PCR and Southern blotting respectively.ResultsPlasmids containing entecavir resistance mutations pETV1(rtL180M+M204V+I169T+M250V)and pETV2(rtL180M+M204V+T184G+S202I)were constructed and expressed in HepG2 cells.HBsAg,HBeAg and HBV DNA in supernatantsweremeasured.Entecavir-resistant HBV strains showed decline of replication capacities,which were equal to 47.4%and 38.6%of wild type HBV.Conclusion Entecavir-resistance mutant plasmids of hepatitis B virus are constructed.Various entecavir-resistant HBV show a lower replicative competence compared to wild-type strain in vitro.
hepatitis B virus;entecavir;drug-resistance;plasmid
R512.62
A
1005-1678(2014)08-0053-04
北京大学人民医院研究与发展基金项目(RDB2013-02)
王雪艳,女,博士,副教授,研究方向:肝病,E-mail:wxy2024@126.com;陈红松,通信作者,男,研究员,博士生导师,研究方向:肝病,E-mail:chenhongsong2999@163.com。

