NEDD4-l对前列腺癌PC3细胞TrkA泛素化的影响
汪治宇,李幸,郭晓金,邢联萍,刘雅,单保恩Δ
(1.河北医科大学第四医院肿瘤免疫科,河北石家庄050011;2.美国罗切斯特大学病理科,美国罗切斯特14624)
NEDD4-l对前列腺癌PC3细胞TrkA泛素化的影响
汪治宇1,李幸1,郭晓金1,邢联萍2,刘雅1,单保恩1Δ
(1.河北医科大学第四医院肿瘤免疫科,河北石家庄050011;2.美国罗切斯特大学病理科,美国罗切斯特14624)
目的检测前列腺癌PC3细胞中泛素连接酶NEDD4-l(neural precursor cell expressed developmentally downregulated 4-1,NEDD4-1)对酪氨酸蛋白激酶A(tyrosine kinase A,TrkA)泛素化作用的研究,探讨NEDD4-l调节前列腺癌PC3细胞侵袭及迁移的机制。方法采用脂质体瞬时转染法将NEDD4-l质粒转染入前列腺癌PC3细胞中,应用蛋白免疫共沉淀(co-immunoprecipitation,Co-IP)结合免疫印迹(immunoblotting,IB)法,观察外源的NEDD4-l和TrkA的相互作用;共表达NEDD4-l和ubiquitin,用Co-IP结合IB法检测NEDD4-1对TrkA的泛素化作用;共表达NEDD4-l和ubiquitin的同时,用蛋白酶体抑制剂MG132处理,观察TrkA水平的改变。结果转染NEDD4-1质粒后,外源性表达的NEDD4-l可与TrkA共沉淀;共表达NEDD4-1和ubiquitin后,NEDD4-1对内源的TrkA有泛素化作用,TrkA能与泛素共沉淀;共表达NEDD4-1和ubiquitin,用蛋白酶体抑制剂MGl32处理后,TrkA的泛素化降解被抑制。结论在前列腺癌PC3细胞中,TrkA是NEDD4-1的底物之一;NEDD4-1可调节TrkA的泛素化作用,促进其在蛋白酶体降解。
前列腺癌;NEDD4-1;TrkA;泛素化
前列腺癌是目前全球男性致死率排名第2位的肿瘤[1],随着直肠指检、PSA分析、超声医学等技术的应用,其筛出率逐年增高。因此,阐明其发病机制,寻找新的治疗手段成为现代神经外科的研究热点之一。
近年来,蛋白泛素化降解在肿瘤发生机制中的作用越来越受到人们的重视[2]。蛋白的泛素化(ubiquitination)降解是指在泛素活化酶(E1)、泛素结合酶(E2)及泛素连接酶(E3)的依次作用下将多个泛素(ubiquitin)共价结合到特定的靶蛋白上,并被带到26S蛋白酶体降解的过程[3]。在多泛素化过程中,底物特异性由E3决定,因此E3是蛋白质泛素化过程重要的调节靶点,也是研究热点,其中,泛素连接酶NEDD4-l(neural precursor cell expressed developmentally downregulated 4-1,NEDD4-1)是近年来的研究热点之一[3-4]。NEDD4-1最早是由Kumarts等[5]发现的HECT(homologous to E6-APC-terminus)泛素连接酶,NEDD4-l包括一个N端的C2(Ca2+/lipid-binding)结构域,中间的4个WW结构域及一个C端的HECT结构域,C2参与膜靶向结合,WW参与蛋白质的相互作用以及底物识别,HECT具有E3的催化活性,负责靶蛋白的泛素化和降解[4,6]。研究显示NEDD4-1可以与多种底物相互作用,现已鉴定的底物有:①离子通道和膜载体;②膜受体;③肿瘤抑制基因;④胞吞的蛋白[7-8]。因此,NEDD4与下列多种生物效应有关:神经信号的传导[9],肿瘤发生与细胞生长[10],细胞代谢[11],受体的胞吞与降解,病毒的出芽[12]。NEDD4-1优先泛素化肿瘤抑制基因和胞吞的蛋白[13]。于如同等[14-15]研究发现,用NEDD4-1的小干扰RNA(siRNA)转染PTEN缺失的U251和U87胶质母细胞瘤细胞后,细胞的凋亡率明显升高,侵袭性降低;而过表达NEDD4-1则促进细胞的增殖和侵袭。
酪氨酸蛋白激酶A(tyrosine kinase A,TrkA)是神经生长因子(nerve growth factor,NGF)的高亲和力功能性受体,NGF的神经营养与保护作用必须与TrkA受体相结合才能得以实现[16-17]。而正常成年大鼠脑组织内仅有少数神经元表达TrkA。出血性脑损伤后,如何提高TrkA受体表达,对维持损伤神经元的结构,促进神经细胞损伤后的存活及修复,重建神经生理功能具有重要意义。TrkA是相对分子质量为140 kD的酪氨酸PK受体,其分子组成可以分为3个部分,即辨别并结合NGF的膜外部、跨膜部和由酪氨酸激酶产生酶活性的胞内区。胞外区含有 2个LRRs,具有识别并结合NGF的功能,胞内区有酪氨酸激酶以及结合src癌基因同源2(src homology domain,SH2)、PLC-yl的位点[18],激酶部分是TrkA的催化部位,酪氨酸残基是TrkA关键的功能部位。相关研究结果分析Slitrk家族具有与TrkA类似的胞内区,其胞内区酪氨酸残基也是潜在的磷酸化位点,并且Slitrk调节神经元生长的作用机制与TrkA相似[19]。
已有文献报道在PC12细胞中,NEDD4可以将TrkA泛素化[20]。目前在前列腺癌中关于NEDD4-1和TrkA间作用的研究未见有报道,本实验拟采用体外前列腺癌PC3细胞为研究对象,通过免疫印记、免疫共沉淀等技术检测NEDD4-1与TrkA蛋白间的相互作用机制;并用蛋白酶体抑制剂处理,观察处理前后对TrkA蛋白水平的影响,进而为前列腺癌细胞侵袭、迁移的基因基础寻找到新的信号通路。
1 材料与方法
1.1 材料 pcDNA3.1-NEDD4-1质粒由美国Memorial Sloan-Kettering肿瘤中心细胞生物学实验室Xuejun Jiang教授馈赠。HA-ubiquitin质粒由中国社会科学院上海神经科学研究所馈赠。前列腺癌PC3细胞系,购自中国科学院上海细胞库。DH5a大肠杆菌购自北京天根生化科技有限公司。牛血清白蛋白(Amresco公司),胎牛血清(杭州四季青公司),DMEM/F12(Gibco公司),MGl32蛋白酶体抑制剂(MERCK-Calbiochem公司),Ampicillin(上海生物工程有限公司),lipofectamine 2000(Invitrogen公司)。细胞培养板、培养皿(Coming公司),质粒抽提试剂盒(Invitrogen公司),PVDF膜(Milipore公司)。
1.2 方法
1.2.1 细胞培养与脂质体转染 人前列腺癌细胞株PC3培养在10%胎牛血清的DMEM/F12培养基(含100 U/m L青霉素)中,于37℃、5%CO2细胞培养箱内培养,细胞呈贴壁生长。待细胞长满后,弃掉培养液,0.25%胰蛋白酶消化,每隔2~3 d分瓶传代培养。
取对数生长期细胞接种于6孔细胞培养板中,每孔细胞1× 106个,加入DMEM/F12完全培养基2mL继续培养。细胞达到约80%的融合度时更换新鲜培养液,2 h时后用脂质体(lipofectamine 2000)进行转染:将10μL lipofectamine 2000加入250μL opti-MEM中,混匀;将4μg pcDNA3.1-NEDD4-1质粒加入250μL opti-MEM中,混匀;然后将稀释好的lipofectamine 2000和质粒轻柔混匀,室温孵育20min;把孵育好的混合物均匀加入细胞培养板中继续培养,48 h后收集细胞进行检测。
1.2.2 蛋白免疫印迹法 收集转染48 h的PC3细胞,每个10 cm培养皿加1mL的NP40裂解缓冲液冰上裂解30min。进行离心(4℃,12000 r/min,30min)。收集上清液蛋白,-80℃保存备用。50μg蛋白行SDS-PAGE电泳,以湿转法将蛋白质转移至PVDF膜上,5%脱脂奶室温封闭1 h,TBST洗膜(5min×5);一抗4℃孵育过夜,TBST再次洗膜(5min×5)加入相应HRP标记的二抗,室温2 h,TBST洗膜(5min×5);ECL发光。以等量蛋白质上样β-actin对照,分析条带的灰度值与各自的内参β-actin的比值来判断目的蛋白的表达水平。
1.2.3 免疫共沉淀结合免疫印迹技术检测NEED4-1与TrkA相互作用 将上述-80℃保存的上清液蛋白,用分光光度计进行比色分析测定蛋白浓度。留取2个500μg蛋白行免疫共沉淀。将每组蛋白样品加入含蛋白酶抑制剂的细胞裂解液至1 mL,分别加入2μg相应的单克隆抗体(沉淀NEDD4-1用NEDD4-1抗体,阴性对照组加入抗体兔IgG),4℃转轱24 h;再加入30μL Protein G Agarose,4℃转轱24 h,用NP40裂解液洗Protein G Agarose 5次,最后加入30μL 2×SDS上样缓冲液悬起混匀;煮沸10min,使蛋白充分变性,离心(4℃,2000 g,15min),将上清行免疫印记检测。如1.2.2所示步骤进行免疫印迹,分为3组(见表1):Input组上样量为50μg,其余2组将免疫共沉淀产物上清全部加入上样孔。

表1 免疫印迹实验分组Tab.1 Grouping of IB
1.2.4 检测NEDD4-l对内源的TrkA的泛素化 共表达NEDD4-1和ubiquitin用蛋白免疫共沉淀(Co-IP)结合免疫印迹(IB)法,检测NEDD4-l对内源的TrkA的泛素化作用。如前面所示步骤,单独或者同时转染pcDNA3.1-NEDD4-l质粒和HA-ubiquitin质粒至PC3细胞中,然后进行蛋白免疫共沉淀和免疫印迹。免疫印迹分为3组(见表2)。

表2 免疫印迹实验分组Tab.2 Grouping of IB
1.2.5 免疫印迹(IB)观察TrkA水平的改变 共表达NEDD4-1和ubiquitin,用蛋白酶体抑制剂MGl32处理,用免疫印迹(IB)观察TrkA水平的改变,反映其降解情况。每孔质粒DNA lμg,脂质体2.5μL。转染后5 h换液,转染32 h取出一组4孔加入10μM蛋白酶抑制剂MGl32,每孔加入20 mg/mL的 MGl32 0.118μL,其终浓度为10μM。处理16 h,然后用NP40细胞裂解液(已加蛋白酶抑制剂)裂解细胞。如上述步骤所示,进行免疫印迹分组(见表3)。
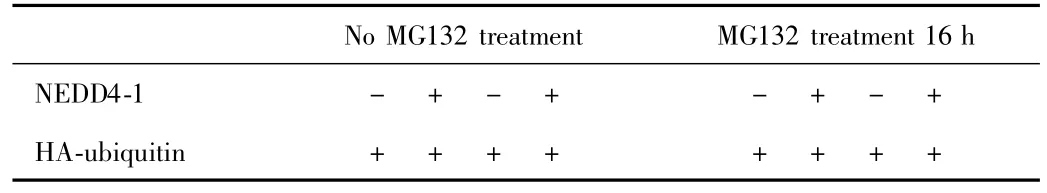
表3 免疫印迹实验分组Tab.3 Grouping of IB
2 结果
2.1 前列腺癌PC3细胞过表达NEDD4-1后,外源性NEDD4-可以和内源性TrkA共沉淀 采用脂质体转染法将pcDNA 3.1-NEDD4-1质粒转染入PC3细胞后48 h,应用免疫共沉淀结合免疫印迹技术检测发现:NEED4-1可与内源性TrkA共沉淀,IgG抗体对照组则无共沉淀现象(见图1)。
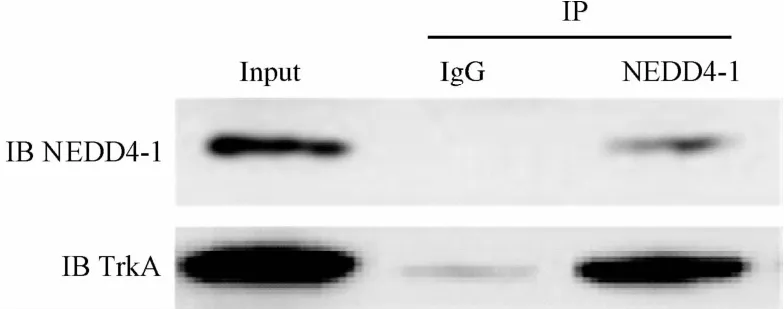
图1 外源性NEDD4-1与内源性TrkA可以共沉淀Fig.1 Endogenous TrkA co-precipitated with exogenous NEDD4-1
2.2 共表达NEDD4-1和ubiquitin,NEDD4-1对内源的TrkA有泛素化作用,TrkA能与泛素共沉淀 将pcDNA3.1-NEDD4-1质粒和HA-ubiquitin质粒共转染入PC3细胞,转染后48 h,应用免疫共沉淀结合免疫印迹技术检测发现(见图2):HA-ubiquitin与内源性TrkA可以共沉淀,IgG抗体对照组没有共沉淀现象,提示NEDD4-1对内源的TrkA有泛素化作用。共表达NEDD4-1和ubiquitin,NEDD4-1对内源的TrkA有泛素化作用,TrkA能与泛素共沉淀。用HA-ubiquitin质粒和/或不和pcDNA3.1-NEDD4-1质粒转染PC3细胞,应用免疫共沉淀结合免疫印迹技术检测ubiquitin与内源性TrkA可以共沉淀(lane 1,2,5,6),IgG抗体对照组没有共沉淀现象(lane 3,4),NEDD4-1对内源的TrkA有泛素化作用(lane 6):泛素化的TrkA可以用HA抗体检测(1anes 1,2,5,6);过表达外源性泛素可以用HA抗体检测(lane 1~6)。
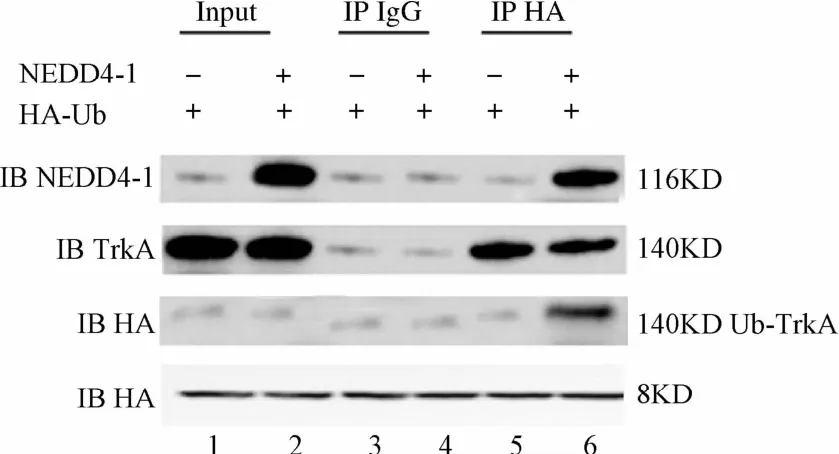
图2 外源性泛素可以与内源性TrkA共沉淀Fig.2 Exogenous ubiquitin co-precipitated with endogenous TrkA
2.3 共表达NEDD4-1和ubiquitin后,用蛋白酶体抑制剂MGl32处理,TrkA的泛素化降解作用能够被抑制 将 pcDNA3.1-NEDD4-1和HA-ubiquitin质粒共转染入U251细胞,转染32 h后,再用蛋白酶体抑制剂MGl32处理16 h,免疫印迹结果发现:与对照组比较,共表达NEDD4-l和ubiquitin(共转染组),TrkA蛋白的表达量显著降低(P<0.01);MGl32处理后,这一差异消失,说明共转染组对TrkA泛素化降解作用能够被抑制(见图3)。
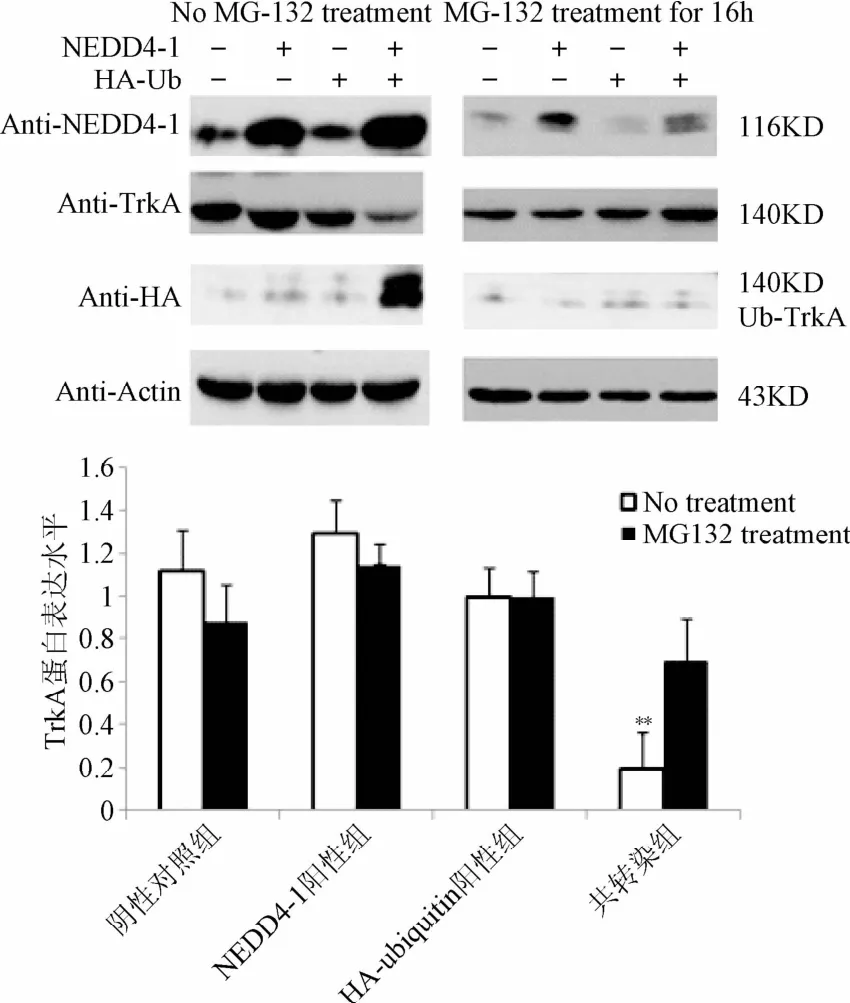
图3 外源性NEDD4-1介导TrkA泛素化降解**P<0.01,与对照相比Fig.3 Exogenous NEDD4-1 regulates ubiquitination of TrkA **P<0.01,compared with control group
3 讨论
常规检测目的蛋白相互作用的方法是免疫共沉淀技术,该技术是一种微量、灵敏和特异性强的检测方法,广泛应用于肿瘤、酶与病毒、寄生虫、信号转导等蛋白质相互作用的研究中,已经成为研究蛋白质相互作用的一个可靠技术[21]。
本研究应用免疫共沉淀结合免疫印迹技术可以检测到内源性TrkA可以被结合了NEDD4-1抗体的琼脂糖珠子(protein G-Agarose beads)沉淀下来,而对照抗体兔IgG却不能出现共沉淀。说明NEDD4-1和TrkA 2种蛋白质是存在相互作用的。
为了进一步证实NEDD4-1是否介导了TrkA的泛素化作用。用HA-ubiquitin质粒与pcDNA3.1-NEDD4-1质粒一起或单独转染PC3细胞,观察TrkA的泛素化现象。用免疫共沉淀结合免疫印迹技术,检测到TrkA可以与结合了HA抗体的琼脂糖珠子共同沉淀下来,而对照抗体却没有沉淀现象出现。NEDD4-1蛋白也可以一起被沉淀下来,但是因为本实验所用的pcDNA3.1质粒载体上也带有HA-tag,所以虽然被沉淀下来,但不能肯定的说是3者共沉淀的,当然也存在3者共沉淀的可能性,而且理论上也应该是3者共沉淀。
泛素化过程的最终是要进入泛素-蛋白酶体通路进行降解[22]。为了探讨应用蛋白酶体抑制剂是否能阻止TrkA泛素化降解。采用HA-ubiquitin质粒与pcDNA3.1-NEDD4-1质粒一起或单独转染PC3细胞,并设立空白对照组,转染32 h后,参考相关文献方法[23],取出一组用10μM蛋白酶体MGl32处理16 h,免疫印记技术检测发现共转染组TrkA被泛素化降解,而用10μM蛋白酶体MGl32处理16 h组泛素化降解被抑制。本文结果表明NEDD4-1能介导TrkA的泛素化,并将其带到蛋白酶体处进行降解。但泛素化作用如何参与并调节PC3细胞的迁移和侵袭,是下一步的主要研究方向。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA:a cancer journal for clinicians,2013,63(1):11-30.
[2]Sun Y.Targeting E3 ubiquitin ligases for cancer therapy[J].Cancer Biol Ther,2003,2(6):623-629.
[3]Yang B,Kumar S.Nedd4 and Nedd4-2:closely related ubiquitin protein ligases with distinct physiological functions[J].Cell Death Differ,2009,17(1):68-77.
[4]Persau A,Alberts P,Amsen EM,et a1.Comparison of substrate specificity of the ubiquitin ligases Nedd4 and Nedd4-2 using proteome arrays[J].Mol Syst Biol,2009,5:333.
[5]Kumar S,OmookaY,Noda M.Identification of a set of genes with developmentally down-regulated expression in the mouse brain[J]. Biochem Biophys Res Commun,1992,185(1):1155-1161.
[6]Varshavsky A.The ubiquitin system[J].Trends Biochem Sci,1997,22(10):383-387.
[7]Fotia AB,Ekberg J,Adams DJ,et a1.Regulation of neuronal voltagegated sodium channels by the ubiquitin-protein ligases Nedd4 and Nedd4-2[J].JBiol Chem,2004,279(28):28930-28935.
[8]Wang J,Peng QH,Lin Q,et a1.Calcium activates Nedd4 E3 ubiquitin ligases by releasing the C2 domain-mediated auto-inhibition[J].JBiol Chem,2010,1(2):223-231.
[9]Arevalo JC,Waite J,Rajagopal R,et a1.Cell survival through Trk neurotrophin receptors is differentially regulated by ubiquitination[J]. Neuron,2006,50(4):549-559.
[10]Xu LL,ShiY,Petrovics G,et al.PMEPA1,an androgen-regulated NEDD4-binding protein,exhibits cell growth inhibitory function and decreased expression during prostate cancer progression[J].Cancer Res,2003,63(15):4299-4304.
[11]Lang F,Bohmer C,Palmada M,et a1.(Patho)physiological significance of the serum-and glucocorticoid-inducible kinase isoforms[J].Physiol Rev,2006,86(4):1151-1178.
[12]Vana ML,Tang Y,Chen A,et a1.Role of Nedd4 and ubiquitination of Rous sarcoma virus Gag in budding of virus-like particles from cells[J].J Virol,2004,78(24):l3943-13953.
[13]Aoh QL,Castle AM,Hubbard CH,et a1.SCAMP3 negatively regulates epidermal growth factor receptor degradation and promotes receptor recycling[J].Mol Biol Cell,2009,20(6):1 816-1832.
[14]于如同,李季林,石琼.NEDD4-l对胶质瘤细胞周期、增殖及凋亡的研究[J].中华实验外科杂志,2010,27(1):157.
[15]于如同,郑金玉,石琼.NEDD4-1对胶质瘤U251细胞迁移和侵袭作用研究[J].中华实验外科杂志,2009,26(12):1742-1743.
[16]Niewiadomska G,Mietelska-Porowska A,Mazurkiewicz M.The cholinergic system,nerve growth factor and the cytoskeleton[J].Behav Brain Res,2011,221(2):515-526.
[17]Tao Y,Laura C,Begona A,et al.Regulation of trafficking of activated TrkA is critical for NGF-mediated Functions[J].Traffic,2011,12(4):521-534.
[18]Aruga J,Yokota N,Mikoshiba K.Human SLITRK family genes:genomic organization and expression profiling in normalbrain and brain tumor tissue[J].Gene,2003,315:87-94.
[19]靳雁斌,范文红,范明.Slitrk基因家族的研究进展[J].国际病理科学与临床杂志,2006,26(2):159-161.
[20]Georgieva M V,de Pablo Y,Sanchis D,etal.Ubiquitination of TrkA by Nedd4-2 regulates receptor lysosomal targeting and mediates receptor signaling[J].Jneurochem,2011,117(3):479-493.
[21]程小星,邓少丽,蹇锐.B淋巴细胞信号转导相关接头蛋白Bam32与Hic25的相互作用[J].中国生物化学与分子生物学报,2005,21(6):796-800.
[22]Spence J,Gali RR,Dittmar G,et al.Cell cycle-regulated modification of the ribosome by a variant multiubiquitin chain[J].Cell,2006,4(106):67-76.
[23]Weissman AM.Themes and variations on ubiquitylation[J].Nat Rev Mol Cell Biol,2001,2(2):169-178.
(编校:吴茜,刘路路)
Regulation effect of NEDD4-1 on ubiquitination of the TrkA in prostate cancer cells
WANG Zhi-yu1,LIXing1,GUO Xiao-jin1,XING Lian-ping2,LIU Ya1,SHAN Bao-en1Δ
(1.Department of Tumor Immunology,The Fourth Hospital of HebeiMedical University,Shijiazhuang 050011,China;2.Department of Pathology,University of Rochester,Rochester 14624,USA)
ObjectiveTo investigate the possibility that neural precursor cell expressed developmentally downregulated 4-1(NEDD4-1)regulates ubiquitination of the tyrosine kinase A(TrkA)in prostate cancer cells and discuss the possiblemechanism thatNEDD4-1promotes invasion andmigration of prostate cancer cells.MethodsAfter transient over-expression NEDD4-1 in PC3 cells using liposome transfection method,the interaction between exogenous NEDD4-1 and TrkA was tested by using immunoprecipitation(Co-IP)combined with immunoblotting(IB).After co-overexpression of NEDD4-1 and ubiquitin,the ubiquitination effectof TrkA was examined using Co-IP combined with IBmethod.After co-overexpression of NEDD4-1 and ubiquitin,the ubiquitinated TrkA levelwas analyzed with or without the proteasome inhibitor MG132 treatment.ResultsAfter overexpression of NEDD4-1 in PC3 cells,the exogenous NEDD4-1 was co-precipitated with TrkA.After co-overexpression of NEDD4-1 and ubiquitin,the TrkA was ubiquitinated by exogenous NEDD4-1.The ubiquitinated TrkA level was increased after proteasome inhibitor MG132 treatment,indicating that the TrkA degradation was blocked.Conclusion TrkA protein was one of the substrate of NEDD4-1 in prostate cancer cells;NEDD4-1 regulates ubiquitination of TrkA and promots its degradation in proteasome.
prostate cancer;NEDD4-1;TrkA;ubiquitination
R285.5
A
1005-1678(2014)08-0001-04
国家自然科学基金(81202037)
汪治宇,男,博士,副教授,研究方向:肿瘤免疫学,E-mail:wzyu79@163.com;单保恩,通信作者,男,博士,教授,研究方向:免疫学,E-mail:danbaoen@163.com。

