透骨消痛颗粒含药血清诱导骨髓间充质干细胞分化的实验研究
贾峰,王彤
(1.淄博市第一医院骨伤科,山东淄博255200;2.南京医科大学,江苏南京210029)
透骨消痛颗粒含药血清诱导骨髓间充质干细胞分化的实验研究
贾峰1,王彤2
(1.淄博市第一医院骨伤科,山东淄博255200;2.南京医科大学,江苏南京210029)
目的探讨透骨消痛颗粒含药血清诱导骨髓间充质干细胞(bonemarrow stromal cells,BMSCs)向软骨细胞分化的潜能。方法以临床等效剂量0.145 g/(kg·d)、0.29g/(kg·d)、0.58 g/(kg·d)制备各浓度透骨消痛颗粒含药血清,36只SD大鼠随机均分为空白对照组,低剂量组、中剂量组和高剂量组,分别给予0.9%生理盐水20mL,不同浓度透骨消痛颗粒含药血清各20mL,连续灌胃3 d,采用全骨髓培养法分离培养BMSCs,显微镜下观察软骨细胞分化的形态变化并计数;RT-PCR检测骨髓基质干细胞中Sox9、CollagenⅡ、Runx2 mRNA表达。结果空白对照组细胞呈梭形,漩涡状,单一生长;透骨消痛颗粒含药血清各组BMSCs形态发生转变,至接种7 d后,其细胞生长达到高峰;透骨消痛颗粒含药血清可促进软骨细胞数量,且具有明显的剂量效应;透骨消痛颗粒含药血清可增加Sox9、CollagenⅡ和Runx2 mRNA表达水平。结论透骨消痛颗粒含药血清可有效诱导BMSCs向软骨细胞分化。
透骨消痛颗粒含药血清;骨髓间充质干细胞;软骨;分化潜能
骨髓间充质干细胞(bone marrow stromal cells,BMSCs)是具有多向分化潜能的非造血系干细胞,其可通过有效的诱导途径分化为软骨表型细胞,并在关节软骨缺损和畸形的临床治疗中发挥重要作用[1-2]。研究显示,透骨消痛颗粒具有延缓软骨退变的生物学效应,并对早、中期膝骨性关节炎有较好的治疗作用[3-4]。因此,是否可将透骨消痛颗粒作为诱导剂来促进BMSCs向软骨细胞定向分化?本实验旨在通过采用透骨消痛颗粒含药血清为诱导剂,观察其对BMSCs诱导向软骨细胞分化的潜能,为进一步将BMSCs应用于临床软骨缺损修复提供实验依据。
1 材料与方法
1.1 主要实验试剂与仪器 透骨消痛颗粒(主要成分:巴戟天、川芎、白芍、肿节风)由福州屏山药厂生产,胎牛血清、DMEM培养液、PBS、胰蛋白酶为美国Hy-clone公司产品,反转录试剂盒为美国Promega公司产品,Sox9抗体、Collagen II、Collagen X和β-actin引物均由南京生兴生物技术有限公司合成。
BIO-TEK ELX800型全自动酶标仪为美国BIO-Tek公司产品,日立HU-12A型透射电镜为日本日立公司产品。
1.2 透骨消痛颗粒含药血清制备及动物分组 雄性SD大鼠36只,体质量200~220 g,采用摸球法随机均分为空白对照组,透骨消痛低剂量组、中剂量组和高剂量组。空白对照组给予0.9%生理盐水20mL连续灌胃3 d,透骨消痛药物组给予预先制备好的不同浓度的透骨消痛水提物20mL/次,2次/d,动物给药剂量相当于临床等效剂量,依据“人和动物体表面积折算的等效剂量比率表”计算[5],低剂量组、中剂量组和高剂量组分别给予0.145 g/(kg·d)、0.29 g/(kg·d)、0.58 g/(kg·d)的透骨消痛颗粒临床等效剂量;连续灌胃3 d,第4天1次服用全天剂量,禁食12 h,末次给药3 h后采用盐酸氯胺酮麻醉后腹主动脉采血,3000 r/min离心15min,分离血清后于56℃水浴30 min,灭活,-20℃保存备用。
1.3 BMSCs体外培养 采用全骨髓培养法分离培养骨髓间充质干细胞。SD大鼠10%水合氯醛麻醉致死,髂骨骨髓腔处抽取6~8mL骨髓,放入DMEM-LG培养液中制备细胞悬液。制备好的细胞悬液以1500 r/min离心8 min,PBS清洗后加入DMEM完全培养液(含10%胎牛血清,维生素C 50mg/L和青链霉素各100 U/mL)重悬细胞,计数有核细胞,并以2×109个/L浓度接种于培养瓶,置37℃、5%CO2饱和湿度培养箱中培养,5 d后首次更换培养液,倒置显微镜下观察细胞生长情况,后间隔2~3 d更换培养液,至细胞融合达80%~90%时,以0.02% EDTA和0.25%胰蛋白酶消化,传代培养。
1.4 BMSCs诱导向软骨细胞分化 取第2代BMSCs经2.5 g/L胰蛋白酶消化,以6×106个/L浓度接种于96孔培养板,每孔终体积为100μL,常规培养24 h贴壁后分别加入20mL生理盐水(空白对照组)和20mL不同剂量透骨消痛颗粒水提物(低剂量组、中剂量组和高剂量组),DMEM常规培养2周。倒置显微镜下观察BMSCs诱导细胞向软骨细胞分化的形态变化,随机选取10个视野的软骨细胞进行计数,取均值作为软骨细胞数量;透射电子显微镜下观察接软骨细胞的超微结构。
1.5 RT-PCR检测骨髓基质干细胞中Sox9、CollagenⅡ、Runx2 mRNA表达 干预48 h后,Trizol试剂提取总RNA,测定OD260和OD280,计算RNA的纯度和含量。M-MLV反转录合成cDNA,用RT-PCR扩增Sox9、collagenⅡ、collagenⅩ。南京生兴生物技术有限公司合成引物,2-△△CT法分析结果。引物设计如下:Sox9上游引物:5′-AGCAAAGGAGATGAAATCTGTTCTG-3′,下游引物:5′-AGGTTAACTGCTGGTGTTCTGAGA-3′;collagenⅡ上游引物:5′-GGCAATAGCAGGTTCACGTACA-3′,下游引物:5′-CGATAACAGTCTTGCCCCACTT-3′;Runx2上游引物:5′-AGAAGGCACAGACAGAAGCTTGA-3′,下游引物:5′-AGGAATGCGCCCTAAATCACT-3′;内参β-actin上游引物:5′-TGTGCCCATCTACGAGGGGTATGC-3′,下游引物:5′-GGTACATGGTGGTGCCGCCAGAACA-3′。
1.6 统计学方法 采用SPSS17.0进行数据分析,正态计量数据用“±s”表示,采用单因素方差分析比较,采用LSD法进行组间两两比较;以P<0.05为差异有统计学意义。
2 结果
2.1 透骨消痛颗粒含药血清诱导后BMSCs细胞形态变化
倒置显微镜下观察,空白对照组细胞呈梭形,漩涡状,且随接种时间其形态保持单一生长,未见细胞老化现象;透骨消痛颗粒含药血清组(中剂量组)在接种3 d后,细胞贴壁呈簇状聚集,BMSCs形态向三角形或多边形转变;接种7 d后,其细胞生长达到高峰。透射电子显微镜下观察接种3 d后软骨细胞的超微结构,空白对照组细胞呈圆形,核不规则,核仁清晰,染色质均匀;透骨消痛颗粒含药血清组(中剂量组)细胞呈圆形,核呈分叶状,核仁清晰,细胞处于分裂早期见图1。
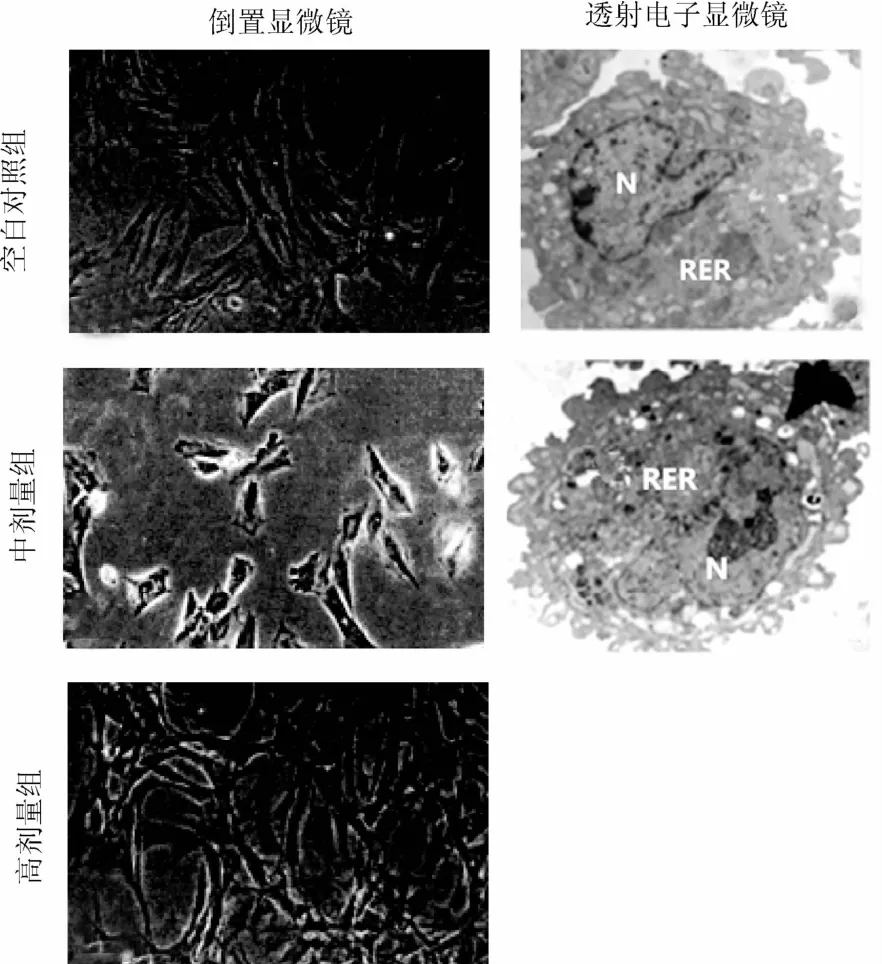
图1 显微镜下BMSCs细胞形态(×100)N:细胞核,RER:粗面内质网Fig.1 Morphology of bonemarrow stromal cells(×100)N:cell nucleus;RER:rough endoplasmic reticulum
2.2 透骨消痛颗粒含药血清对BMSCs向软骨细胞分化数量的影响 给予不同浓度的含药血清诱导后,随培养时间推移,各组软骨细胞数量不断增加,在培养7 d后,软骨细胞数可达到平台期,透骨消痛颗粒含药血清表现出明显的促进软骨细胞数量的作用,其培养5,7,9 d的吸光度值显著高于对照组(P<0.05,见图2),且随着透骨消痛颗粒含药血清浓度的增加,软骨细胞数量增加。
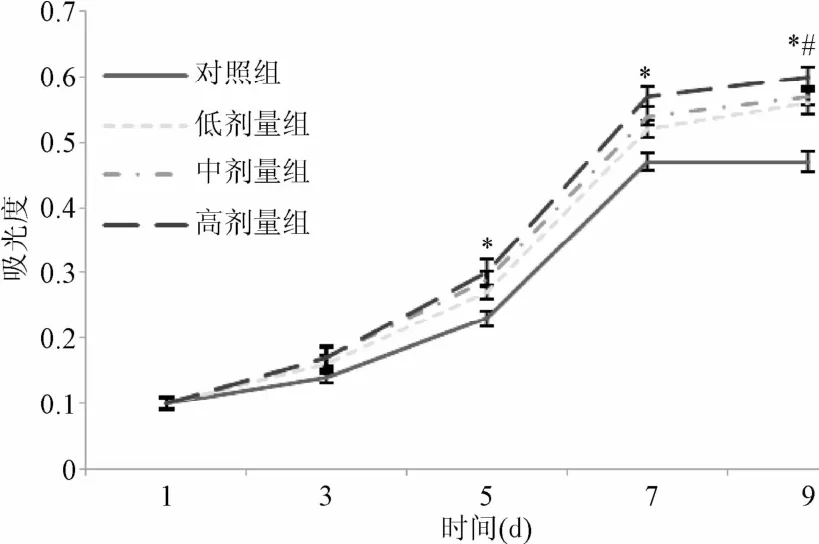
图2 透骨消痛颗粒含药血清对软骨细胞数量的影响*P<0.05,与对照组相比;#P<0.05,与高剂量组相比Fig.2 Effect of Tougu Xiaotong granule drug-containing serum on the amount of chondrocytes*P<0.05,compared with control group;#P<0.05,compared with high-dose group
2.3 透骨消痛颗粒含药血清对BMSCs中Sox9、CollagenⅡ和Runx2 mRNA表达水平的影响 不同剂量透骨消痛颗粒含药血清诱导14 d后,RT-PCR结果显示:各透骨消痛颗粒含药血清组BMSCs中Sox9、CollagenⅡ和Runx2 mRNA表达水平均显著高于空白对照组(P<0.05),且高、中剂量透骨消痛颗粒含药血清组中Sox9 mRNA表达水平高于低剂量组,高剂量组collagenⅡ和Runx2 mRNA表达水平高于中、低剂量组(P<0.05,见图3)。
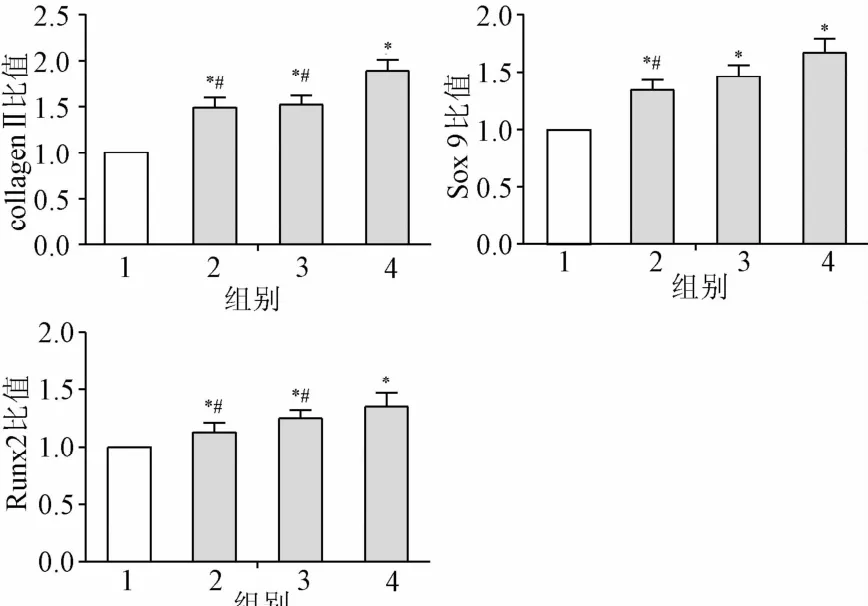
图3 透骨消痛颗粒含药血清对BMSCs中Sox9、CollagenⅡ、Runx2 mRNA表达的影响*P<0.05,与对照组相比;#P<0.05,与高剂量组相比Fig.3 Effect of Tougu Xiaotong granule containing serum on Sox9,CollagenⅡand Runx2 mRNA expression of BMSCs*P<0.05,compared with control group;#P<0.05,compared with high-dose group
3 讨论
关节软骨疾患临床常见,由于软骨缺乏丰富的血液供应,其自我修复能力极其有限甚至无内在修复能力,因此软骨缺损的治疗成为临床面临的巨大挑战。组织工程技术是关节软骨疾患修复的重要方法,其中软骨细胞和BMSCs是软骨组织工程学常用的种子细胞,由于软骨细胞在增殖过程中去分化现象明显,因此软骨细胞有限的增殖能力限制了其在构建组织工程软骨种子细胞中的应用。BMSCs是存在于骨髓基质中的具有多项分化潜能的非造血细胞群[6-7],在其较长的分裂增殖期内,BMSCs可通过不断的自我更新,分化为骨、软骨、肌腱等多种结缔组织。但在骨关节疾患中,由于BMSCs的缺乏,其增殖分化潜能减弱,因此,尝试在不同的诱导条件下,促进BMSCs向软骨细胞分化对临床有重要意义。
既往研究发现,透骨消痛颗粒可通过抑制氧自由基、细胞因子等生物效应来延缓软骨细胞、软骨基质的退变,从而改善关节形态[8]。同时,多项研究已证实透骨消痛颗粒可促进BMSCs向软骨细胞增殖分化[9-11],但该类研究并未涉及到骨分化过程中调节因子的作用。本研究采用含透骨消痛颗粒成分的血清体外培养大鼠BMSCs,结果显示,透骨消痛颗粒含药血清可促进BMSCs分化成为软骨细胞。由于Ⅱ型胶原蛋白(CollagenⅡ)是软骨基质的重要组成成份,也是表达软骨细胞的特异性基因,其含量增多可提高软骨的抗压性和耐磨性,从而延缓软骨组织的退变。因此,本实验采用透骨消痛颗粒含药血清和细胞体外共同培养的方法,通过RT-PCR方法观察了透骨消痛颗粒含药血清对BMSCs中CollagenⅡ的影响,从而反映软骨细胞表型的分化状态。结果显示:透骨消痛颗粒含药血清可有效促进CollagenⅡ mRNA的表达,说明BMSCS向软骨细胞表形转化过程受到透骨消痛颗粒含药血清的调节。
前期研究显示,透骨消痛颗粒可通过有效调控软骨细胞线粒体凋亡[12],维持软骨细胞、软骨基质及软骨下骨3者降解和合成正常偶联的平衡,并可上调细胞周期中的关键蛋白而加速骨髓基质干细胞周期的进程[13],从而促进其增殖。从分子机制看,在骨分化过程中,Sox9为成软骨过程中必需的转录调控因子,其通常在肥大软骨细胞中不表达,而主要集中表达于成软骨祖细胞和软骨细胞[14-15],因此,缺少Sox9将引起基质干细胞凝聚阶段的软骨细胞分化阻滞,同时会使软骨细胞终末期的分化速度加快,导致其提前钙化,同时,其还可促进Ⅱ型胶原基因的表达,促进CollagenⅡ的分泌。Runx2亦为成骨细胞的特异转录因子,其对多能干细胞向成骨细胞分化起关键作用,并可促进软骨的血管化以及软骨细胞的成熟[16]。本研究中,透骨消痛颗粒含药血清可有效促进BMSCs中Sox9和Runx2转录水平的升高,提示透骨消痛颗粒含药血清可通过升高Sox9和Runx2表达水平参与诱导分化软骨细胞的信号通路过程,且在一定程度上抑制BMSCs向肥大的软骨细胞分化,而表现为终末细胞表型。
综上所述,透骨消痛颗粒含药血清可有效促进BMSCs分化成为软骨细胞,在此过程中,Sox9和Runx2转录因子参与了软骨细胞分化和增殖过程。
[1]Wang W,Li B,Yang J,et al.The restoration of full-thickness cartilage defects with BMSCs and TGF-beta 1 loaded PLGA/fibrin gel constructs[J].Biomaterials,2010,31(34):8964-8973.
[2]Cao L,Yang F,Liu G,et al.The promotion of cartilage defect repair using adenovirusmediated Sox9 gene transfer of rabbit bone marrow mesenchymal stem cells[J].Biomaterials,2011,32(16):3910-3920.
[3] 黄云梅,陈文列,刘献祥,等.透骨消痛颗粒对骨性关节炎影响的组织化学研究[J].中国中医骨伤科杂志,2011,19(1):1-3.
[4] 郑春松,林珠灿,许惠风,等.透骨消痛胶囊治疗骨性关节炎的多向药理学研究[J].福建中医药大学学报,2011,21(1):43-47.
[5]徐淑云,卞如濂,陈修.药理实验学方法[M].3版.北京:人民卫生出版社,2002:202-205.
[6] 罗仪,王辉,巫贵成,等.骨髓间充质干细胞移植在治疗肝硬化中的临床疗效研究[J].中国生化药物杂志,2012,33(4):457-459.
[7] 王建祥,王平,吴海龙,等.骨髓间充质干细胞在大鼠重症急性胰腺炎中的作用[J].中国生化药物杂志,2010,31(6):381-384.
[8] 胡丹,黄秋云,黎金浓,等.中药诱导骨髓间充质干细胞多向分化研究进展[J].中华细胞与干细胞杂志(电子版),2013,3(4):40-44.
[9] 刘伯龄,李西海,肖丽春,等.透骨消痛颗粒含药血清诱导骨髓基质干细胞向软骨细胞分化[J].中国组织工程研究,2013,17(32):5863-5870.
[10]吴追乐,刘献祥,李西海,等.透骨消痛颗粒诱导骨髓间充质干细胞向软骨细胞的分化[J].中国组织工程研究与临床康复,2009,13(33):6456-6460.
[11]刘献祥,李明波,陈文列,等.透骨消痛颗粒对BMSCs向软骨细胞分化的影响[J].福建中医学院学报,2009,19(4):33-37.
[12]吴追乐,李西海,吴广文,等.透骨消痛胶囊含药血清对软骨细胞线粒体凋亡通路的影响[J].中华中医药杂志,2011,26(2):343-346.
[13]刘伯龄,李西海,梁珪清,等.透骨消痛颗粒水提与醇提物含药血清干预骨髓基质干细胞活性的实验研究[J].中国组织工程研究,2012,16(41):7717-7722.
[14]Feng G,Wan Y,Balian G,et al.Adenovirus-mediated expression of growth and differentiation factor-5 promotes chondrogenesis of adipose stem cells[J].Growth Factors,2008,26(3):132-142.
[15]Cao L,Yang F,Liu G,et al.The promotion of cartilage defect repair using adenovirusmediated Sox9 gene transfer of rabbit bone marrow mesenchymal stem cells[J].Biomaterials,2011,32(16):3910-3920.
[16]Zhang Y,Xie R,Croce C M,et al.A program of microRNAs controls osteogenic lineage progression by targeting transcription factor Runx2[J]. Proceedings of the National Academy of Sciences,2011,108(24):9863-9868.
(编校:吴茜,刘路路)
Effect of Tougu Xiaotong granule drug-containing serum on the chondrogenic potential of bonemarrow stromal cells
JIA Feng1,WANG Tong2
(1.Department of Orthopedics,First Hospital of Zibo,Zibo 255200,China;2.Nanjing Medical University,Nanjing 210029,China)
ObjectiveTo investigate the effect of Tougu Xiaotong granule drug-containing serum on the chondrogenic potential of bone marrow stromal cells(BMSC).MethodsTougu Xiaoyong granule drug-containing serum were prepared by clinical equivalent dose of0.145 g/(kg·d),0.29 g/(kg·d)and 0.58 g/(kg·d).36 SD rats were randomly divided into blank control group,low-dose group,middle-dose group and high-dose group equally.Four groups were respectively accepted 20mL 0.9%saline and different concentration of Tougu Xiaotong granule drug-containing serum 20mL,continuous lavage in 3 d.BMSCswere cultivated by whole bonemarrow culturemethod,andmorphological changes of cartilage cell differentiation were observed undermicroscopes;Sox9,CollagenⅡ,Runx2 mRNA expression were detected by RT-PCR.ResultsBMSCs in blank control group showed fusiform,swirl,single growth,and BMSCsmorphology in Tougu Xiaotong granule drug-containing serum group were changed and reached the cellgrowth peak after7 d of cultivation.Tougu Xiaotong granule drug-containing serum promoted the amountof chondrocytes,and had obvious dose-response effect. Tougu Xiaotong granule drug-containing serum increased Sox9,CollagenⅡand Runx2 mRNA expression level significantly.Conclusion Tougu Xiaotong granule drug-containing serum can effectively induce the differentiation from BMSCs to chondrocytes.
Tougu Xiaotong granule drug-containing serum;bonemarrow stromal cells;chondrocytes;differentiation potential
R285.5
A
1005-1678(2014)08-0026-04
国家自然科学基金(81171851)
贾峰,男,学士,主治医师,研究方向:中医骨伤,E-mail:qch1821460028@163.com。

