姜黄醇与放疗联用对人乳腺癌MCF-7细胞的影响研究
王颖,殷咏梅
(1.新乡医学院第一附属医院肿瘤内科,河南新乡453100;2.南京医科大学,江苏南京210029)
姜黄醇与放疗联用对人乳腺癌MCF-7细胞的影响研究
王颖1,殷咏梅2
(1.新乡医学院第一附属医院肿瘤内科,河南新乡453100;2.南京医科大学,江苏南京210029)
目的研究天然中药提取物姜黄醇(turmeric alcohol)单独使用或者与放疗联用对MCF-7人乳腺癌细胞系/MCF-10A正常乳腺上皮细胞的生长抑制效果、肿瘤细胞克隆形成、细胞周期分布和端粒酶活性的影响。方法实验分4组,分别为:人乳腺癌细胞株MCF-7姜黄醇组;人乳腺癌细胞株MCF-7对照组;正常乳腺上皮细胞MCF-10A姜黄醇组;正常乳腺上皮细胞MCF-10A对照组。2组姜黄醇组分别使用姜黄醇处理,其余2组对照组不作处理。采用细胞增殖检测方法CCK-8检测姜黄醇药物毒性;另外,分别单纯给予姜黄醇,或者姜黄醇与放疗联合,通过集落克隆形成实验(clone-forming assay)观察姜黄醇是否影响MCF-7细胞放射敏感性;以流式细胞仪检测各组乳腺癌细胞的细胞周期分布(细胞处于G1、S、G2的比率);在机制研究方面,测定肿瘤细胞端粒酶活性、端粒长度在给药前后的变化。结果姜黄醇对MCF-7乳腺癌细胞的生长具有显著的抑制作用,其抑制效果与时间和剂量相关,并在72h达到平台期;而采用姜黄醇后正常乳腺上皮细胞MCF-10A的增殖未受到明显影响。克隆形成能力方面,经过姜黄醇处理后即对MCF-7乳腺癌细胞的放射敏感性产生明显的影响,即合用姜黄醇可显著降低放疗后MCF-7细胞的集落形成率,计算姜黄醇的放射增敏比SERSF2为1.31,SERD0为1.32。而姜黄醇对MCF-10A正常乳腺上皮细胞的细胞周期分布未见明显影响。结论姜黄醇可以增加MCF-7人乳腺癌肿瘤细胞的放射敏感性,其放射增敏的机制可能与端粒酶活性下调、端粒缩短以及影响细胞周期分布有关。同时,姜黄醇对MCF-10A正常乳腺上皮细胞的细胞增殖、放射敏感性和细胞周期分布无明显影响。姜黄醇可能作为未来临床上可行的乳腺癌治疗放射增敏剂。
放射抗拒;姜黄醇;放射敏感性;乳腺癌
目前肿瘤是全世界范围内严重威胁人类健康的重大疾病,虽然肿瘤的治疗效果有了很大提高,但在全世界范围内,每年肿瘤的发病率还在高速增长[1-3]。在中国,无论是发病率还是死亡率,也在逐年增加,它已成为中国人群发病率高的疾病之一[4]。作为全世界范围内女性最常见的恶性肿瘤,乳腺癌可见于各个年龄层,但主要好发于中老年妇女。近年来,伴随生活水平的不断提高以及营养状况的改善,乳腺癌在全球的发病率都有呈逐年升高的趋势。目前,在全世界范围内,乳腺癌成为女性死亡的头号杀手之一,已经成为影响女性健康的主要致死性疾病之一[5]。目前针对乳腺癌有很多治疗手段,诸如:手术、化疗、放疗、生物靶向治疗、基因治疗等[6],但由于肿瘤的病因至今尚未明确,因此在现有的认识基础上,这些疗法尚没有完全令人满意[7]。本课题在姜黄醇现有的药理学研究基础上,结合乳腺癌细胞株自身的放射生物学特点,研究天然中药提取物姜黄醇(curcumin)单独使用或者与放疗联用对MCF-7人乳腺癌细胞系的生长抑制效果、肿瘤细胞克隆形成变化、以及对于细胞周期分布和特异蛋白的影响。根据所得结果分析姜黄醇在体外放疗增敏作用,其剂量与效应关系、时间与效应关系、效应分子变化特征等,以期为乳腺癌的放射增敏研究提供一定的价值。
1 材料与方法
1.1 实验材料
1.1.1 细胞株:肿瘤细胞MCF-7人乳腺癌细胞株\MCF-10A正常乳腺上皮细胞由武汉大学典型物种保藏中心提供,并由本室保存,按细胞培养流程进行常规细胞培养和传代。
1.1.2 主要试剂:RNA提取试剂Trizol试剂(Invitroge公司);RT-PCR逆转录试剂盒购自立陶宛Fermentas公司,PCR引物由上海生物工程技术服务有限公司合成;肿瘤端粒酶活性检测试剂盒Telo TAGGG Telomerase PCR ELISA Kit购自Roche公司;DNA回收纯化试剂盒(Fermentas公司)、十二烷基磺酸钠(SDS)(Sigma公司);琼脂粉购自日本Agar公司;1640培养基(Hyclone公司);特级胎牛血清(杭州四季青公司);青霉素、链霉素(Hyclone公司);T4DNALigase(Fermentas公司);胶回收试剂盒(北京天根公司);肿瘤鼠抗人POT1单克隆抗体,羊抗鼠二抗IgG购自美国的SantaCruz公司;蛋白裂解液(江苏碧云天公司);G418(日本Amresco公司产品);硝酸纤维素膜(晶美公司);显影液和定影液(购自柯达);其它试剂均为国产分析纯。
1.2 方法 实验分4组,分别为:肿瘤细胞MCF-7人乳腺癌细胞株姜黄醇组;肿瘤细胞MCF-7人乳腺癌细胞株对照组;MCF-10A正常乳腺上皮细胞姜黄醇组;MCF-10A正常乳腺上皮细胞对照组。2组黄醇组分别使用姜黄醇处理,其余2组对照组不做处理。
1.2.1 肿瘤细胞培养:培养基包含灭活的胎牛血清(10%),100U/mL青链霉素的RPMI1640培养基,培养条件为37℃、5%CO2,让肿瘤贴壁生长。待细胞融合度达90%后进行传代培养。
1.2.2 细胞周期检测:通过碘化丙啶(propidium,PI)可以与DNA结合产生荧光强度与DNA含量成正比的原理计算细胞周期的分布情况。以细胞周期检测试剂盒说明书为基础进行具体操作。
1.2.3 端粒酶活性的检测:采用TRAP-PCR-ELISA法检测细胞前后端粒酶活性的变化。以Telo TAGGG Telomerase PCR ELISA Kit试剂盒说明书为基础进行操作。
1.2.4 克隆形成实验测定肿瘤细胞的放射敏感性:采用肿瘤集落形成法测定肿瘤细胞的克隆形成率,方法如下:收集进入对数生长期的肿瘤细胞,经0.25%胰蛋白酶与0.02%EDTA混合液消化后制成单细胞的悬液。将肿瘤细胞制成单细胞悬液,后用细胞计数仪计数。单细胞悬液行倍比稀释成所需的细胞浓度。按照预定照射剂量的大小,将不同数目的(102~105个/mL)细胞接种于50mL的塑料培养瓶内,每瓶放入8mL含胎牛血清的培养液。将消化后的细胞放置于37℃的CO2培养箱中静置,时间:4~6 h,让细胞贴壁生长以备用。按预定的剂量分别接受0、1、2、3、4、6、8、10 Gy单次剂量照射(射野20 cm×20 cm,SSD=80 cm,60 Co治疗机,以培养瓶细胞贴壁处为剂量参考点),每个剂量点设3个平行样本。将上述经过照射后的细胞置于专用培养箱中下培养14 d,以利于细胞克隆形成,期间不要挪动培养瓶。去掉培养液,然后用1%甲紫无水乙醇溶液固定和染色20min。用PBS溶液液轻洗2~3次,以去除多余的背景,晾干,将培养瓶置于显微镜下观察,在低倍镜视野下计数≥50个细胞低克隆数目。以0Gy细胞组作为对照,计算各个分组的克隆形成率(plating efficiency,PE),其中计算公式为:克隆形成率(PE)=克隆数/接种细胞数×100%。
细胞放射敏感性参数的计算和存活曲线的拟合:实验在相同环境和条件下重复3次。其中2Gy时的放射增敏比(sensitization enhancementratio,SER)SERSF2定义为2Gy时放射组SF/放射干扰组SF。
1.3 统计学方法 应用SPSS13.0和GraphPad Prism 5.0统计软件以多靶单击模型(muti-target single-hitmodel)和线形二次模型(liner-quadratic model)分别拟合实验数据,绘制生存曲线,计算放射生物学参数SF2,实验重复3次。
2 结果
2.1 姜黄醇对MCF-7及MCF-10A细胞增殖的影响 如图1所示,在使用姜黄醇处理后,MCF-7乳腺癌细胞的增殖速度变慢,随着时间的延长其增殖率不断下降,在72 h左右达到平台期。这一结果表明,姜黄醇对MCF-7乳腺癌细胞株具有明显的增殖抑制作用,且这种作用在给药72 h候达到一个平台期,这为将来姜黄醇用于乳腺癌的治疗以及放射增敏所需的时间窗口提供了实验依据。
对正常乳腺上皮细胞MCF-10A而言,本研究通过细胞增殖曲线可以观察到,在使用姜黄醇处理后,MCF-10A细胞的增殖速度未见明显降低,整体呈现一个平稳下降的过程,随着时间的延长其增殖率不断下降,但同样在72 h左右达到持续的高峰,在72 h以后其增殖率呈现上升的趋势。这一结果表明,姜黄醇对正常组织来源的乳腺上皮细胞增殖率的影响较小,且在72 h处理后会进入一个相对平稳的平台期,这一时间区间与MCF-7乳腺癌细胞的抑制率是一致的。
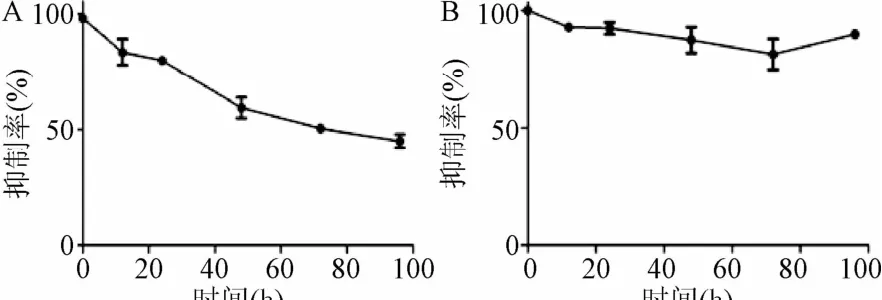
图1 姜黄醇处理后MCF-7乳腺癌细胞(A)及MCF-10A正常乳腺上皮细胞(B)的增殖曲线(姜黄醇/对照组)Fig.1 Proliferation curve of breast cancer cells MCF-7(A)and normal breast epithelial cells MCF-10A(B)after turmeric alcohol treatment(turmeric alcohol/control group)
2.2 姜黄醇对MCF-7乳腺癌细胞株及正常乳腺上皮细胞MCF-10A放射敏感性的影响 联合应用多靶单击模型和Graphpad 5.0统计绘图软件计算MCF-7细胞SF2,D0值,拟合细胞的存活分数曲线。如图2所示,MCF-7对照组的D0、SF2分别为2.86,0.596;而肿瘤细胞经过姜黄醇处理后,乳腺癌细胞的克隆形成能力明显下降,D0、SF2分别为2.16,0.456,具体表现为多靶单击模型的肩区变窄,存活曲线呈下降的趋势,计算姜黄醇的放射增敏比分别为SERSF2为1.31,SERD0为1.32。这一结果表明,肿瘤细胞经过姜黄醇处理后,肿瘤细胞对DNA损伤修复的能力下降,最终表现为对放射线的敏感性增加。而对正常乳腺上皮MCF-10A细胞而言,联合应用多靶单击模型和Graphpad 5.0统计绘图软件计算SF2,D0值,拟合细胞的存活分数曲线。如图2所示,MCF-10A对照组的D0、SF2分别为3.21,0.678;经过姜黄醇处理后,乳腺癌细胞的克隆形成能力明显下降,D0、SF2分别为3.14、0.682,具体表现为多靶单击模型的肩区变窄,存活曲线呈下降的趋势,计算姜黄醇作用后MCF-10A正常上皮细胞的放射增敏比分别为SERSF20.99,SERD01.02。从拟合曲线的形状来看,姜黄醇作用后细胞存活曲线的肩区和下降趋势都未见明显分离,从放射增敏比的指标来看,也未见明显差异,这一结果显示,姜黄醇对正常乳腺上皮来源的MCF-10A的放射敏感性无明显影响。
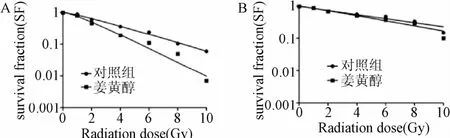
图2 姜黄醇处理后MCF-7乳腺癌细胞(A)及MCF-10A正常乳腺上皮细胞(B)的存活曲线(利用多靶单击模型拟合)Fig.2 Survival curve of breast cancer cells MCF-7(A)and normal breast epithelial cells MCF-10A(B)after turmeric alcohol treatment(muti-target single-hitmodel)
2.3 姜黄醇对端粒酶活性和端粒长度的影响 如图3所示,经过姜黄醇处理后,乳腺癌细胞的端粒长度和端粒酶活性均下降,提示姜黄醇可以作为一种端粒酶抑制剂作用于乳腺癌细胞,这一结果与上述的细胞增殖以及放射敏感性的结果相一致,即端粒长度越长,放射敏感性越低,端粒酶活性越强,放射敏感性越低。
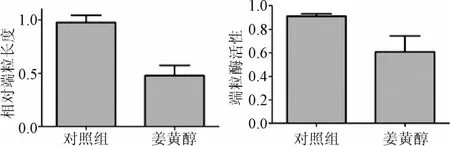
图3 姜黄醇处理后MCF-7乳腺癌细胞端粒长度及MCF-7乳腺癌细胞端粒酶活性的变化Fig.3 Changes of telomere length and breast telomerase activity of breast cancer cells after turmeric alcohol treatment
2.4 姜黄醇对乳腺癌细胞株细胞周期进程的影响 以未经转染的MCF-7作为对照,根据碘化丙啶的DNA染色原理采用流式细胞仪检测siRNA转染MCF-7后24h(MCF-7-siTRF2组)、MCF-7经过4Gy X射线照射后24h(MCF-7-R组)以及转染和射线同时作用组(MCF-7-siTRF2-R组)细胞周期分布情况(见表1)。
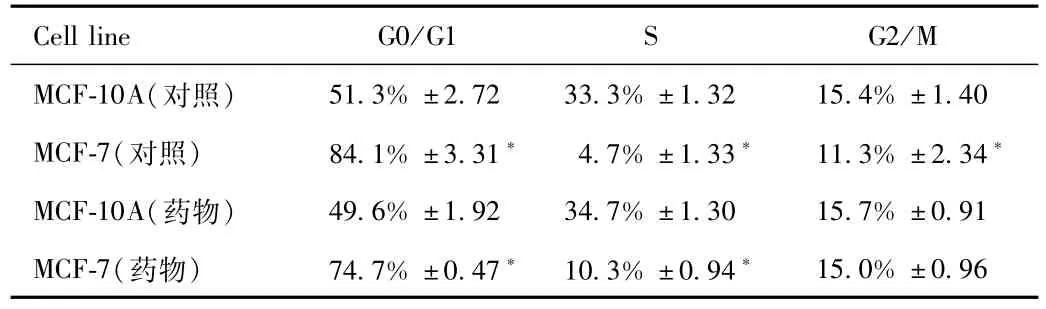
表1 姜黄醇和照射MCF-7细胞后细胞周期分布Tab.1 Cell cycle distribution of MCF-7 cells after turmeric alcohol and irradiation treatment
与MCF-10A相比,MCF-10A经过姜黄醇处理后组G0/G1期细胞比例、S期细胞比例以及G2/M期比例未见明显统计学差异;而MCF-7经过姜黄醇处理后S期细胞比例降低,G2/M期比例增高,且差异具有统计学意义(P<0.05)。这一结果提示姜黄醇对正常细胞的细胞周期分布未见明显影响,而对乳腺癌细胞MCF-7而言,使得更多的肿瘤细胞进入对放射线相对敏感的G2/M期,因此MCF-7获得放射增敏可能与细胞周期的这种再分布有关。
3 讨论
目前研究表明,肿瘤细胞接受2Gy照射后存活分数(SF2)能够区分放射敏感性,并与放疗后患者2年存活率、局部控制率、复发率等密切相关[8-10]。体外培养的细胞株其敏感性高低的差别比较大,SF2可变动在0.01~0.90的范围内。SF2值大,表明细胞对射线的敏感性小;SF2值小,则细胞对射线的敏感性大。本研究中,分别以姜黄醇与MCF-7细胞作用24 h,再分别以不同剂量X射线照射后,相同照射剂量下,实验组集落数和细胞存活分数较空白对照组降低。按照单击多靶模型拟合细胞存活曲线,提示姜黄醇对人乳腺癌细胞株MCF-7均有明显的放射增敏作用,其放疗增敏比(SERDq)为1.71,姜黄醇作用细胞后的SF2、D0、Dq较单纯照射组均明显降低。姜黄醇作用后Dq值最小,代表肿瘤细胞修复能力变弱,意味着肿瘤细胞对放射线的敏感性提高。采用某些药物或者手段促使肿瘤细胞跨过S期并停留在G2/M期,是在生物学行为上提高肿瘤细胞对放射敏感性的一个重要途径[11-13]。本研究中不同浓度姜黄醇作用24 h后,G2/M期细胞比率随着姜黄醇浓度的增加而增加,而S期细胞比率随着姜黄醇浓度的增加而下降,此作用存在明显的剂量依赖性。与对照组相比,单纯放疗组和药物+放疗组的G2/M期细胞比例均明显增多(P<0.05),而药物+放疗组的G2/M期细胞比例又明显高于药物组和单纯放疗组(P<0.05)。说明姜黄醇对MCF-7细胞的周期分布有明显影响,具有G2/M期阻滞作用。
姜黄醇作为放射增敏剂,在提高乳腺癌细胞放射敏感性方面具有明显的理论与实践意义,这一结果显示,从中药制剂中寻找低毒有效的新化合物,可以突破传统观点认为的亲电子性或乏氧增敏剂的理论范围[14]。姜黄醇可以降低端粒酶活性、缩短端粒长度、使得肿瘤细胞更多地进入放射敏感的时相,因此姜黄醇是一种潜在的放射增敏药物。
[1]Anand P,Sundaram C,Jhurani S,et al.Curcumin and cancer:an“oldage”disease with an“age-old”solution[J].Cancer Lett,2008,267(1):133-164.
[2]Kunnumakkara AB,Anand P,Aggarwal BB.Curcumin inhibits proliferation,invasion,angiogenesis and metastasis of different cancers through interaction with multiple cell signaling proteins[J].Cancer Lett,2008,269(2):199-225.
[3]Greenlee RT,Murray T,Bolden S,etal.Cancer statistics,2000[J].CA Cancer JClin,2000,50(1):7-33.
[4]Yang L,Parkin DM,Ferlay J,et al.Estimates of cancer incidence in China for 2000 and projections for 2005[J].Cancer Epidemiol Biomarkers Prev,2005,14(1):243-250.
[5]Koo JY,Kim HJ,Jung KO,et al.Curcumin inhibits the growth of AGS human gastric carcinoma cells in vitro and shows synergism with 5-fluorouracil[J].JMed Food,2004,7(2):117-121.
[6]Aggarwal S,Takada Y,Singh S,et al.Inhibition of growth and survival of human head and neck squamous cell carcinoma cells by curcumin viamodulation of nuclear factor-kappaB signaling[J].Int J Cancer,2004,111(5):679-692.
[7]Radhakrishna PG,Srivastava AS,Hassanein TI,et al.Induction of apoptosis in human lung cancer cells by curcumin[J].Cancer Lett,2004,208(2):163-170.
[8]Duvoix A,Morceau F,Delhalle S,et al.Induction of apoptosis by curcumin:mediation by glutathione S-transferase P1-1 inhibition[J]. Biochem Pharmacol,2003,66(8):1475-1483.
[9]Jiang MC,Yang-Yen HF,Yen JJ,et al.Curcumin induces apoptosis in immortalized NIH 3T3 and malignant cancer cell lines[J].Nutr Cancer,1996,26(1):111-120.
[10]Aggarwal BB,Harikumar KB.Potential therapeutic effects of curcumin,the anti-inflammatory agent,against neurodegenerative,cardiovascular,pulmonary,metabolic,autoimmune and neoplastic diseases[J]. International Journal of Biochemistry&Cell Biology,2009,41(1):40-59.
[11]Strimpakos AS,Sharma RA.Curcumin:Preventive and therapeutic properties in laboratory studies and clinical trials[J].Antioxidants&Redox Signaling,2008,10(3):511-545.
[12]Singh S,Aggarwal BB.Activation of transcription factor NF-kappa B is suppressed by curcumin(diferuloylmethane)[J].JBiol Chem,1995,270(42):24995-25000.
[13]Shishodia S,Amin HM,Lai R,et al.Curcumin(diferuloylmethane)inhibits constitutive NF-kappaB activation,induces G1/S arrest,suppresses proliferation,and induces apoptosis in mantle cell lymphoma[J].Biochem Pharmacol,2005,70(5):700-713.
[14]Bierhaus A,Zhang Y,Quehenberger P,et al.The dietary pigment curcumin reduces endothelial tissue factor gene expression by inhibiting binding of AP-1 to the DNA and activation of NF-kappa B[J].Thromb Haemost,1997,77(4):772-782.
(编校:吴茜)
Effect of combination of radiotherapy w ith turmeric alcohol on human breast cancer cell line MCF-7
WANG Ying1,YIN Yong-mei2
(1.Department of Internal Medicine-Oncology,The First Affiliated Hospital of Xinxiang Medical University,Henan 453100,China;2.Nanjing Medical University,Nanjing 210029,China)
ObjectiveTo study the turmeric alcohol of natural herbal extract alone or in combination with radiotherapy on growth inhibitory effect,changes in tumor cell colony formation,cell cycle distribution and the impactof specific proteins of human breast cancer cell line MCF-7.MethodsThere were four groups:human breast cancer cell line MCF-7-turmeric alcohol group;human breast cancer cell line MCF-7-control group;normal breast epithelial cells MCF-10A-turmeric alcohol group;normal breast epithelial cells MCF-10A-control group.Turmeric alcohol toxicity was detected by cell proliferation assay method CCK-8;radiosensitivity ofMCF-7 cellswas observed by clone-forming assay;cell cycle distribution of breast cancer cells(the cells ratio in the G1,S,G2)was detected by flow cytometry in each group;telomerase activity and telomere length changesweremeasured before and after administration.ResultsThe results showed that turmeric alcohol of the growth of MCF-7 breast cancer cells was significantly inhibited,and the inhibitory effectwas time and dose-dependent,and reached a plateau at 72 hours;while the effect of turmeric alcohol on proliferation of normal mammary epithelial cell line MCF-10A was not significantly.Colony-forming ability,radiosensitivity was significantly impacted after turmeric alcohol treatment of breast cancer cell MCF-7 that turmeric alcohol combined with radiosensitivity could significantly reduce the colony formation rate of MCF-7 cells after radiotherapy;sensitivity enhance mentratios of turmeric alcohol were 1.31 of SERSF2,1.32 of SERD0.Conclusion Turmeric alcohol could increase the radiosensitivity of human breast cancer cell line MCF-7,and itsmechanism of radiosensitization may be associated with telomerase activity reducing,telomere shortening and cell cycle distribution.Meanwhile,turmeric alcohol have no obvious influence on normal breast epithelial cell MCF-10A proliferation,radiosensitivity and cell cycle distribution were observed.Turmeric alcoholmay be used as a viable future clinical treatment of breast cancer radiation sensitizer.
radiation resistance;turmeric alcohol;radiosensitivity;breast cancer
王颖,女,硕士,主治医师,研究方向:恶性肿瘤的综合治疗,E-mail:122509545@qq.com。
R285.5
A
1005-1678(2014)08-0073-04
国家自然科学基金(81172503)

